超聲波協同酶解提取壇紫菜藻紅蛋白工藝優化
孔祥佳 - 吳秋瑩 - 謝 勇 林 埔 劉智禹 -
(1. 福建中醫藥大學藥學院,福建 福州 350122;2. 福建省水產研究所,福建 廈門 361013) (1. College of Pharmacy, Fujian University of Traditional Chinese Medicine, Fuzhou, Fujian 350122, China; 2. Fisheries Reasearch Instiute of Fujian, Xiamen, Fujian 361013, China)
超聲波協同酶解提取壇紫菜藻紅蛋白工藝優化
孔祥佳1KONGXiang-jia1吳秋瑩1WUQiu-ying1謝 勇1XIEYong1林 埔1LINPu1劉智禹2LIUZhi-yu2
(1. 福建中醫藥大學藥學院,福建 福州 350122;2. 福建省水產研究所,福建 廈門 361013) (1.CollegeofPharmacy,FujianUniversityofTraditionalChineseMedicine,Fuzhou,Fujian350122,China; 2.FisheriesReasearchInstiuteofFujian,Xiamen,Fujian361013,China)
采用單因素試驗和響應面法確定壇紫菜藻紅蛋白提取的最佳工藝條件。通過單因素試驗探討加酶量、超聲時間、超聲功率、pH、固液比對藻紅蛋白得率和純度的影響,并根據單因素試驗結果固定pH為5.0、固液比為1∶40 (g/mL),同時選取加酶量、超聲時間和超聲功率為影響因素進行響應面優化試驗,確定壇藻紅蛋白的最優提取工藝參數為:加酶量0.05 g、超聲時間40 min、超聲功率為額定功率的90%(450 W)。該條件下藻紅蛋白的得率和純度分別為(1.808±0.007)%和0.460±0.001。
壇紫菜;藻紅蛋白;超聲波;纖維素酶
海藻中含有豐富的參與光合作用的捕光色素,主要包含葉綠素、類胡蘿卜素和藻膽蛋白[1]。藻膽蛋白是一種水溶性捕光色素蛋白,按其最大特征吸收峰和呈色類型不同,又分為藻紅蛋白(phycoerythrins,PE;λmax=540~570 nm;紫粉色)、藻藍蛋白(phycocyanins,PC;λmax=610~620 nm;藍色)、別藻藍蛋白(allophycocyanins,APC;λmax=650~655 nm;藍綠色)、藻紅藍蛋白(phycoerythrocyanins,PEC;λmax=560~600 nm;橙色)四類[1][2]1。其中,對藻紅蛋白的研究最多,并已廣泛運用于食品色素添加劑[3-4]、熒光探針[3-4]、抗氧化[5]、抗腫瘤[5]等生物醫學工程領域。紫菜是世界上分布較廣的大型經濟海藻之一,含有豐富的藻紅蛋白,可為提取分離藻紅蛋白提供優質的原材料[2]3-4,12[6-7]。在藻紅蛋白的分離技術中,合理有效地破碎原材料細胞膜和細胞壁結構尤為重要,已報道的提取方法有酶解法[6,8]、超聲波法[7]、溶脹法[7,9]、反復凍融法[7,10]等。但施瑛等[6]所采用的復合酶法提取紫菜藻紅蛋白需耗時7.2 h;何思佳等[7]對比溶脹法及反復凍融法提取條斑紫菜藻紅蛋白分別耗時1 440 min 和120 min×5次,且提取率低。而超聲波法是利用超聲波的空化效應和機械作用破碎原材料的細胞膜和細胞壁結構,具有提取率高、提取時間短等優點[7,11-14]。同時,纖維素酶利用酶催化反應的專一性降解原材料細胞壁中的纖維素從而破壞細胞壁結構,具有提取率高、提取溫度低等優點。但目前將二者結合用于紫菜藻紅蛋白提取的報道較少。本試驗擬以福建省廣泛分布的壇紫菜(Porphyrahaitanensis)為試材,采用超聲波協同纖維素酶提取壇紫菜中的藻紅蛋白,利用響應面法對提取工藝進行優化,以期為開展壇紫菜有效物質研發及藻紅蛋白大規模生產提供理論依據。
1 材料與方法
1.1 材料與試劑
壇紫菜:福建省水產研究所;
纖維素酶:10 000 U/g,上海阿拉丁生化科技股份有限公司;
濃鹽酸:分析純,國藥集團化學試劑有限公司。
1.2 儀器與設備
臺式離心機:TDL80-2B型,上海安亭科學儀器廠;
恒溫水浴鍋:KD-600S型,上海精宏實驗設備有限公司;
電子分析天平:CP144型,上海奧豪斯儀器有限公司;
紫外可見分光光度計:UV9100型,北京瑞利分析儀器公司;
中藥粉碎機:FW177型,天津市泰斯特儀器有限公司;
數控超聲波清洗器(額定超聲功率為500 W):KQ-500DE型,昆山市超聲儀器有限公司;
pH計:PHS-3C型,上海儀電科學儀器股份有限公司;
磁力加熱攪拌器:CJJ79-1型,金壇市白塔新寶儀器廠。
1.3 試驗方法
1.3.1 藻紅蛋白提取工藝流程
壇紫菜干→粉碎→過篩(60目)→按比例加入蒸餾水→調pH→添加纖維素酶酶解→超聲波提取→離心→取上清液→檢測藻紅蛋白得率和純度
1.3.2 壇紫菜藻紅蛋白得率和純度的測定 參照施瑛等[6]的方法,按式(1)、(2)計算壇紫菜藻紅蛋白的得率和純度。
(1)
式中:
ρPE——提取稀釋液中藻紅蛋白的質量-體積濃度,mg/mL;
A560 nm、A617 nm、A650 nm——提取稀釋液在560,617,650 nm 的吸光值;
W——藻紅蛋白得率,%;
n——稀釋倍數;
VPE——提取液的體積,mL;
MPE——壇紫菜干品的質量,g。
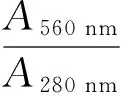
(2)
式中:
P——藻紅蛋白純度;
A280 nm、A560 nm——提取稀釋液在280,560 nm的吸光值。
1.3.3 單因素條件對壇紫菜藻紅蛋白得率和純度的影響
(1) 加酶量:取2.0 g壇紫菜粉末,共8份,固液比1∶40(g/mL),調pH至5.0,分別加入纖維素酶0.01,0.02,0.03,0.04,0.05,0.06,0.07,0.08 g,35 ℃酶解1 h后,于20 ℃下超聲浸提30 min,超聲功率為額定功率的70%(即350 W),10 000 r/min 離心5 min,取上清液,檢測藻紅蛋白得率和純度。
(2) 超聲時間:取2.0 g壇紫菜粉末,共5份,固液比1∶40 (g/mL),調pH至5.0,加入纖維素酶0.02 g,35 ℃酶解1 h 后,分別于20 ℃下超聲浸提20,30,40,50,60 min,超聲功率為額定功率的70%,10 000 r/min離心5 min,取上清液,檢測藻紅蛋白得率和純度。
(3) 超聲功率:取2.0 g壇紫菜粉末,共5份,固液比1∶40 (g/mL),調pH至5.0,加入纖維素酶0.02 g,35 ℃酶解1 h 后,于20 ℃下超聲浸提30 min,超聲功率分別為額定功率的60%,70%,80%,90%,100%(即300,350,400,450,500 W),10 000 r/min離心5 min,取上清液,檢測藻紅蛋白得率和純度。
(4) pH:取2.0 g壇紫菜粉末,共5份,固液比1∶40 (g/mL),分別調pH至4.0,4.5,5.0,5.5,6.0,加入纖維素酶0.02 g,35 ℃酶解1 h后,于20 ℃下超聲浸提30 min,超聲功率為額定功率的70%,10 000 r/min離心5 min,取上清液,檢測藻紅蛋白得率和純度。
(5) 料液比:取2.0 g壇紫菜粉末,共5份,固液比分別為1∶20,1∶30,1∶40,1∶50,1∶60 (g/mL),調pH至5.0,加入纖維素酶0.02 g,35 ℃酶解1 h后,于20 ℃下超聲浸提30 min,超聲功率為額定功率的70%,10 000 r/min離心5 min,取上清液,檢測藻紅蛋白得率和純度。
1.3.4 響應面優化試驗 根據單因素試驗結果與分析設計響應面試驗,進一步優化超聲波協同酶解提取壇紫菜藻紅蛋白的工藝條件。
1.4 數據處理
各指標測定均重復3次,采用Excel進行數據統計,數據以3次獨立樣品測定結果的平均值±標準差表示,并采用ANOVA程序用于方差分析。
2 結果與分析
2.1 加酶量對壇紫菜藻紅蛋白得率和純度的影響
在酶催化反應環境(溫度、底物濃度、pH)一定時,酶促反應與加酶量呈正比,但隨著催化反應進行,底物濃度減少,催化反應速率降低[12]。由圖1可知,當纖維素酶添加量在0.01~0.05 g時,藻紅蛋白得率升高、純度增加;當加酶量為0.05 g時,藻紅蛋白的得率和純度最高,分別為1.469%和0.406;但隨著纖維素酶添加量的進一步增加,藻紅蛋白得率和純度降低。綜合考慮工業生產成本及藻紅蛋白得率和純度,選擇纖維素酶添加量0.04,0.05,0.06 g作進一步研究。
2.2 超聲時間對壇紫菜藻紅蛋白得率和純度的影響
由圖 2可知,壇紫菜藻紅蛋白的得率和純度均隨超聲時間的延長呈先升后降的趨勢。超聲提取20~30 min時,由于超聲時間短,壇紫菜細胞壁破壞不完全,藻紅蛋白溶出率較低;當超聲提取40 min時,藻紅蛋白得率和純度均達到最大,分別為1.298%和0.402;當超聲提取50~60 min時,藻紅蛋白得率和純度快速降低,可能與超聲時間過長導致藻紅蛋白結構被破壞有關。綜合考慮生產時間成本及藻紅蛋白得率和純度,選擇超聲時間30,40,50 min作進一步研究。
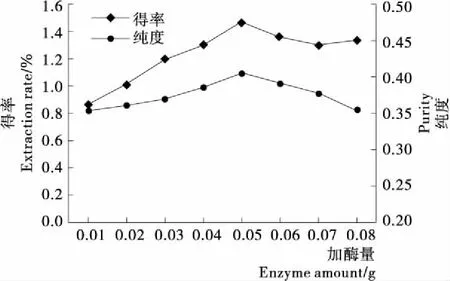
圖1 加酶量對壇紫菜藻紅蛋白得率和純度的影響
Figure 1 Effect of enzyme amount on the extraction rate and purity of phycoerythrin fromPorphyrahaitanensis
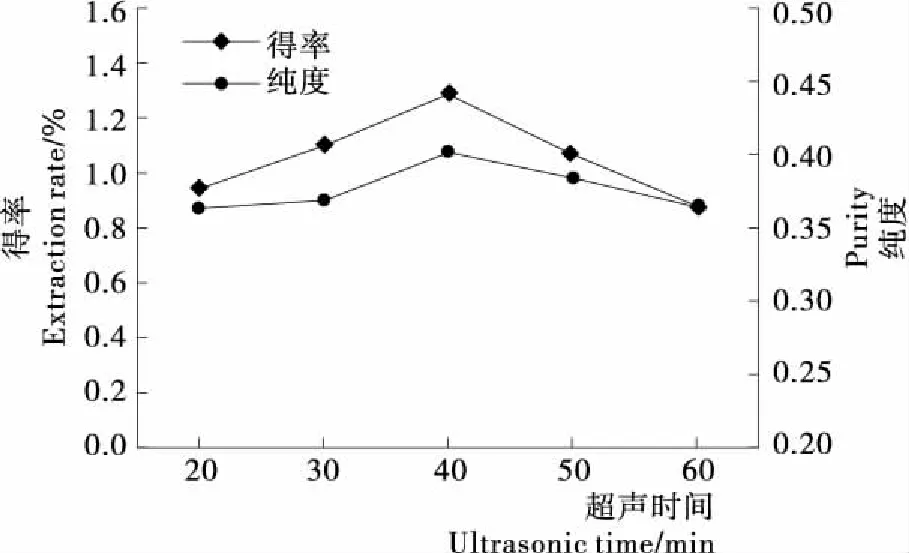
圖2 超聲時間對壇紫菜藻紅蛋白得率和純度的影響
Figure 2 Effect of ultrasonic time on the extraction rate and purity of phycoerythrin fromPorphyrahaitanensis
2.3 超聲功率對壇紫菜藻紅蛋白得率和純度的影響
超聲功率影響超聲作用,超聲功率越高,空化強度越大,超聲效果越好,有效成分分離越快。由圖3可知,藻紅蛋白得率隨著超聲功率的不斷增加而增大,當達到額定功率的100%時,藻紅蛋白得率最高(1.380%)。但藻紅蛋白純度隨超聲功率的不斷增加呈先升高后降低的趨勢;超聲功率為額定功率的60%~90%時,藻紅蛋白純度快速增加;當超聲功率為額定功率的90%時,藻紅蛋白純度達到最大(0.398);而隨著超聲功率的繼續升高,藻紅蛋白純度降低,可能與超聲功率過高導致提取物中其它雜質溶出有關。綜合考慮能量消耗成本及藻紅蛋白得率和純度,選擇超聲功率為額定功率的80%,90%,100%作進一步研究。
2.4 pH對壇紫菜藻紅蛋白得率和純度的影響
由圖4可知,壇紫菜藻紅蛋白的得率和純度均隨pH值的增加先升高后降低,且在pH為5.0時,藻紅蛋白的得率和純度達到最大,分別為1.001%和0.367。這是由于pH影響纖維素酶的活性,過酸或過堿的溶液均會降低纖維素酶的活性,導致藻紅蛋白得率和純度降低。進一步分析表明,在相同提取條件下,pH值對藻紅蛋白得率和純度的影響顯著(P<0.05)低于加酶量、超聲時間、超聲功率;因此,優化試驗時固定酶解反應pH為5.0。
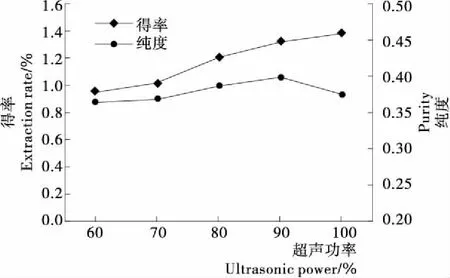
圖3 超聲功率對壇紫菜藻紅蛋白得率和純度的影響
Figure 3 Effect of ultrasonic power on the extraction rate and purity of phycoerythrin fromPorphyrahaitanensis
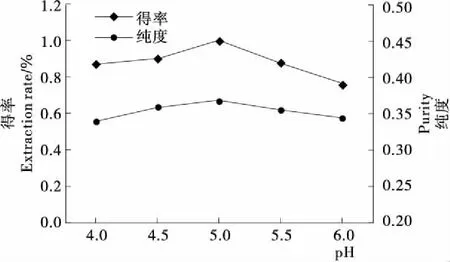
圖4 pH對壇紫菜藻紅蛋白得率和純度的影響
Figure 4 Effect of pH on the extraction rate and purity of phycoerythrin fromPorphyrahaitanensis
2.5固液比對壇紫菜藻紅蛋白得率和純度的影響
由圖5可知,壇紫菜藻紅蛋白的得率和純度均隨液固比的增大呈先升后降的趨勢。當固液比為1∶40 (g/mL)時,藻紅蛋白的得率最高(1.008%);當固液比為1∶30 (g/mL)時,藻紅蛋白的純度最大(0.376)。說明溶劑用量低,固液兩相間的濃度差小,傳質推動力弱,無法充分提取壇紫菜中的藻紅蛋白;溶劑用量高,雖可增大固液兩相間的濃度差,但也導致提取物中其它雜質的溶出,從而降低藻紅蛋白的純度。進一步分析表明,在相同提取條件下,固液比對藻紅蛋白得率和純度的影響顯著(P<0.05)低于加酶量、超聲時間、超聲功率;且固液比為1∶30 (g/mL)時藻紅蛋白的純度與固液比為1∶40 (g/mL)時差異不顯著(P>0.05);因此,優化試驗時固定固液比為1∶40 (g/mL)。
2.6 響應面試驗結果
2.6.1 Box-Behnken試驗設計及結果 根據單因素試驗結果及分析,鑒于pH值及固液比對壇紫菜藻紅蛋白得率和純度的影響較小,故采用響應面法優化壇紫菜藻紅蛋白提取工藝時,考察加酶量、超聲時間和超聲功率對壇紫菜藻紅蛋白得率和純度的影響。響應面試驗設計因素及水平見表1,試驗設計方案及數據處理結果見表2。
2.6.2 模型建立及顯著性分析 按照Box-Behnken試驗設計的統計學要求,對試驗數據進行二次多元回歸擬合,獲得項目指標對影響因子的關系為:
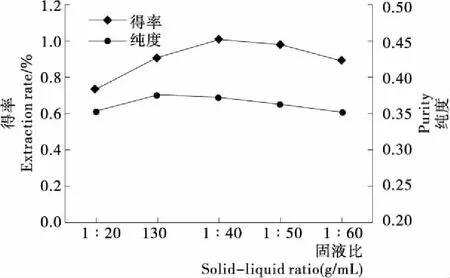
圖5 固液比對壇紫菜藻紅蛋白得率和純度的影響
Figure 5 Effect of solid-liquid ratio on the extraction rate and purity of phycoerythrin fromPorphyrahaitanensis
Y1=1.81+0.052X1-0.026X2+0.066X3+0.007X1X2-0.03X1X3-0.012X2X3-0.14X12-0.22X22-0.011X32,
(3)
Y2=0.46+0.009X1+0.001X2-0.008X3-0.002X1X2+0.014X1X3+0.005X2X3-0.018X12-0.038X22-0.027X32。
(4)
為檢驗上述二次多元回歸方程的有效性,進一步對超聲波協同酶解提取壇紫菜藻紅蛋白得率和純度的系數和回歸模型進行方差分析,結果見表3、4。
由表3可知,回歸方程中的一次項X1、X2、X3對Y1的影響極顯著(P<0.01),X1對Y2的影響極顯著(P<0.01),X3對Y2的影響顯著(P<0.05),但X2對Y2的影響不顯著(P>0.05);回歸方程中的二次項X12、X22對Y1的影響極顯著(P<0.01),X32對Y1的影響顯著(P<0.05),且X12、X22、X32對Y2的影響極顯著(P<0.01);交互項X1X2對Y1、Y2及X2X3對Y2的影響不顯著(P>0.05),但X1X3對Y1、Y2的影響極顯著(P<0.01),X2X3對Y1的影響顯著(P<0.05)。

表1 響應面試驗設計因素及水平Table 1 Factors and levels ofresponse surface experiments design
由表4可知,回歸模型的P<0.01,說明二次回歸方程模型極顯著;Y1、Y2的相關系數R2分別為0.988 5,0.977 1,表明藻紅蛋白的得率和純度實際值與預測值誤差小;調整相關系數RAdj2分別為0.996 5,0.947 6,表明藻紅蛋白得率和純度的模型僅有0.003 5,0.002 4不能用上述二次多元回歸方程模擬;且適合度缺損項P>0.05為不顯著,進一步說明回歸模型與實際情況擬合程度高。
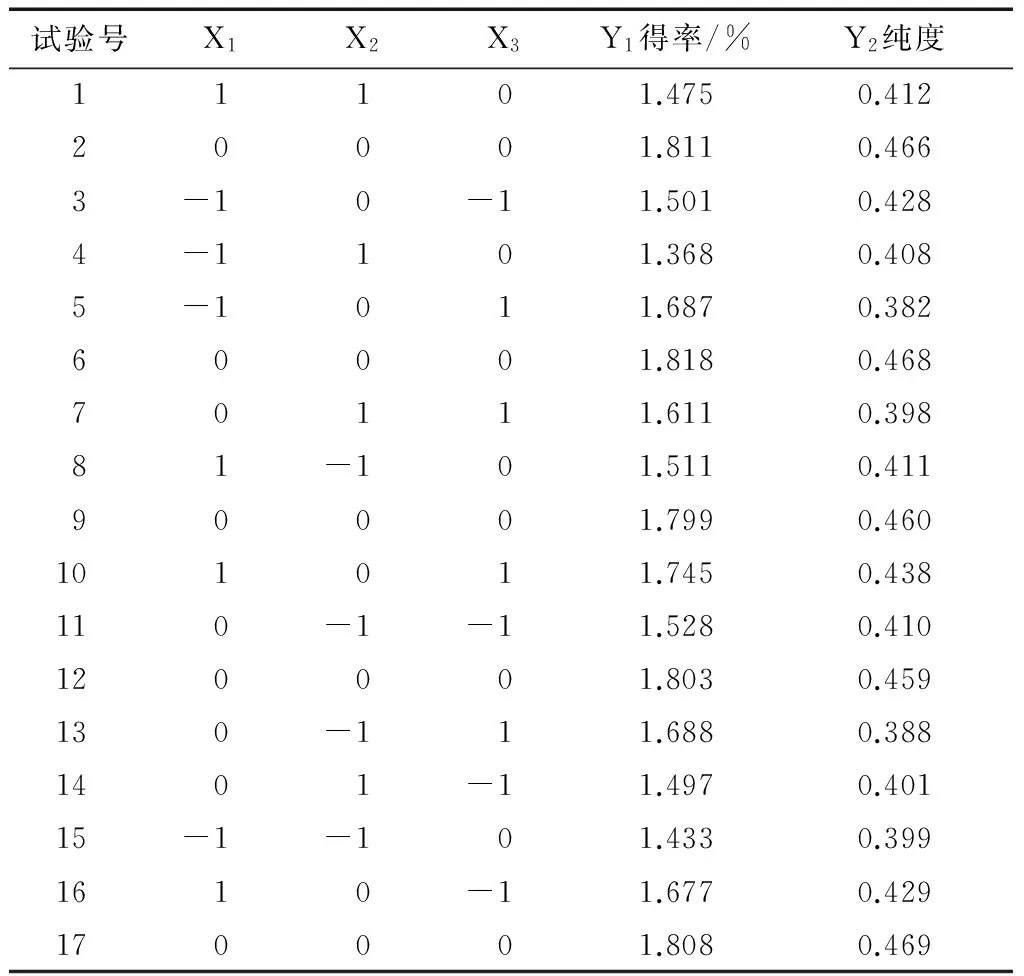
表2 響應面試驗設計方案及數據處理結果Table 2 Design and results of response surface experiments
表3超聲波協同酶解提取壇紫菜藻紅蛋白得率和純度系數的方差分析
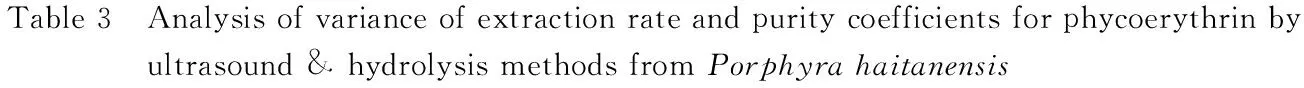
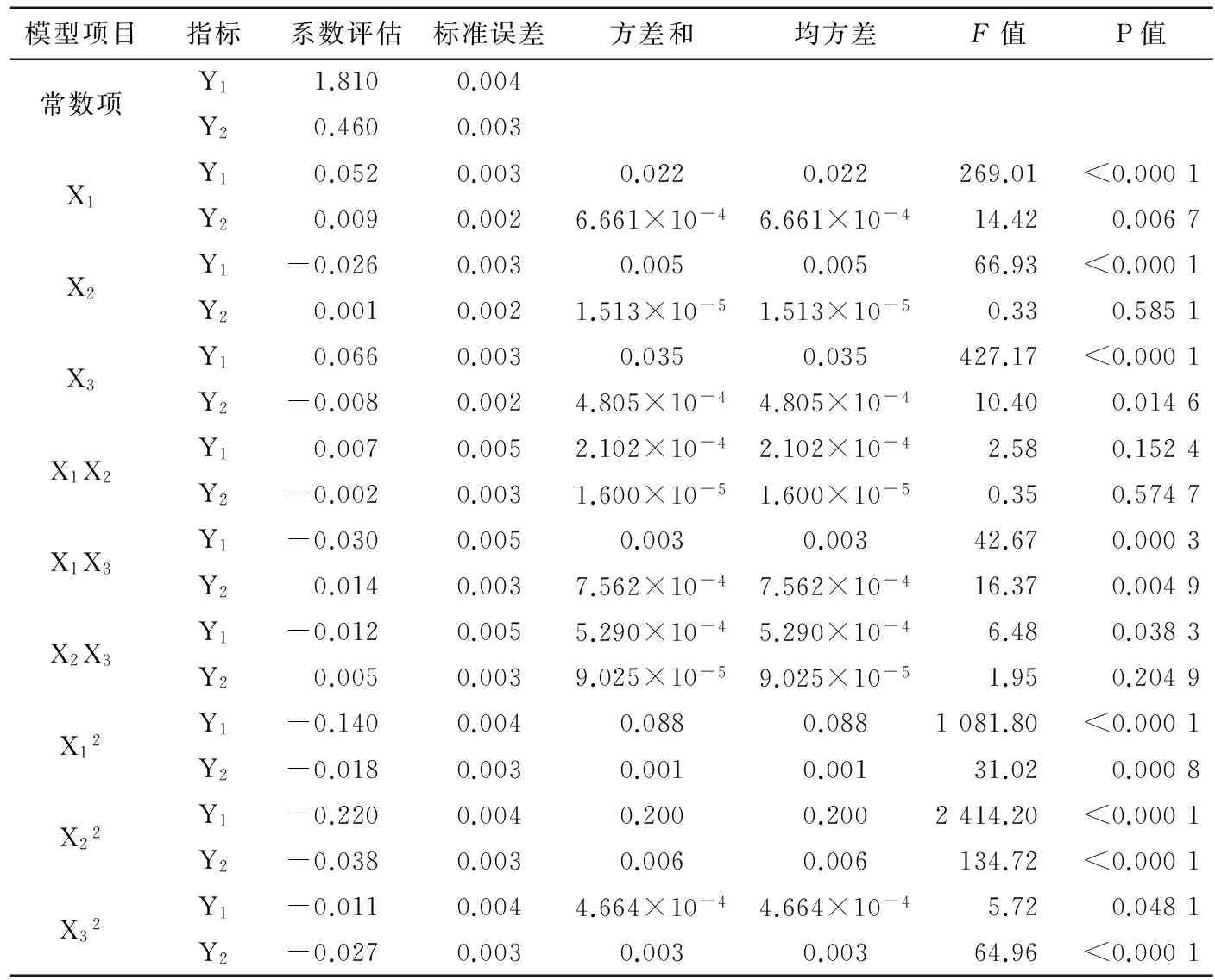
模型項目指標系數評估標準誤差方差和均方差F值P值常數項X1X2X3X1X2X1X3X2X3X12X22X32Y11.8100.004Y20.4600.003Y10.0520.0030.0220.022269.01<0.0001Y20.0090.0026.661×10-46.661×10-414.420.0067Y1-0.0260.0030.0050.00566.93<0.0001Y20.0010.0021.513×10-51.513×10-50.330.5851Y10.0660.0030.0350.035427.17<0.0001Y2-0.0080.0024.805×10-44.805×10-410.400.0146Y10.0070.0052.102×10-42.102×10-42.580.1524Y2-0.0020.0031.600×10-51.600×10-50.350.5747Y1-0.0300.0050.0030.00342.670.0003Y20.0140.0037.562×10-47.562×10-416.370.0049Y1-0.0120.0055.290×10-45.290×10-46.480.0383Y20.0050.0039.025×10-59.025×10-51.950.2049Y1-0.1400.0040.0880.0881081.80<0.0001Y2-0.0180.0030.0010.00131.020.0008Y1-0.2200.0040.2000.2002414.20<0.0001Y2-0.0380.0030.0060.006134.72<0.0001Y1-0.0110.0044.664×10-44.664×10-45.720.0481Y2-0.0270.0030.0030.00364.96<0.0001
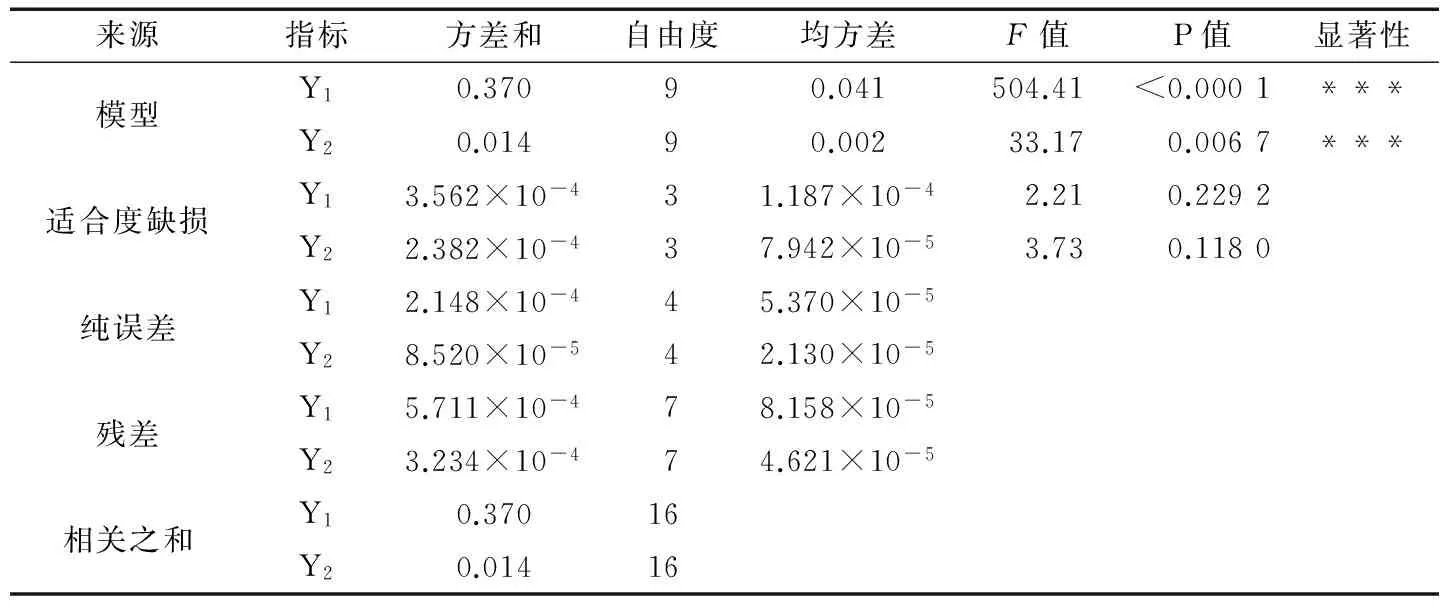
表4 回歸模型的方差分析?Table 4 Analysis of variance of regression model
? ***表示差異極顯著(P<0.01);Y1:R2=0.988 5,RAdj2=0.996 5;Y2:R2=0.977 1,RAdj2=0.947 6。
2.6.3 響應面交互作用分析 響應面圖可直觀地體現各影響因子對項目指標的影響[15]。由圖6、7可知,超聲波協同酶解提取壇紫菜藻紅蛋白的影響因子對藻紅蛋白得率和純度的影響不同。其中,圖6(a)和圖7(a)的響應面圖曲面坡度平緩,等高線排列稀疏且趨于圓形,表示X1、X2對Y1、Y2的交互影響小;圖6(b)和圖7(b)的響應面圖曲面坡度陡峭,等高線排列緊密切趨于橢圓形,說明X1、X3對Y1、Y2的交互影響大;圖6(c)和圖7(c)表明,X2和X3對Y1存在交互作用,但X2、X3對Y2交互作用不顯著。

圖6 提取條件對壇紫菜藻紅蛋白得率交互影響的曲面圖及等高線圖

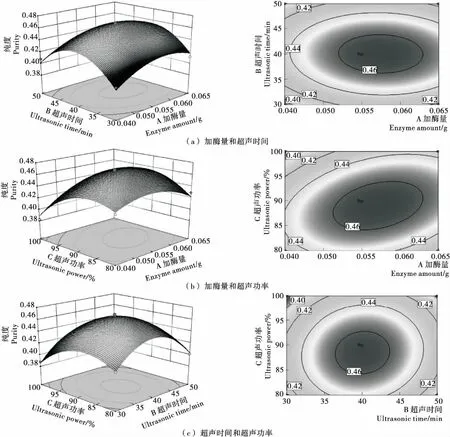
圖7 提取條件對壇紫菜藻紅蛋白純度交互影響的曲面圖及等高線圖

2.6.4 提取參數優化及模型驗證 通過采用Box-Behnken試驗設計以及Design-Expert 8.0分析軟件對藻紅蛋白得率和純度回歸模型進行分析,得出超聲波協同酶解提取壇紫菜藻紅蛋白最優組合為:加酶量0.05 g、超聲時間39.79 min、超聲功率為額定功率的91.07%(額定功率為500 W);在此操作條件下,藻紅蛋白的得率為1.819%,純度為0.465。考慮實際操作的可行性,最優提取參數調整為:加酶量0.05 g、超聲時間40 min、超聲功率為額定功率的90%,藻紅蛋白理論得率為1.810%,純度為0.460;在此條件下通過3 次平行實驗驗證,得出藻紅蛋白實際得率和純度分別為(1.808±0.007)%和0.460±0.001,實際值與理論值相差極小。因此認為,本試驗所建立的回歸模型可較好預測壇紫菜藻紅蛋白的得率和純度。
3 結論
通過試驗優化得出超聲波協同酶解提取壇紫菜藻紅蛋白的最佳工藝參數為:pH 5.0、固液比1∶40 (g/mL),加酶量0.05 g,超聲時間40 min,超聲功率為額定功率的90%;該條件下藻紅蛋白的得率和純度分別為(1.808±0.007)%和0.460±0.001。在超聲波協同纖維素酶酶解的雙重作用下,可有效縮短壇紫菜藻紅蛋白的提取時間,有利于大批量的工業化生產。但在采用超聲波破壁的過程中,部分聲能可轉化為熱能從而引起藻紅蛋白提取液的溫度升高,而且超聲波的空穴作用,可能會導致藻紅蛋白結構和生物活性發生變化。因此,在后續研究中,將借助傅里葉紅外光譜、掃描電子顯微鏡觀察以及化學分析等方法探討超聲波協同酶解對藻紅蛋白結構和生物活性的影響。
[1] MUNIER M, MORANCAIS M, DUMAY J, et al. One-step purification of R-phycoerythrin from the red edible seaweedGrateloupiaturuturu[J]. Journal of Chromatography B, 2015, 992: 23-29.
[2] 李春霞. 壇紫菜藻紅蛋白規模制備、結構鑒定及體外抗腫瘤活性研究[D]. 上海: 上海海洋大學, 2012.
[3] SEKAR S, CHANDRAMOHAN M. Phycobiliproteins as a commodity: trends in applied research, patents and commercializa-tion[J]. Journal of Applied Phycology, 2008, 20(2): 113-136.
[4] DUMAY J, MORAN?AIS M, MUNIER M, et al. Chapter eleven-phycoerythrins: valuable proteinic pigments in red seaweeds[J]. Advances in Botanical Research, 2014, 71: 321-343.
[5] PANGESTUTI R, KIM S K. Biological activities and health benefit effects of natural pigments derived from marine algae[J]. Journal of Functional Foods, 2011, 3: 255-266.
[6] 施瑛, 裴斐, 周玲玉, 等. 響應面法優化復合酶法提取紫菜藻紅蛋白工藝[J]. 食品科學, 2015, 36(6): 51-57.
[7] 何思佳, 王洪新, 王遠輝. 條斑紫菜藻紅蛋白提取工藝的研究[J]. 食品工業科技, 2011(11): 334-338.
[8] DUMAY J, CLéMENT N, MORAN?AIS M, et al. Optimiz-ation of hydrolysis conditions ofPalmariapalmatato enhance R-phycoerythrin extraction[J]. Bioresource Technology, 2013, 131: 21-27.
[9] 蔡春爾, 李春霞, 藤一悅, 等. 條斑紫菜藻紅蛋白粗提方法比較[J]. 上海海洋大學學報, 2012, 21(3): 368-373.
[10] SENTHILKUMAR N, SURESH V, THANGAM R, et al. Isolation and characterization of macromolecular protein R-Phycoerythrin fromPortieriahornemannii[J]. International Journal of Biological Macromolecules, 2013, 55(8): 150-160.
[11] 付復華, 袁洪燕, 潘兆平, 等. 黃桃超聲波輔助酶法去皮工藝優化及其品質分析[J]. 食品與機械, 2016, 32(8): 182-187.
[12] 孔祥佳, 連至楠. 楊梅清汁加工中的酶解工藝研究[J]. 江蘇農業科學, 2017, 45(12): 131-134.
[13] 孔祥佳, 劉廉榮. 超聲波乙醇浸提法提取橄欖葉總多酚工藝的研究[J]. 福建中醫藥, 2017, 48(2): 34-37.
[14] 徐穎, 樊凡, 陰鵬濤, 等. 紫薯花青素超聲波輔助酶法提取工藝優化及其抗氧化性研究[J]. 食品與機械, 2017, 33(3): 150-154.
[15] 徐效圣, 潘儼, 傅力, 等. 響應面法優化水酶法提取核桃油的工藝條件[J]. 食品與機械, 2010, 26(2): 92-96.
OptimizationofphycoerythrinextractionfromPorphyrahaitanensisbyultrasound&hydrolysis
The optimization of phycoerythrin extraction fromPorphyrahaitanensiswere investigated by single experiments and response surface methodology. The single experiments were used to explore the effects on the extraction rate and purity of phycoerythrin by different enzyme amount, ultrasonic time, ultrasonic power, pH and solid-liquid ratio. The best pH and solid-liquid ratio were determined as 5.0 and 1∶40 (g/mL), respectively. Meanwhile, the enzyme amount, ultrasonic time and ultrasonic power were investigated through response surface experiment. The optimal extraction conditions were determined as follows: enzyme amount 0.05 g, ultrasonic time 40 min and ultrasonic power 90% of the rated one. Under these conditions, the extraction rate and purity of phycoerythrin were reached (1.808±0.007)% and 0.460±0.001, respectively.
Porphyrahaitanensis; phycoerythrin; ultrasound; cellulase
農業行業標準制定和修訂(編號:181721301092371054)
孔祥佳(1983—),女,福建中醫藥大學講師,博士。
E-mail: nihaojia2005@126.com
2017—07—14
10.13652/j.issn.1003-5788.2017.09.033

