日糧添加亮氨酸和苯丙氨酸對荷斯坦公犢生長性能及血清代謝物的影響
楊昕澗,曹陽春,鄭辰,劉凱,郭龍,蔡傳江,劉寶龍,姚軍虎
?
日糧添加亮氨酸和苯丙氨酸對荷斯坦公犢生長性能及血清代謝物的影響
楊昕澗,曹陽春,鄭辰,劉凱,郭龍,蔡傳江,劉寶龍,姚軍虎
(西北農林科技大學動物科技學院,陜西楊凌712100)
研究日糧添加亮氨酸和苯丙氨酸對犢牛生長性能和血清代謝物的影響,為亮氨酸和苯丙氨酸在奶牛高效生產中的應用提供理論參考。試驗選取20頭1日齡體重為(38±3)kg的荷斯坦公犢,隨機分為4組,分別為對照組、亮氨酸組(1.435 g·L-1)、苯丙氨酸組(0.725 g·L-1)、混合氨基酸組(1.435 g·L-1亮氨酸和0.725 g·L-1苯丙氨酸),每組5頭牛,各組以丙氨酸調節為等氮日糧。犢牛單獨飼喂,試驗共8周,預試期1周,正試期7周。試驗犢牛單圈飼養,試驗日糧由原奶和開食料組成。犢牛出生后,1 h內飼喂4.0 L初乳。此后1周為過渡期,日喂原奶2次,每次3.0 L。過渡期內以氨基酸添加量的20%為梯度逐天增加,至出生第6 天達到添加量的100%。2—8周為正試期,日飼喂添加氨基酸的原奶2次。第2—3周每次3.5 L,4—8周每次4.0 L。第3周開始定量供給開食料,自由飲水。在犢牛1、3、5、7、8周齡測定體重、體高、體斜長和胸圍,計算體軀指數和體長指數;采集10 mL血液用于獲得血清,并檢測其氨基酸組成、葡萄糖、尿素氮、胰島素和膽囊收縮素。采用IBM SPSS Statistics V22.0 統計軟件GLM過程進行統計分析,采用LSD法進行多重比較。混合氨基酸組平均日增重顯著低于其余3組(<0.05)。相對于對照組,各處理組顯著提高最終體斜長(<0.05)。亮氨酸和苯丙氨酸具有降低最終體高的趨勢(<0.10),而苯丙氨酸顯著降低最終胸圍(<0.05)。與對照組相比,亮氨酸組和混合氨基酸組顯著提高犢牛8周齡體軀指數(<0.05)。但各組犢牛初始體重、體斜長、體高、胸圍、體軀指數、體長指數和最終體重及體軀指數無顯著差異(>0.05)。添加亮氨酸顯著提高血清組氨酸、亮氨酸、蘇氨酸、甘氨酸和總必需氨基酸的濃度(<0.05),趨于增加天冬氨酸和總氨酸濃度(<0.10),但顯著降低丙氨酸和甘氨酸濃度(<0.05)。苯丙氨酸顯著提高血清苯丙氨酸、谷氨酸和甘氨酸濃度(<0.05),對照組因添加丙氨酸調節為等氮日糧,其血清丙氨酸濃度顯著高于亮氨酸組與混合氨基酸組(<0.05)。苯丙氨酸和亮氨酸對血清各種氨基酸濃度無交互效應(>0.05)。亮氨酸顯著提高血清葡萄糖濃度(<0.05),苯丙氨酸降低血清葡萄糖濃度(<0.05),且與亮氨酸存在負交互效應(<0.05)。此外,苯丙氨酸顯著提高血清尿素氮含量(<0.05),但亮氨酸和苯丙氨酸添加對血清中胰島素及膽囊收縮素濃度無顯著影響(>0.05)。日糧中添加亮氨酸可提高犢牛血清部分必需氨基酸、葡萄糖濃度、8周齡體軀指數和平均日增重。從以上指標可見,亮氨酸添加效果優于苯丙氨酸,但二者在影響血清葡萄糖濃度方面存在負交互效應。
亮氨酸; 苯丙氨酸; 犢牛; 生長性能; 血清代謝物
0 引言
【研究意義】亮氨酸作為一種功能性氨基酸[1],可通過激活雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路調控動物機體蛋白合成及分解代謝[2-3]。苯丙氨酸是芳香族氨基酸的一種,可通過鈣敏感受體促進膽囊收縮素(cholecysto-kinin,CCK)的分泌[4]。CCK可促進胰腺合成胰淀粉酶、胰蛋白酶和胰蛋白酶原,并刺激胰酶釋放,增強胰酶活性[5]。【前人研究進展】研究表明,日糧中添加1 g過瘤胃亮氨酸可促進綿羊骨骼肌mTOR信號通路中4E-BP1和S6K1的磷酸化,進而促進骨骼肌蛋白合成[6]。此外,亮氨酸代謝產物α-酮異己酸也可顯著促進綿羊股二頭肌和背最長肌的蛋白合成[7]。LIU等[8]的研究也證實亮氨酸可作為營養信號分子促進α-淀粉酶分泌,調控荷斯坦青年母牛胰腺外分泌功能,從而改善能量供應,但其是否可促進奶牛生長發育尚不清楚。YU等[9]對山羊十二指腸灌注苯丙氨酸,結果表明,苯丙氨酸可促進胰酶的分泌。胰酶分泌增多,理論上可改善動物對營養物質的利用,但其是否會影響奶牛生長性能卻不得而知。【本研究切入點】初生犢牛處于高蛋白周轉與骨骼肌蛋白快速合成時期。與成年牛相比,哺乳犢牛可更有效的利用氨基酸等營養物質用于自身生長發育。且此期犢牛前胃系統并未發育完全,其消化系統與單胃動物相似,攝食的牛奶可不經瘤網胃而直接到達皺胃進行初步消化,繼而到達小腸被消化吸收[10],這避免了瘤網胃微生物對日糧營養組分的改變。【擬解決的關鍵問題】利用這一生理特性,筆者研究了亮氨酸和苯丙氨酸對奶公犢生長發育及血清代謝物的影響,以期為功能性氨基酸在奶牛生產中的應用提供理論依據。
1 材料與方法
1.1 試驗時間、地點
試驗于2015年4—9月在現代牧業(寶雞)有限公司犢牛島進行。
1.2 試驗設計
試驗以20頭1日齡體重為(38±3)kg的荷斯坦公犢為試驗對象,按體重相近原則隨機分為對照組(C)、亮氨酸組(L)、苯丙氨酸組(P)、混合氨基酸組(M)4組,每組5頭牛,試驗期8周。
試驗處理通過向原奶中添加亮氨酸和苯丙氨酸實現,并通過添加丙氨酸調節為等氮日糧。處理組添加亮氨酸和苯丙氨酸的依據參考YU等[11]和LIU等[8]的試驗結果,按照本試驗所測原奶中氨基酸含量,添加其基礎氨基酸含量的42%,各處理添加量見表1。L-亮氨酸和L-苯丙氨酸由寧波大榭開發區海德氨基酸工業有限公司提供,純度均為99.0%;L-丙氨酸由淮北新旗氨基酸有限公司提供,純度為99.2%。
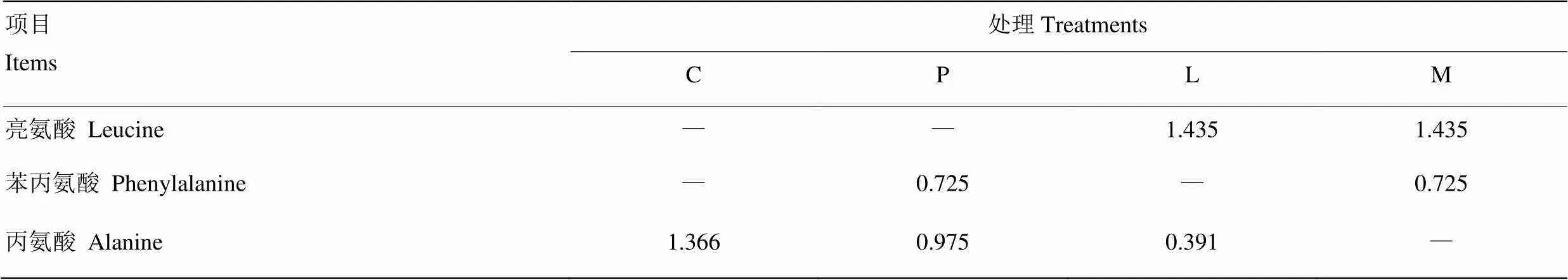
表1 原奶中氨基酸添加量
C=對照組,P=苯丙氨酸組,L=亮氨酸組,M=混合氨基酸組,所有處理組添加丙氨酸調節為等氮日糧。下同
C=milk with added alanine as control, P=milk with added phenylalanine and alanine, L=milk with added leucine and alanine, M=milk with added leucine and phenylalanine. Animal were fed with isonitrogenous diets was achieved by added alanine. the same as below
1.3 飼養管理
動物試驗在現代牧業(寶雞)有限公司犢牛島進行,試驗日糧由原奶和開食料組成。犢牛出生后,1 h內飼喂4 L初乳。此后1周為過渡期,日喂原奶2次,每次3 L。過渡期內以氨基酸添加量的10%為梯度逐天增加,至出生第6天達到添加量的100%。2—8周為正試期,日飼喂添加氨基酸的原奶2次。第2—3周每次3.5 L,4—8周每次4 L。第3周開始定量供給開食料,自由飲水。
1.4 樣品采集與指標測定
1.4.1 日糧組成 普瑞納犢牛開食料由玉米、豆粕、麥麩、甘蔗糖蜜、磷酸氫鈣、石粉、食鹽、L-賴氨酸、維生素A、維生素D3、維生素E、硫酸銅、硫酸亞鐵等組成。干物質(dry matter,DM)、粗蛋白(crude protein,CP)、淀粉(starch)、粗灰分(crude ash)、鈣(calcium,Ca)、總磷(total phosphorus,TP)和L-賴氨酸(L-lysine)測定方法參照中華人民共和國國家標準中相應的方法進行;中性洗滌纖維(neutral detergent fiber,NDF)和酸性洗滌纖維(acid detergent fiber,ADF)含量參照Van Soest等[12]方法測定。開食料化學組成見表2。每兩周采集一次原奶,測定氨基酸組成,方法參照GB/T5009.124—2003。原奶中精氨酸、組氨酸、異亮氨酸、亮氨酸、賴氨酸、蛋氨酸、苯丙氨酸、蘇氨酸、纈氨酸、丙氨酸、天冬氨酸、胱氨酸、谷氨酸、酪氨酸、甘氨酸、絲氨酸和脯氨酸的含量(g·L-1,DM)分別為1.429、0.920、1.744、3.432、3.055、0.950、1.731、1.804、2.372、1.356、2.869、0.358、7.605、1.846、0.838、2.260和6.458。

表2 試驗用犢牛開食料化學組成(干物質基礎)
除了L-賴氨酸數據由普瑞納提供外,其余指標均為實測值Analyzed values except L-lysine offered by Purina
1.4.2 生長性能 于晨飼前逐頭稱量犢牛1、3、5、7、8周齡體重、體高、體斜長和胸圍,計算體軀指數和體長指數。
體軀指數(%)=胸圍(cm)/體斜長(cm)×100;
體長指數(%)=體斜長(cm)/體高(cm)×100。
1.4.3 血清樣品采集與測定 于犢牛1、3、5、7、8周齡,晨飼后90 min以真空采血管頸靜脈采血約10 mL,37℃傾斜放置至血清析出,3 000 r/min離心15 min,收集血清于2 mL離心管中,加入抑肽酶(10 000 IU·mL-1),-80℃保存待測。檢測血清葡萄糖(Glucose,Glu)、血清氨基酸組成(Amino acids,AA)、尿素氮(Serum urea nitrogen,SUN)、胰島素(Insulin)、CCK。
血清葡萄糖于采樣當日采用葡萄糖氧化酶-過氧化物酶法檢測,采用葡萄糖測試盒(南京建成生物工程研究所),使用多功能酶標儀(Bio-tek SynergyTMHT,美國)測定。采用試劑盒(南京建成生物工程研究所)測定SUN、STP、Alb、Glb。采用Elisa試劑盒(Cloud-Clone Crop,美國)方法測定Insulin和CCK。
參照文獻[13]的方法,略加改進后應用全自動氨基酸分析儀(日立L-8900,日本)進行AA測定。取400 μL血清于2 mL離心管中,加入40 μL正亮氨酸(5 μmol·L-1)、100 μL10%磺基水楊酸溶液和400 μL pH 2.2的檸檬酸鈉緩沖液,充分混勻,置于4℃30 min,然后于4℃下10 000 r/min離心30 min,取上清,經2.2 μm水相濾膜過濾到進樣瓶中,上機待測。
1.5 統計分析
試驗數據用Excel 2016進行初步處理后,利用IBM SPSS Statistics V22.0 統計軟件GLM過程進行統計分析,采用LSD法進行多重比較。
2 結果
2.1 亮氨酸和苯丙氨酸對奶公犢生長性能的影響
原奶中添加亮氨酸和苯丙氨酸對奶公犢生長性能的影響見表3。由表3可知,各組犢牛初始體重、體斜長、體高、胸圍、體軀指數、體長指數和最終體重及體軀指數無顯著差異(>0.05)。相對于對照組,各處理組顯著提高最終體斜長(<0.05)。亮氨酸和苯丙氨酸具有降低最終體高的趨勢(<0.10),而苯丙氨酸顯著降低最終胸圍(<0.05)。與對照組相比,亮氨酸組和混合氨基酸組顯著提高犢牛8周齡體軀指數(<0.05)。混合氨基酸組平均日增重(Average daily gain,ADG)顯著低于其余3組(<0.05)。
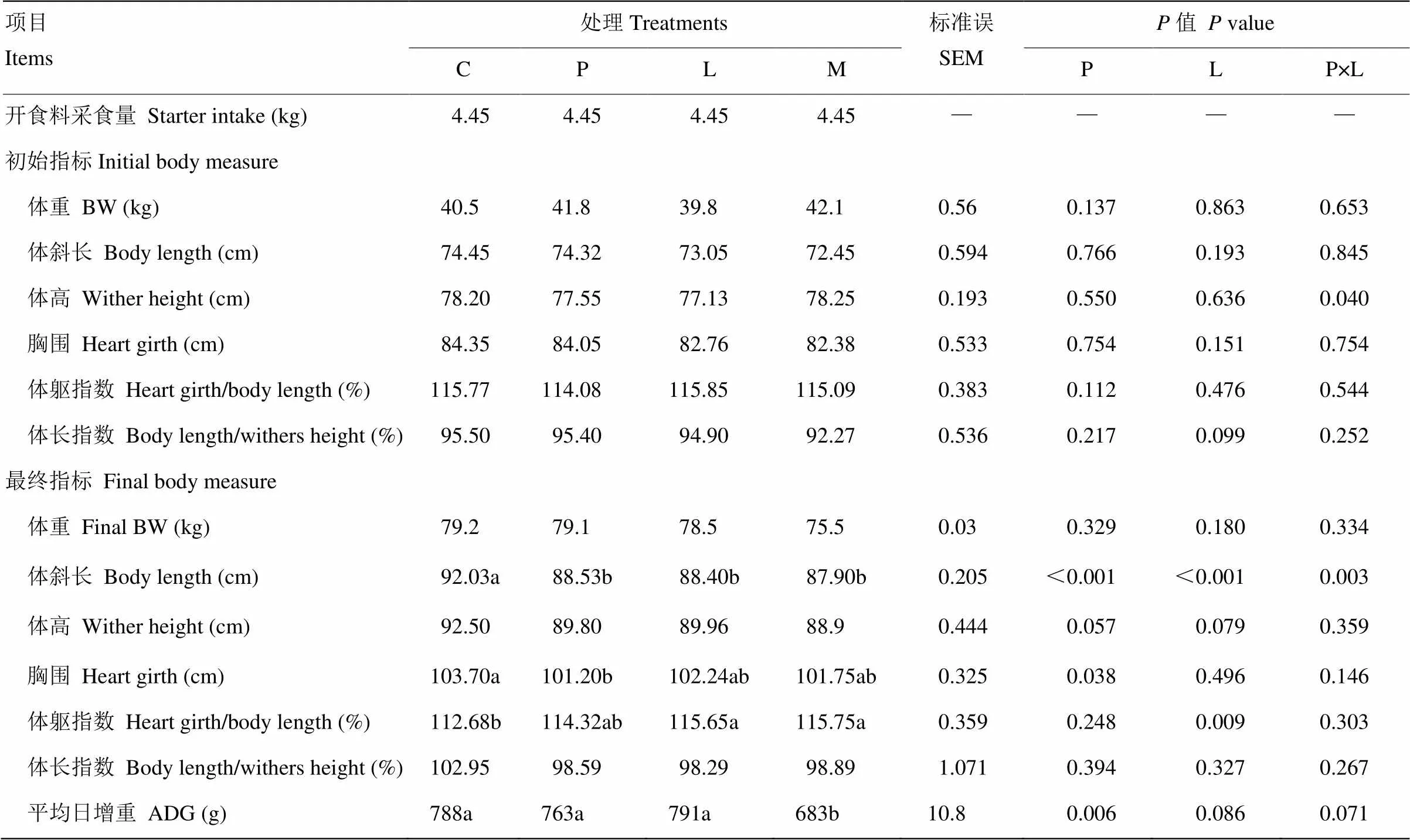
表3 原奶中添加亮氨酸和苯丙氨酸對奶公犢生長性能的影響
同行不同小寫字母表示差異顯著(<0.05)。下同
Different lowercases in a row indicate significantly (<0.05). The same as below
2.2 亮氨酸和苯丙氨酸對奶公犢血清氨基酸濃度的影響
表4所示為原奶中添加亮氨酸和苯丙氨酸對奶公犢血清氨基酸濃度的影響。亮氨酸顯著提高血清組氨酸、亮氨酸、蘇氨酸、甘氨酸和總必需氨基酸的濃度(<0.05),趨于增加天冬氨酸和總氨酸濃度(<0.10),但顯著降低丙氨酸和甘氨酸濃度(<0.05)。與對照組、苯丙氨酸組和混合氨基酸組相比,亮氨酸組組氨酸濃度分別提高14.3%、20.6%和10.8%,亮氨酸濃度分別提高128.7%、127.5%和7.6%,蘇氨酸濃度分別提高11.8%、13.3%和降低0.5%,甘氨酸濃度分別降低10.7%、17.2%和9.0%,總必需氨基酸濃度分別提高18.1%、15.2%和降低3.6%。苯丙氨酸顯著提高血清苯丙氨酸、谷氨酸和甘氨酸濃度(<0.05),與對照組、亮氨酸組、混合氨基酸組相比,苯丙氨酸組苯丙氨酸濃度提高98.9%、81.6%和降低3.5%。對照組因添加丙氨酸調節為等氮日糧,其血清丙氨酸濃度顯著高于亮氨酸組與混合添加組(<0.05)。苯丙氨酸和亮氨酸對血清各種氨基酸濃度無交互效應(>0.05)。
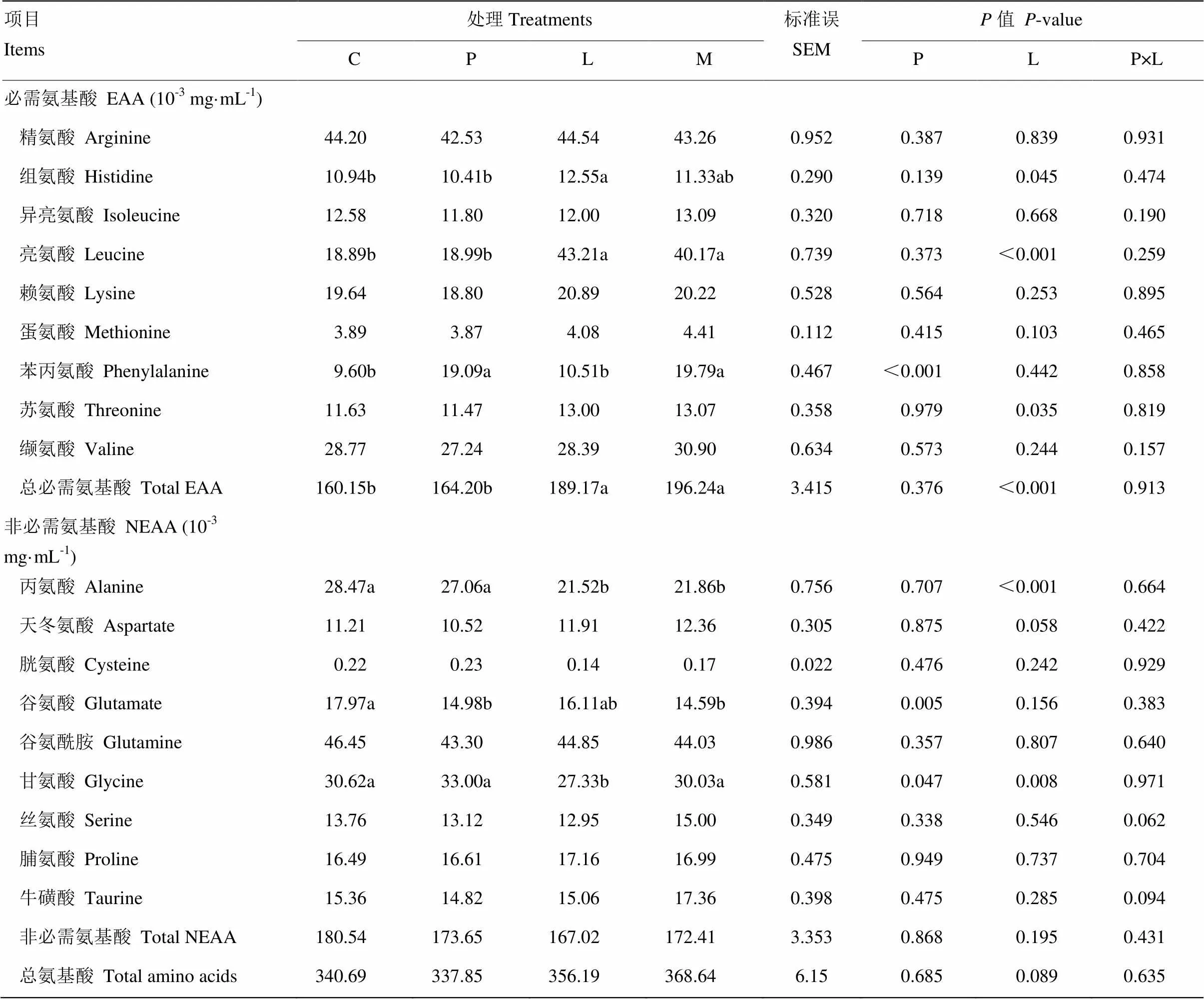
表4 原奶中添加亮氨酸和苯丙氨酸對奶公犢血清氨基酸濃度的影響
2.3 亮氨酸和苯丙氨酸對奶公犢血清代謝物濃度的影響
表5所示為原奶中添加亮氨酸和苯丙氨酸對奶公犢血清代謝物濃度的影響。亮氨酸顯著提高血清葡萄糖濃度(<0.05)。與對照組、苯丙氨酸組和混合氨基酸組相比,亮氨酸組血清葡萄糖濃度分別提高22.9%、23.7%和20.7%。苯丙氨酸降低血清葡萄糖濃度(<0.05),且與亮氨酸存在負交互效應(<0.05)。
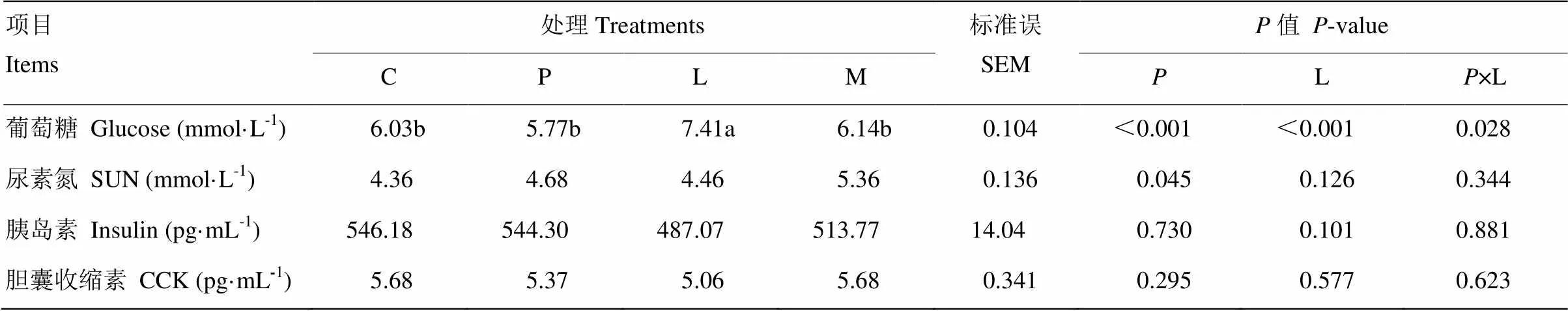
表5 原奶中添加亮氨酸和苯丙氨酸對奶公犢血清代謝物濃度的影響
此外,苯丙氨酸顯著提高血清尿素氮含量(<0.05)。亮氨酸和苯丙氨酸添加對血清中胰島素及膽囊收縮素濃度無顯著影響(>0.05)。
3 討論
經典營養學理論將亮氨酸和苯丙氨酸歸為必需氨基酸,動物細胞常不能通過自身合成此類氨基酸或合成量不足以滿足需求,因此必須通過日糧攝入來維持機體生長及生產活動正常進行[14]。增加哺乳仔豬亮氨酸攝入量,可通過改善仔豬腸道發育,從而促進其生長發育[15]。苯丙氨酸屬于芳香族氨基酸,被廣泛應用于醫藥和阿巴斯甜的主要原料,可在腎臟和肝臟經羥化酶催化作用氧化成酪氨酸[16],并與酪氨酸一起合成兒茶酚胺、黑色素等神經遞質和激素。通過十二指腸長期灌注低劑量(2 g·d-1)苯丙氨酸可通過增加血液CCK濃度調控反芻動物胰腺淀粉酶[9],從而提高動物生產性能。但SWANEPOEL等[17]研究表明,以菜籽粕為主要蛋白來源的高產奶牛日糧中添加過瘤胃苯丙氨酸對生產性能無影響。目前,將亮氨酸和苯丙氨酸作為功能性氨基酸,主要研究其對反芻動物乳蛋白合成的調控及機制[18-20],關于其對犢牛生長性能、血清氨基酸、葡萄糖及相關激素的影響尚不清楚。本試驗通過向原奶中添加亮氨酸和苯丙氨酸研究二者對奶公犢生長發育及血清代謝物的影響,并通過添加丙氨酸進行等氮處理,使得4組原奶中粗蛋白水平一致。
亮氨酸和苯丙氨酸等功能性氨基酸不僅可作為機體蛋白質合成底物,還能調控機體組織及部分功能性蛋白合成,在動物生長發育過程中起著重要作用[21-22]。本試驗通過向犢牛攝食的原奶中添加亮氨酸和苯丙氨酸,雖然8周齡斷奶時各組體重無顯著差異,但亮氨酸有提高平均日增重的趨勢,亮氨酸組的平均日增重為各組最高。混合氨基酸組日增重顯著低于對照組,且血清尿素氮含量最高,這可能由氨基酸的不平衡性所致。血清尿素氮濃度可較準確的反映動物體內蛋白質代謝和氨基酸之間的平衡,較低的尿素氮濃度預示著更好的氨基酸平衡狀況[23]。混合氨基酸組具有較高的尿素氮濃度,預示著氨基酸平衡狀況較差,其生長發育因氨基酸的不平衡而受到抑制。體尺大小主要由遺傳力所決定,但營養水平和飼喂制度可促進或阻礙遺傳力發揮。優秀的體軀指數預示著較高的體軀容積,體軀容積與產奶量存在潛在正遺傳相關[24]。添加亮氨酸顯著提高犢牛8周齡體軀指數,說明亮氨酸可促進犢牛向擁有更高生產潛力方向發育。而混合氨基酸組可能由于氨基酸不平衡降低了奶公犢蛋白質利用效率,抑制了骨骼和骨骼肌的生長發育,導致最終體斜長和平均日增重相對較低。
本試驗通過向原奶中添加亮氨酸和苯丙氨酸,發現亮氨酸可顯著提高犢牛血清組氨酸、亮氨酸、蘇氨酸和總必需氨基酸濃度,對總氨基酸濃度也有提高的趨勢,與對照組相比亮氨酸組血清亮氨酸水平濃度提高128.7%。SUN等[15]通過向哺乳仔豬基礎日糧中添加2倍的亮氨酸,發現亮氨酸具有促進仔豬腸道發育、提高亮氨酸轉運載體表達及21 d體重的作用,與對照相比處理組血漿亮氨酸濃度提高62.0%,天冬酰胺濃度提高23.6%,而其余氨基酸無顯著差異。NEWGARD等[25-26]也分別闡述了亮氨酸對小鼠和早期斷奶仔豬血液氨基酸的影響。本試驗結果與上述研究不完全一致,可能是受日糧、動物、日齡及氨基酸添加比例不同所致。犢牛氨基酸代謝池中可利用氨基酸濃度的增加,表明亮氨酸具有促進部分氨基酸吸收入血的作用,其可能是通過促進腸道發育及提高氨基酸轉運載體表達實現。本研究發現,額外添加亮氨酸飼喂犢牛,并未造成亮氨酸與纈氨酸、異亮氨酸間競爭性拮抗作用的發生。
近年來,苯丙氨酸作為乳蛋白合成過程中重要氨基酸而受到一定關注[27]。GLOAGUEN等[28]研究添加不同比例苯丙氨酸對仔豬生長性能的影響,發現提供較高比例的苯丙氨酸會抑制仔豬的生長發育。SWANEPOEL等[17]研究添加苯丙氨酸對高產奶牛的影響,結果表明每日提供7.5 g小腸可吸收苯丙氨酸,不影響其生產性能和血清氨基酸組成,但影響奶牛體況評分。本試驗中,添加苯丙氨酸顯著提高血清苯丙氨酸和甘氨酸濃度,降低谷氨酸濃度,對其余氨基酸無顯著影響。以上結果表明,亮氨酸和苯丙氨酸對犢牛的影響存在差異,具體表現在對血清氨基酸組成及體型的影響不同。
葡萄糖是所有脊椎動物碳水化合物代謝過程中居中心位置的一種單糖,同時也是動物機體內唯一可通過血液和細胞在全身循環的碳水化合物,可為機體提供能量的同時,參與多種生理功能[29]。反芻動物葡萄糖代謝與蛋白質之間存在著密切的聯系,TOMá?[30]通過靜脈注射葡萄糖研究其對羔羊血清氨基酸的影響,發現血清葡萄糖增多顯著降低哺乳羔羊血清氨基酸水平,同時發現注射葡萄糖顯著降低飼喂高脂日糧斷奶羔羊的血清必需和非必需氨基酸水平。孫海洲等[31]利用代謝葡萄糖和代謝蛋白質兩個整體營養指標研究生長肥育綿羊葡萄糖和蛋白質的平衡,結果表明生長肥育羊日糧存在一個最佳代謝蛋白/代謝葡萄糖平衡,在飼喂1.1倍維持能量水平日糧條件下,其值介于1.00—1.07之間。近期研究表明,與葡萄糖對氨基酸代謝的影響類似,氨基酸同樣影響反芻動物葡萄糖代謝。YU等[11]利用十二指腸灌注法研究亮氨酸和苯丙氨酸對山羊胰腺外分泌功能的影響,結果表明亮氨酸和苯丙氨酸可促進胰腺α-淀粉酶分泌,提高小腸淀粉消化率,進而為機體提供更多葡萄糖。LIU等[8]也證實亮氨酸可作為營養信號分子促進α-淀粉酶分泌,調控荷斯坦青年母牛胰腺外分泌功能,從而改善其能量供應。
本試驗中,各組犢牛血清葡萄糖濃度在3.5—10.0 mmol·L-1范圍內變動。亮氨酸顯著提高血清葡萄糖濃度,苯丙氨酸則顯著降低血清葡萄糖、提高血清尿素氮濃度。血清葡萄糖濃度越高,意味著可供動物直接利用的能量就越多。而較高的血清尿素氮濃度意味著犢牛血清氨基酸平衡狀況較差[23],血清氨基酸并沒有很好的參與機體蛋白合成,血清中大量存在的必需與非必需氨基酸在說明亮氨酸可能促進部分氨基酸吸收的同時,也一定程度說明這些氨基酸沒能被機體及時合理利用參與機體蛋白合成。以上結果說明,亮氨酸組氨基酸平衡狀況較好,血清氨基酸更好的參與了組織蛋白的合成。添加亮氨酸可提高血清葡萄糖濃度,其可能是通過促進胰腺及腸道相關消化酶合成來實現。
血液葡萄糖主要受胰島素和胰高血糖素的調控。胰島素是由胰腺胰島β細胞受內源或外源性物質如葡萄糖、乳糖、核糖、精氨酸、胰高血糖素等刺激而分泌的一種蛋白質激素,是動物機體內唯一可降低血糖的激素。亮氨酸可通過激活mTOR通路影響腎上腺素活力,調控胰島素分泌[32]。本試驗發現亮氨酸對血清胰島素含量無顯著影響。與YANG等[32-33]的研究結果存在差異,可能是由于此期血液中持續高濃度亮氨酸通過激活mTORC1通路,提高胰腺細胞內低氧誘導因子1-α水平,從而抑制胰腺內分泌前體細胞向胰島β細胞的分化所致[34-35]。
CCK是由腸道黏膜Ⅰ細胞分泌,在含115個氨基酸殘基的CCK原基礎上加工剪切形成的一類多肽[36]。CCK是胰酶合成和釋放的強效刺激劑,且能夠增強胰酶的活性。苯丙氨酸可通過鈣敏感受體有效刺激CCK的釋放[37]。YU等[9]在奶山羊上的研究發現十二指腸灌注苯丙氨酸可通過增加血液CCK濃度促進胰酶分泌。理論上,相關消化酶分泌增多,動物對營養物質的利用效率將會在一定程度上得到提高。本試驗,添加苯丙氨酸顯著降低血清葡萄糖濃度,但不影響血清CCK濃度。苯丙氨酸組與對照組血清葡萄糖濃度差異并不顯著,但其值較低。原因可能是苯丙氨酸促進胰島素分泌所致,苯丙氨酸組胰島素/葡萄糖濃度比顯著高于亮氨酸組,且在數值上高于對照組。苯丙氨酸對CCK沒有影響的原因可能是因此期食糜流速較快,腸道缺乏一個持續的刺激源所致[38]。
4 結論
日糧中添加亮氨酸可提高犢牛血清組氨酸、亮氨酸、蘇氨酸、甘氨酸、總必需氨基酸和葡萄糖濃度,提高8周齡體軀指數和平均日增重。從以上指標來說,亮氨酸添加效果優于苯丙氨酸,但二者在影響血清葡萄糖濃度方面存在負交互效應。而混合氨基酸組可能因奶公犢攝入氨基酸不平衡降低其蛋白質利用效率和生長發育。本試驗條件下,日糧中添加亮氨酸和苯丙氨酸對犢牛的生長發育沒有促進作用。
[1] WU G Y. Functional amino acids in nutrition and health., 2013, 45(3): 407-411.
[2] BOULTWOOD J, YIP B H, VUPPUSETTY C, PELLAGATTI A, WAINSCOAT J S. Activation of the mTOR pathway by the amino acid L-leucine in the 5q-syndrome and other ribosomopathies., 2013, 53(1): 8-17.
[3] KIM J, SONG G, WU G Y, GAO H J, JOHNSON G A, BAZER F W. Arginine, leucine, and glutamine stimulate proliferation of porcine trophectoderm cells through the MTOR-RPS6K-RPS6-EIF4EBP1 signal transduction pathway., 2013, 88(5): 1-9.
[4] LIOU A P, SEI Y, ZHAO X, FENG J, LU X, THOMAS C, PECHHOLD S, RAYBOULD H E, WANK S A. The extracellular calcium-sensing receptor is required for cholecystokinin secretion in response to L-phenylalanine in acutely isolated intestinal I cells., 2011, 300(4): 538-546.
[5] 于志清. 青藤堿對消化液分泌的影響及其機制的實驗研究[D]. 蘭州: 蘭州大學, 2013.
YU Z Q. Effects of sinomenine on digestive juice secretion: an experimental study[D]. Lanzhou: Lanzhou University, 2013. (in Chinese)
[6] 桑丹, 孫海洲, 郭俊清, 趙存發. 過瘤胃保護性亮氨酸對綿羊骨骼肌哺乳動物雷帕霉素靶蛋白(mTOR) 信號傳導通路關鍵因子的影響. 動物營養學報, 2011, 23(1): 61-65.
SANG D, SUN H Z, GUO J Q, ZHAO C F. Effects of rumen-protected leucine on the key factors controlling mTOR signal transduction pathway in the skeletal muscle of sheep., 2011, 23(1): 61-65.(in Chinese)
[7] 桑丹. 亮氨酸及α?酮異己酸鈣對綿羊機體蛋白質合成的影響研究[D]. 呼和浩特:內蒙古農業大學, 2009.
SANG D. Study on effects of leucine and α-KIC-Ca on protein synthesis in sheep[D]. Hohhot: Innner Mongolia Agriculture University, 2009. (in Chinese)
[8] LIU K, LIU Y, LIU S M, XU M, YU Z P, WANG X, CAO Y C, YAO J H. Relationships between leucine and the pancreatic exocrine function for improving starch digestibility in ruminants., 2015, 98(4): 2576-2582.
[9] YU Z P, XU M, YAO J H, LIU K, LI F, LIU Y, WANG F, SUN F F, LIU N N. Regulation of pancreatic exocrine secretion in goats: differential effects of short-and long-term duodenal phenylalanine treatment., 2013, 97(3): 431-438.
[10] ABE M, IRIKI T, KONDOH K, SHIBUI H. Effects of nipple or bucket feeding of milk-substitute on rumen by-pass and on rate of passage in calves., 1979, 41(1): 175-181.
[11] YU Z P, XU M, WANG F, LIU K, YAO J H, WU Z, QIN D K, SUN F F. Effect of duodenal infusion of leucine and phenylalanine on intestinal enzyme activities and starch digestibility in goats., 2014, 162: 134-140.
[12] VAN SOEST P J, ROBERTSON J B. LEWIS B A. Symposium: carbohydrate methodology, metabolism, and nutritional implications in dairy cattle, methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition., 1991, 74: 3583-3597.
[13] JONES B N, Gilligan J. Amino acid analysis by o-phthaldialdehyde precolumn derivatization and reverse-phase HPLC//. New Jersey: Humana Press, 1986: 121-151.
[14] WU G Y. Dietary requirements of synthesizable amino acids by animals: a paradigm shift in protein nutrition., 2014, 5(1): 1-12.
[15] SUN Y L, WU Z L, LI W, ZHANG C, SUN K L, JI Y, WANG B, JIAO N, HE B B, WANG W W, DAI A L, WU G Y. Dietary L-leucine supplementation enhances intestinal development in suckling piglets., 2015, 47(8): 1517-1525.
[16] FITZPATRICK P F. Allosteric regulation of phenylalanine hydroxylase., 2012, 519(2): 194-201.
[17] SWANEPOEL N, ROBINSON P H, ERASMUS L J. Effects of ruminally protected methionine and/or phenylalanine on performance of high producing Holstein cows fed rations with very high levels of canola meal., 2015, 205: 10-22.
[18] RIUS A G, APPUHAMY J A, CYRIAC J, KIROVSKI D, BECVAR O, ESCOBAR J, MCGILLIARD M L, BEQUETTE B J, AKERS R M, HANIGAN M D. Regulation of protein synthesis in mammary glands of lactating dairy cows by starch and amino acids., 2010, 93(7): 3114-3127.
[19] 高海娜, 鄭楠, 胡菡, 王加啟. 必需氨基酸通過哺乳動物雷帕霉素靶蛋白信號通路調控乳蛋白合成的研究進展. 動物營養學報, 2014, 26(9): 2451-2456.
GAO H N, ZHENG N, HU H, WANG J Q. Research progress on the regulation of milk protein synthesis by essential amino acid through mammalian target of rapamycin signaling pathway., 2014, 26(9): 2415-2456. (in Chinese)
[20] 代文婷, 李愛軍, 鄭楠, 王加啟. 亮氨酸水平對奶牛乳腺上皮細胞增殖及κ-酪蛋白合成相關基因表達的影響. 動物營養學報, 2015, 27(5): 1559-1566.
DAI W T, LI A J, ZHENG N, WANG J Q. Effects of leucine level on proliferation and κ-Casein synthesis related gene expressions of bovine mammary epithelial cells., 2015, 27(5): 1559-1566. (in Chinese)
[21] GANG L, WANG X Q, WU G Y, FENG C P, ZHOU H J, LI D F, WANG J J. Improving amino acid nutrition to prevent intrauterine growth restriction in mammals., 2014, 46(7): 1605-1623.
[22] WU G Y, BAZER F W, DAI Z L, LI D F, WANG J J, WU Z L. Amino acid nutrition in animals: protein synthesis and beyond., 2014, 2(2): 387-417.
[23] 席鵬彬, 李德發, 高天增, 龔麗敏. 賴氨酸與蛋白質比例對斷奶仔豬生長性能, 血清尿素氮及游離氨基酸濃度的影響. 動物營養學報, 2002, 14(1): 36-41.
XI P B, LI D F, GAO T Z, GONG L M. A study on the effect of lysine to protein ratio on growth performance, serum urea nitrogen and serum free amino acids concentrations in weaned pigs., 2002, 14(1): 36-41. (in Chinese)
[24] 儲明星, 師守. 奶牛體型線性評定數據的應用. 中國奶牛, 1994, 1: 26-27.
CHU M X, SHI S. Application of linear evaluation data of dairy cows.1994, 1: 26-27. (in Chinese)
[25] NEWGARD C B. Interplay between lipids and branched-chain amino acids in development of insulin resistance., 2012, 15(5): 606-614.
[26] ZHANG S H, QIAO S Y, REN M, ZENG X F, MA X, WU Z L, THACKER P, WU G Y. Supplementation with branched-chain amino acids to a low-protein diet regulates intestinal expression of amino acid and peptide transporters in weanling pigs., 2013, 45(5): 1191-1205.
[27] IROSHAN I H. The effect of a limited supply of phenylalanine, threonine, or tryptophan on mammary metabolism in dairy cows[D]. Calgary: University of Calgary, 2015.
[28] GLOAGUEN M, FLOC'H N L, PRIMOT Y, CORRENT E, MILGEN J V. Performance of piglets in response to the standardized ileal digestible phenylalanine and tyrosine supply in low-protein diets., 2014, 8(9): 1412-1419.
[29] 盧德勛. 反芻動物葡萄糖營養調控理論體系及其應用. 畜牧與飼料科學, 2010, 31(6/7): 402-409.
LU D X. The theoretical system and application of glucose nutrition regulation in ruminant.2010, 31(6/7): 402-409. (in Chinese)
[30] TOMá? J, KOPPEL J, KUCHáR S. The effect of glucose and xylazine on free amino acids concentrations in suckling and ruminating lambs., 1987, 57(1-5): 196-204.
[31] 孫海洲, 盧德勛, 張海鷹, 羿靜, 趙秀英, 馮宗慈. 不同代謝葡萄糖與代謝蛋白質比例的日糧對生長肥育綿羊葡萄糖營養影響的研究. 動物營養學報, 2001, 13(1): 43-48.
SUN H Z, LU D X, ZHANG H Y, YI J, ZHAO X Y, FENG Z C. Effects of different ratio of dietary metabolizable glucose (MG) to metabolizable protein on glucose nutrition in growing-finishing sheep., 2001, 13(1): 43-48. (in Chinese)
[32] YANG J, DOLINGER M, RITACCIO G, CONTI D, ZHU X J, HUANG Y F. Leucine as a stimulant of insulin., 2015: 49-62.
[33] XU G, KWON G, CRUZ W S, MARSHALL C A, MCDANIEL M L. Metabolic regulation by leucine of translation initiation through the mTOR-signaling pathway by pancreatic β-cells., 2001, 50(2): 353-360.
[34] RACHDI L, A?ELLO V, DUVILLIé B, SCHARFMANN R. L-leucine alters pancreatic β-cell differentiation and function via the mTOR signaling pathway., 2012, 61(2): 409-417.
[35] 駱超超, 鄭楠, 趙圣國,李松勵, 文芳, 王加啟, 張養東. 氨基酸調控哺乳動物細胞mTORC1上游通路研究進展. 中國農業科學, 2015, 48(S):67-74.
LUO C C, ZHENG N, ZHAO S G, LI S L, WEN F, WANG J Q, ZHANG Y D. Advances of the regulation of amino acids-mediated- mTORC1 upstream pathway in mammalian cells., 2015, 48(S):67-74. (in Chinese)
[36] NILAWEERA K N, GIBLIN L, ROSS R P. Nutrient regulation of enteroendocrine cellular activity linked to cholecystokinin gene expression and secretion., 2010, 66(1): 85-92.
[37] BALLINGER A B, CLARK M L. L-phenylalanine releases cholecystokinin (CCK) and is associated with reduced food intake in humans: evidence for a physiological role of CCK in control of eating., 1994, 43(6): 735-738.
[38] STEINERT R E, LANDROCK M F, HOROWITZ M, FEINLE- BISSET C. Effects of intraduodenal infusions of l-phenylalanine and l-glutamine on antropyloroduodenal motility and plasma cholecystokinin in healthy men., 2015, 21(3): 404-413.
(責任編輯 林鑒非)
Effect of Leucine and Phenylalanine Supplementation on Growth Performance and Serum Metabolites of Holstein Male Calves
YANG Xinjian, CAO Yangchun, ZHENG Chen, LIU Kai, GUO Long, CAI Chuanjiang, LIU Baolong, YAO Junhu
(College of Animal Science and Technology, Northwest A&F University, Yangling 712100, Shaanxi)
The objective of the study was to know the effect of leucine and phenylalanine supplementation on growth performance and serum metabolites of Holstein male calves. The study could provide a reference for the high efficient use of leucine and phenylalanine on dairy cows.A total of 20 Holstein male calves (birth weight (38±3) kg) were randomly assigned into treatment groups of control, L (1.435 g·L-1leucine), P (0.725 g·L-1phenylalanine), M (1.435 g·L-1leucine and 0.725 g·L-1phenylalanine), and each treatment added alanine as isonitrogenous diet. The experiment lasted for eight weeks, one week for adaption and seven weeks for feeding experiment. The calves were fed individually. Within one hour after birth, each calf was fed 4.0 L of colostrum. During the first week, the calves were fed their assigned milk twice daily, 3.0 L each. For adaption, the amino acid supplementation was increased 20% daily until it reached 100% of the target supplementation on the sixth day after birth. From week 2 to 3, the calves were fed their assigned milk twice a day, 3.5 L each, while from week 4 to 8, the volume of the milk fed increased to 4 L each time. From the third week after birth of the calves, a quantitative supply of the starter feed was provided, with free access to the drinking water. Body weight, withers height, body length, heart girth, heart girth/body length, body length/withers height were recorded at the 1, 3, 5, 7, and 8 week old, respectively. At the same time, 10 mL of blood was drawn from the jugular vein and placed at a tilted angle for serum precipitation. The serum samples were used to determine the amino acids, glucose, serum urea nitrogen, insulin, and cholecysto-kinin, respectively. Data were analyzed using the GLM procedure of IBM SPSS Statistics V22.0 software, differences among treatments were compared using LSD’s multiple range tests.Average daily gain in M group was significantly lower than control, L and P groups (<0.05). Compared with control group, other three groups significantly increased the final body length (<0.05). L and M treatments tended to increase the final wither height (<0.10), while P treatment significantly decreased the final heart girth (<0.05). Compared with control group, L and M treatments significantly increased the heart girth/body length (<0.05), whereas no difference in initial body weight, body length, wither height, heart girth, heart girth/body length, body length/withers height, final body weight and final body length/withers height was found among treatments (>0.05). L treatment significantly increased the concentrations of histidine, leucine, threonine, glycine, and total essential amino acids (<0.05), tended to increase the concentrations of aspartate and total amino acids (<0.10), while significantly decreased the concentrations of alanine and glycine (<0.05). P treatment significantly increased the concentrations of phenylalanine, glutamate and glycine (<0.05). Compared with L and M groups, control group significantly increased the concentrations of serum alanine (<0.05). For serum concentrations of amino acids, no significant interactions between L and P treatments were detected in our study (<0.05). L treatment significantly increased the concentrations of glucose (<0.05), while P treatment significantly decreased the concentrations of glucose (<0.05). For serum concentrations of glucose, significant interactions between L and P treatments were detected in our study (<0.05). Serum urea nitrogen in P group was significantly higher than other three groups (<0.05), whereas no difference in concentration of insulin and cholecysto-kinin were found among treatments (>0.05).In conclusion, leucine supplementation had a better effect than that of phenylalanine on the serum concentration of essential amino acids, glucose, heart girth/body length and average daily gain of Holstein male calves, whereas negative interactions existed between the two kinds of supplementation.
leucine; phenylalanine; calves; growth performance; serum metabolites
2016-11-30;接受日期:2017-09-18
國家自然科學基金(31472122)、陜西省科技統籌創新工程項目(2015KTCQ02-19)
楊昕澗,E-mail:18729548121@163.com。曹陽春,E-mail:caoyangchun@126.com。楊昕澗和曹陽春為同等貢獻作者。通信作者姚軍虎,E-mail:yaojunhu2004@sohu.com

