基于骨肉瘤高表達抗原PBF CTL表位改造及鑒定*
張建新, 時冉冉
(1許昌學院, 河南 許昌 461000; 2漯河醫學高等專科學校, 河南 漯河 462002)
基于骨肉瘤高表達抗原PBF CTL表位改造及鑒定*
張建新1, 時冉冉2△
(1許昌學院, 河南 許昌 461000;2漯河醫學高等專科學校, 河南 漯河 462002)
目的觀察骨肉瘤高表達抗原乳頭瘤病毒結合因子(PBF)的改造表位是否有HLA-A2限制性抗腫瘤能力,開發基于骨肉瘤的多肽免疫治療。方法首先運用RT-PCR和Western blot方法檢測PBF在骨肉瘤細胞系U2OS和Saos-2的表達情況。然后通過NetCTL 1.2、SYFPEITHI和IEDB軟件預測打分來選取PBF的HLA-A2限制性表位。替換PBF抗原錨定位點氨基酸獲得改造肽。候選表位肽的合成方法是標準的Fmoc化學合成法,結合力實驗用于檢測候選表位與T2A2細胞表面HLA-A2分子的結合能力,ELISPOT實驗檢測候選表位肽誘導細胞毒性T淋巴細胞(CTL)分泌干擾素γ(IFN-γ)的能力,乳酸脫氧酶(LDH)釋放實驗和羧基熒光素琥珀酰亞胺脂(CFSE)細胞毒實驗檢測候選肽誘導CTL的能力。結果PBF在骨肉瘤細胞系U2OS和Saos-2均有表達,候選肽P75-1Y2L、P412-1Y、P416-1Y2L9V、P107-1Y和P435-1Y2L具有較好的結合力,且改造肽與HLA-A2的結合力高于原肽。ELISPOT實驗結果顯示表位肽P412、P412-1Y、P416、P416-1Y2L9V和P435-1Y2L誘導的CTL具有分泌IFN-γ的能力;P412-1Y和P416-1Y2L9V誘導特異性T細胞免疫分泌的IFN-γ略高于原肽。LDH釋放實驗和CFSE細胞毒實驗結果顯示表位P412、P412-1Y、P416和P416-1Y2L9V對U2OS細胞均有一定的殺傷作用,P412-1Y和P416-1Y2L9V特異性CTLs對U2OS細胞殺傷率高于原肽特異性CTLs。結論PBF抗原改造表位P412-1Y和P416-1Y2L9V與天然表位P412和P416相比有更高的HLA-A2分子親和力,保留了原有的免疫原性,并且改造肽抗腫瘤免疫效應強于天然表位。P412-1Y和P416-1Y2L9V是優秀的PBF抗原的HLA-A*0201限制性CTL候選表位,可以成為新的抗腫瘤多肽免疫治療疫苗的候選表位。
乳頭瘤病毒結合因子; 表位; 細胞毒性T淋巴細胞; 骨肉瘤
骨肉瘤是骨科最常見的原發性惡性腫瘤。1970年前,骨肉瘤患者的生存率低于20%。輔助化療和手術治療準則的建立,使患者五年存活率提高為60%~70%[1-2]。 這些進展掩蓋了近年來的輔助免疫治療,盡管使用自身腫瘤疫苗的輔助免疫治療具有一定的治療功效[3-5], 但是,骨肉瘤患者的存活率在過去10年已經進入停滯期[6-7],這又重新激起了免疫治療方法的開展[8-9]。乳頭瘤病毒結合因子(pa-pillomavirus-binding factor,PBF)被鑒定為調節人乳頭瘤病毒8型基因組上的啟動子活性的轉錄因子[10]。PBF是由自體細胞毒性T淋巴細胞(cytoto-xic T-lymphocytes,CTL)克隆識別的骨肉瘤相關抗原[11]。 免疫組織化學分析顯示,92%的骨肉瘤活檢標本表達PBF。 此外,PBF陽性骨肉瘤具有比PBF陰性表達更差的預后[12]。 通常,常規骨肉瘤是間充質來源的惡性腫瘤,沒有特定的病因,例如病毒感染。 PBF不僅在人乳頭瘤病毒基因組的轉錄中具有某些功能,而且在骨肉瘤[13-14]、先天免疫[15]和脂肪形成[16]的細胞增殖和凋亡中具有某些功能。本次研究使用NetCTL 1.2、SYFPEITHI和IEDB生物信息學軟件進行綜合預測,篩選出綜合打分較高的表位,并對優勢表位進行適當替換,通過進一步的實驗分析,鑒定篩選出PBF的HLA-A*0201限制性CTL表位[17-19],為未來構建多表位疫苗和重組蛋白融合疫苗打下基礎。
材 料 和 方 法
1材料
T2A2細胞、U2OS細胞(HLA-A2+)和Saos-2細胞(HLA-A2-)由漯河醫學高等專科學校分子醫學實驗室常規保存,采用37 ℃、5% CO2、飽和濕度培養條件下常規培養。外周血單個核細胞(peripheral blood mononuclear cells,PBMCs)由HLA-A2+健康供者捐贈。HLA-A2+外周血健康供者來自課題組尋找的健康供者。
2方法
2.1PBF 在腫瘤細胞中的表達 采用RT-PCR和Western blot法檢測PBF在骨肉瘤細胞系U2OS和Saos-2中的表達情況。參照說明書提取總RNA,反轉錄得到cDNA,以cDNA為模板行PCR。擴增條件為: 95 ℃預變性30 s; 95 ℃變性30 s, 63 ℃退火45 s, 72 ℃延伸45 s,共30個循環; 72 ℃終止延伸5 min。將PCR產物行1%瓊脂糖凝膠電泳,采用凝膠成像系統觀察結果,ImageJ軟件測定各條帶灰度值。PBF的上游引物序列為 5’-TGTGCACAGGTGTCTTTGGT-3’,下游引物序列為5’-CCTGAGCGAAGTTCCCATGT-3’,產物大小278 bp。GAPDH的上游引物序列為5’-GAAGGTGAA GGTCGGAGTC-3’, 下游序列引物為5’-GAAGATGGTGATGGGATTTC-3’,產物大小為226 bp。裂解細胞提取總蛋白,BCA法定量,行SDS-PAGE并轉移PVDF膜。封閉液封閉1 h,加入已稀釋的 I 抗,4 ℃孵育過夜,TBST洗膜3次,加入 II 抗,室溫下孵育1 h, TBST洗膜3次,加入ECL進行發光反應。用ImageJ軟件測定各條帶灰度值。
2.2HLA-A*0201限制性CTL表位肽的預測 結合NetCTL 1.2(http://www.cbs.dtu.dk/services/NetCTL/)、SYFPEITHI(http://www.syfpeithi. de/ bin/MHCServer.dll/EpitopePrediction.htm)和IEDB(http://tools.iedb.org/main/tcell/)軟件對PBF氨基酸序列的預測打分,分別打開這3種預測軟件的主頁,進入 CTL 表位預測界面,本次研究以A2超型為主,參數設定為CTL表位限制性 MHC類型——HLA-A*0201。預測抗原肽長度nonamers (9 aa)。根據各個預測軟件所推選的前30個優勢表位進行綜合選擇,選出在各種軟件打分較好的HLA-A*0201限制性表位。
2.3HLA-A*0201限制性CTL表位肽的合成、純化、分析及質譜鑒定 候選表位肽由上海生工生物工程有限公司合成,經HPLC分析純化后,其純度大于95%,質譜分析其相對分子質量符合理論值。
2.4表位肽與HLA-A2分子結合力實驗 收集T2A2細胞,用無血清RPMI-1640培養基洗3次,調整細胞濃度至1×109/L,鋪于24孔板中,每孔1 mL,每實驗孔加入待測肽50 mg/L,β2-M 2.5 mg/L,37 ℃、5% CO2共孵育18 h后,冷PBA洗滌3次,加入500 μL稀釋度為1∶100的 I 抗(鼠抗人β2-M),4 ℃避光靜置40 min。之后冷PBA洗滌3次,加入50 μL稀釋度為1∶50的 II 抗(FITC標記的羊抗鼠IgG溶液),4 ℃靜置40 min,PBA洗滌1次后上流式細胞儀檢測。其結果用熒光指數(fluorescence index, FI)表示,FI=(表位肽平均熒光強度-背景平均熒光強度)/背景平均熒光強度。FI>1.0表示高等結合力,1.0>FI>0.5表示中等結合力,FI<0.5表示低結合力[20]。
2.5CTL的體外誘導 抽取HLA-A2+健康供者的外周血,將外周血加入含肝素鈉的離心管中,經常規聚蔗糖-泛影葡胺分層液梯度離心,獲取PBMCs,用含10%胎牛血清的IMDM培養基調整細胞濃度為1.5×109/L。第2天分別加入10 mg/L的候選肽共培養,第3天加入5×104U/L的rIL-2繼續培養。每周收集細胞,1 000 r/min離心10 min,除去上清,加入新鮮的10%胎牛血清的IMDM培養基,同時加入上述條件的候選肽和rIL-2。刺激3輪后于最后一次刺激的第3天收集細胞。調整細胞濃度作為效應細胞,用無血清IMDM培養基調整細胞濃度作為靶細胞[21]。
2.6干擾素γ(Interferon-γ,IFN-γ)分泌水平檢測 酶聯免疫斑點實驗(enzyme-linked immunospot assay,ELISPOT)試劑盒購自達科為生物技術有限公司。取出板條,加200 μL無血清的IMDM培養基進行封閉,靜置10 min;誘導的CTL作為效應細胞,荷肽的T2A2作為刺激細胞,細胞濃度均調整為2×109/L;設立對照孔和實驗孔,37 ℃、5% CO2孵育18 h;傾盡孔中培養基,每孔加入200 μL無菌的去離子水,4 ℃ 裂解細胞10 min;傾盡孔內液體,加入200 μL 1×Washing Buffer進行洗滌,洗滌6次,每次停留60 s;加入 100 μL生物素標記的抗體,37 ℃ 孵育1 h;傾盡孔內液體,加入200 μL 1×Washing Buffer進行洗滌,洗滌方法同上,在吸水紙上拍干;加入100 μL酶聯親和素,37 ℃ 孵育1 h;每孔加入200 μL 1×Washing Buffer進行洗滌,洗滌方法同上;加入100 μL現配的AEC顯色液,25 ℃避光靜置30 min;結束后置于通風處,室溫靜置干燥;結果用 ELISPOT 圖像分析儀計數 96 孔板中每孔的斑點數[22]。
2.7乳酸脫氫酶(lactate dehydrogenase,LDH)釋放實驗檢測CTL的細胞毒性 調整CTL濃度為5×109/L;調整靶細胞U2OS細胞濃度為1×108/L;按50∶1、25∶1和12.5∶1的不同效靶比(effector/target,E/T)鋪于96孔板中,同時設立效應細胞自發釋放組、靶細胞自發釋放組、靶細胞最大釋放組、體積校正組和背景對照組,每孔終體積為100 μL。37 ℃、5% CO2培養4 h。于孵育結束前45 min在靶細胞最大釋放組及體積校正組中加入10 μL裂解液,1 000 r/min離心4 min,轉移50 μL上清至另一干凈96孔板中,每孔加入50 μL底物混合液,室溫避光孵育30 min;每孔再加入50 μL終止液。用酶標儀檢測其在490 nm波長處的吸光度(A)。殺傷率(%)=(實驗孔值-效應細胞自發釋放值-CTL自發釋放值)/(靶細胞值-效應細胞自發釋放值)×100%[23]。
2.8羧基熒光素琥珀酰亞胺酯(carboxyfluorescein succinimidyl ester,CFSE)熒光染色檢測CTL的細胞毒性 離心收集靶細胞,并將細胞重懸于含1% 胎牛血清的PBS中,并將細胞濃度調節至1×109/L。按下法制備致敏靶細胞:每1 mL細胞懸浮液加入0.5 μL 5 mmol/L CFSE,室溫光照孵育4 min;對照靶細胞:每1 mL細胞懸液中加入0.5 μL 100 μmol/L CFSE,室溫光照孵育4 min。將細胞用5% FCS-PBS洗滌1次,離心并除去上清液,重懸于無血清IMDM培養基中。將效應細胞在無血清IMDM培養基中洗滌1次,并以(1.25~5)×109/L的濃度重懸于無血清IMDM培養基中。將效應細胞(分別為12.5∶1、25∶1和50∶1)與致敏的靶細胞在離心管中混合,靶細胞數為2×104,37 ℃溫育4 h后,用含有1% 胎牛血清和0.1%疊氮化鈉的PBS(FACS緩沖液)處理相同E/T致敏的靶細胞組和對照靶細胞組,并用FACS緩沖液洗滌。離心,重懸在4%多聚甲醛的PBS溶液中,流式細胞儀檢測。殺傷率(%)=(對照樣品中致敏靶細胞的數量-測試樣品中致敏靶細胞的數量)/對照樣品中致敏靶細胞的數量×100%。
3統計學處理
實驗數據用均數±標準差(mean±SD)表示,多組間均數比較采用單因素方差分析, 以P<0.05為差異有統計學意義。統計圖均由GraphPad Prism 5.0軟件繪制。
結 果
1PBF在骨肉瘤細胞系中的表達
分別使用RT-PCR以及Western blot的方法檢測PBF在骨肉瘤細胞系中的表達,從圖1中可以看出,PBF在U2OS和Saos-2骨肉瘤細胞系中均有表達。
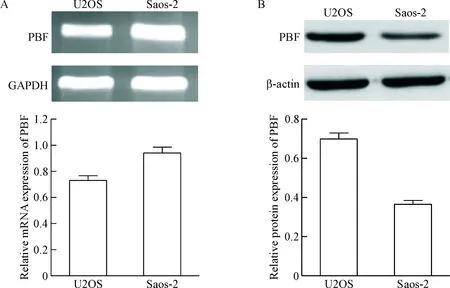
Figure 1. The mRNA (A) and protein (B) expression of PBF in the osteosarcoma cell lines determined by RT-PCR and Western blot.
圖1骨肉瘤細胞系中PBF的表達
2PBFHLA-A2限制性CTL表位的預測結果
依據NetCTL 1.2、SYFPEITHI和IEDB軟件的結果,選取在各個預測軟件中分值排名靠前的表位肽,根據這3個預測軟件進行綜合打分,篩選出分值在各個軟件中打分較好的CTL表位肽,對篩選的表位肽進行氨基酸替換,軟件預測的改造表位的打分情況見表1。
表1PBFHLA-A2限制性CTL表位的預測結果
Table 1. Prediction scores of the HLA-A2 restricted epitope peptides derived from PBF
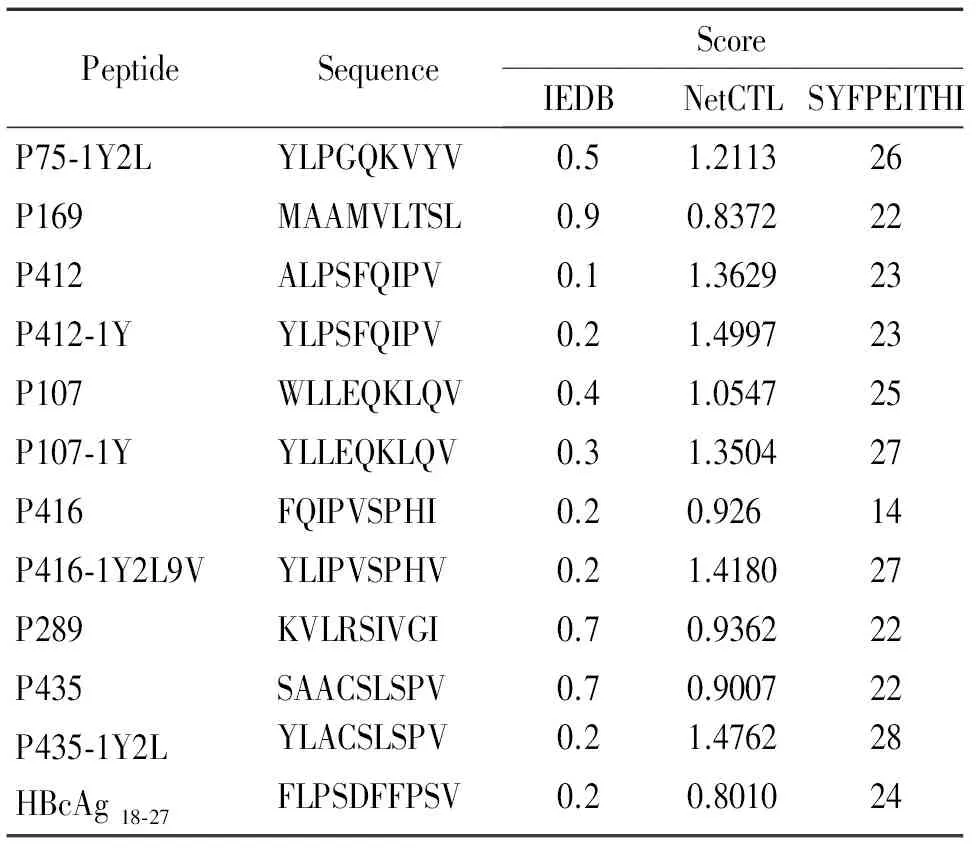
PeptideSequence ScoreIEDBNetCTLSYFPEITHIP75?1Y2LYLPGQKVYV0.51.211326P169MAAMVLTSL0.90.837222P412ALPSFQIPV0.11.362923P412?1YYLPSFQIPV0.21.499723P107WLLEQKLQV0.41.054725P107?1YYLLEQKLQV0.31.350427P416FQIPVSPHI0.20.92614P416?1Y2L9VYLIPVSPHV0.21.418027P289KVLRSIVGI0.70.936222P435SAACSLSPV0.70.900722P435?1Y2LYLACSLSPV0.21.476228HBcAg18?27FLPSDFFPSV0.20.801024
3表位肽/HLA-A2分子結合力實驗結果
P75-1Y2L、P412-1Y、P416-1Y2L9V、P107-1Y和P435-1Y2L具有較好的HLA-A2結合力(FI>1);經過改造后的表位肽明顯提高與MHC分子結合能力,見表2。
表2候選肽與HLA-A*0201分子結合力結果
Table 2. The data of the HLA-A*0201-binding affinity of the candidate peptides derived from PBF
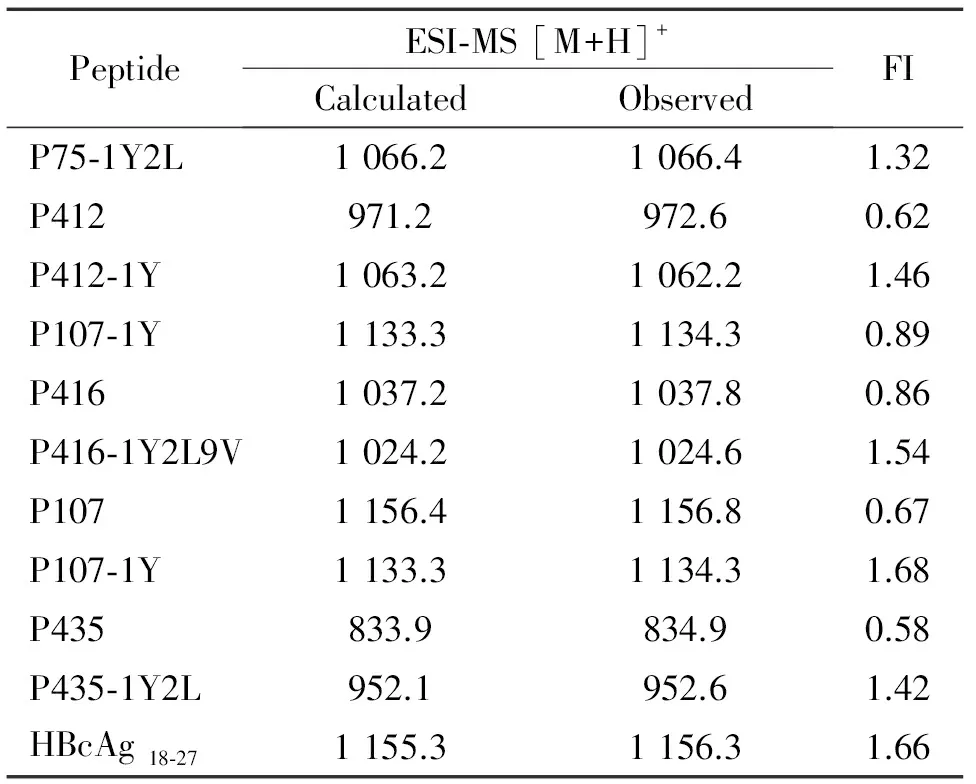
PeptideESI?MS[M+H]+CalculatedObservedFIP75?1Y2L1066.21066.41.32P412971.2972.60.62P412?1Y1063.21062.21.46P107?1Y1133.31134.30.89P4161037.21037.80.86P416?1Y2L9V1024.21024.61.54P1071156.41156.80.67P107?1Y1133.31134.31.68P435833.9834.90.58P435?1Y2L952.1952.61.42HBcAg18?271155.31156.31.66
FI = [mean fluorescence intensity (MFI) of the peptide-MFI background]/MFI background.4IFN-γ分泌水平的檢測
根據結合力的實驗結果,我們選擇了高結合力的多肽進行實驗,結果顯示: P412、P412-1Y、P416、P416-1Y2L9V和P435-1Y2L多肽疫苗能檢測到特異性T細胞免疫,能分泌較多的IFN-γ;P412-1Y、P416-1Y2L9V和P435-1Y2L誘導特異性T細胞免疫分泌的IFN-γ略高于原肽,見圖2。
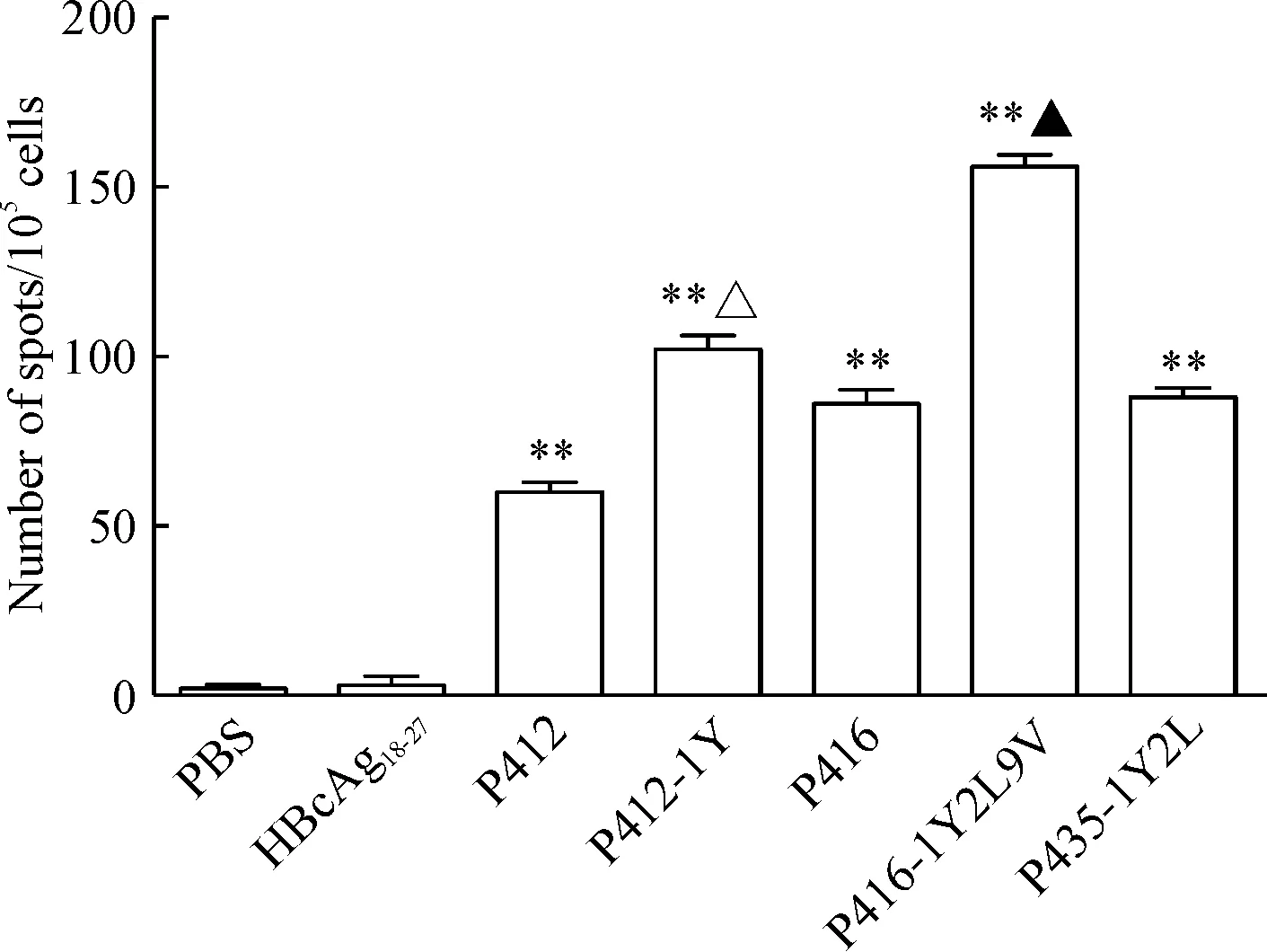
Figure 2. ELISPOT assay to measure IFN-γ release by CTLs induced from PBMCs of healthy donors. CTLs induced by PBS and irrelevant peptide HBcAg18-27were taken as negative control. Mean±SD.n=3.**P<0.01vsPBS group;△P<0.05vsP412 group;▲P<0.05vsP416 group.
圖2ELISPOT法檢測PBF候選表位肽特異性CTL分泌IFN-γ的能力
5LDH法檢測細胞毒性
根據IFN-γ分泌水平結果,我們將有效果的P412、P412-1Y、P416和P416-1Y2L9V做進一步的免疫活性檢測。LDH釋放實驗結果顯示,P412、P412-1Y、P416和P416-1Y2L9V誘導得到的CTL在不同效靶比(12.5∶1、25∶1和50∶1)時對PBF表達陽性的骨肉瘤細胞系U2OS(HLA-A2+)的殺傷率均明顯高于陰性對照(PBS)組和無關肽(HBcAg18-27)組(P<0.01),見圖3。
6CFSE熒光染色檢測細胞毒性的實驗結果
候選肽所誘導產生的CTL,隨著效靶比的提高殺傷效果相應提高。P412和P412-1Y誘導得到的CTL在效靶比為50∶1時對荷肽T2A2的殺傷率分別是23.0%和35.2%,P416和P416-1Y2L9V誘導得到的CTL在效靶比為50∶1時對荷肽T2A2的殺傷率分別是25.5%和32.3%,見圖4。
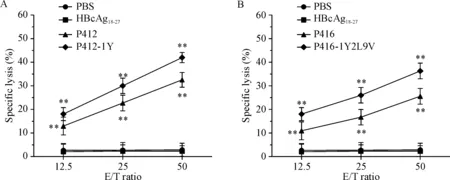
Figure 3. Specific lysis of U2OS cells (HLA-A2+) by the CTLs generated from PBMCs of healthy donors. CTLs were induced by PBF-derived peptides and their analogues. A: P412 and P412-1Y; B: P416 and P416-1Y2L9V. The effector/target (E/T) ratios were 12.5∶1, 25∶1 and 50∶1. The levels of LDH release were detected. CTLs induced by PBS and irrelevant peptide HBcAg18-27were used as negative control. Mean±SD.n=3.**P<0.01vsPBS group.
圖3P412和P416候選肽及其類似物誘導得到的CTL在不同效靶比時對靶細胞U2OS的殺傷情況
討 論
骨與軟組織肉瘤在分子靶向治療方面近年來取得了很大的進展,但是除了胃腸道間質瘤外,其它類型的肉瘤對分子靶向治療的療效仍不理想,可能是由于藥物針對的靶點特異性不強和功能不夠關鍵所致。免疫治療和基因治療在軟組織肉瘤和膠質細胞腫瘤中尚處于研究階段,盡管在動物腫瘤模型中取得了很好的結果,但在臨床上尚未能達到預期的結果,其原因是尚未掌握很好的、控制高度復雜的免疫系統的方法,因此目前還存在很多問題有待于解決,如何選擇分子靶向治療藥物并克服耐藥、選擇高效的免疫治療和基因治療的靶點、構建具有高度特異性和高免疫源性的疫苗、提高基因治療的轉染效率、靶向性和安全性等是目前急需解決的問題。深人研究骨科腫瘤發展的分子機制將有利于開發更多、更特異、更有效的新型靶向治療藥物。腫瘤抗原特異性疫苗含有多種表位,包括Th表位、CTL表位和B細胞表位等,因此免疫原性也強,僅次于腫瘤細胞疫苗,可誘導特異性CTL產生和抗體產生,殺死靶細胞,抑制腫瘤生長,使一些腫瘤患者緩解。細胞毒性T細胞是T淋巴細胞的一部分,具有細胞毒性,在體細胞免疫中起重要作用,CTL是抗腫瘤免疫的主要效應細胞,同時還在抗病毒、抗細菌中作用突出。
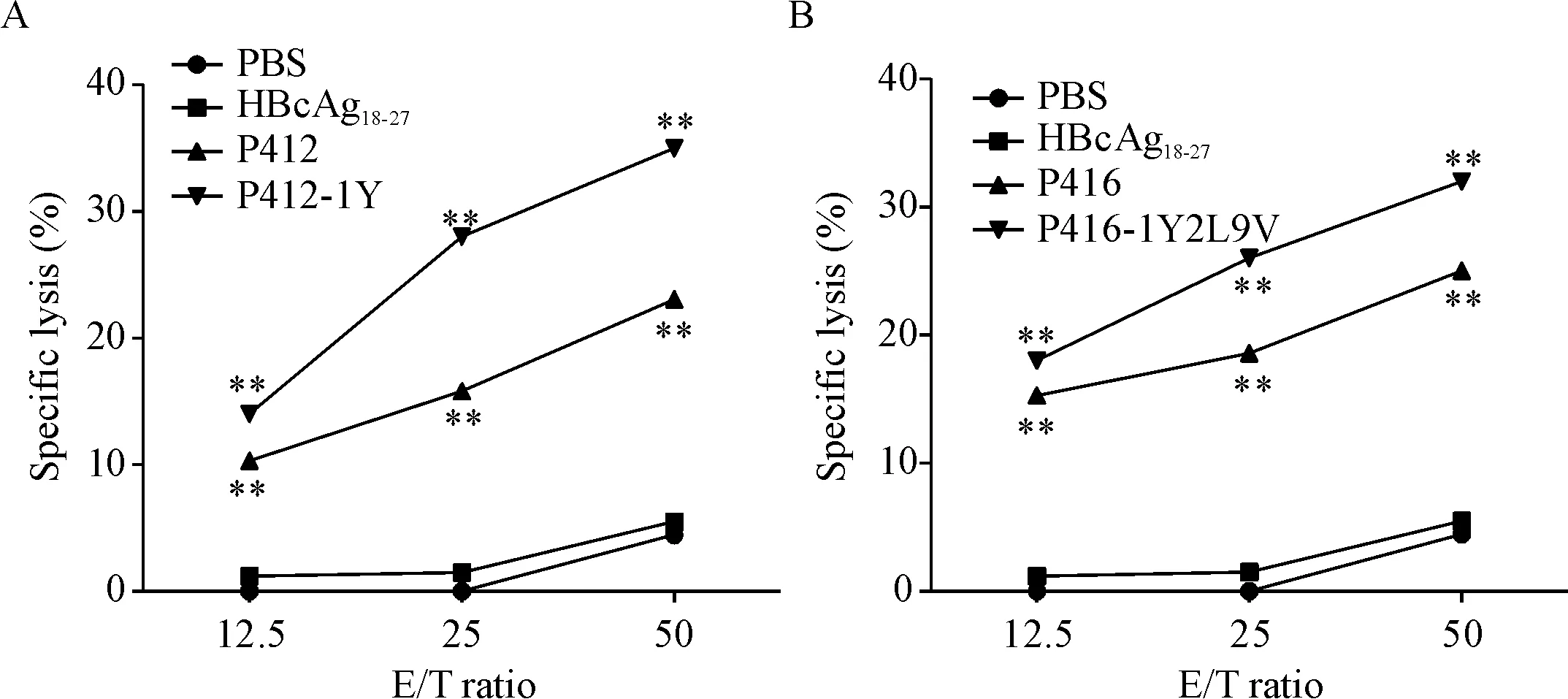
Figure 4. Detection of antigen-specific cytotoxicity by FACS-CTL assay. A: P412 and P412-1Y; B: P416 and P416-1Y2L9V. The effector/target (E/T) ratios were 12.5∶1, 25∶1 and 50∶1. CTLs induced by PBS and irrelevant peptide HBcAg18-27were used as negative control.**P<0.01vsPBS group.
圖4CFSE法特異性CTL的體外細胞毒實驗結果
在本研究中,我們檢查了腫瘤相關抗原PBF的HLA-A*0201結合肽的免疫原性。CTL識別腫瘤相關抗原是發展抗原特異性癌癥免疫治療的首要條件。然而,鑒于在建立自體腫瘤-CTL的技術難度,基于自體的抗原鑒定主要來自黑素瘤和腎細胞癌。在其它腫瘤,包括骨和軟組織肉瘤,已經使用反向免疫學方法,并且已經定義了來自腫瘤特異性融合基因的抗原肽,例如滑膜肉瘤中的SYT-SSX[24-25]、尤文氏肉瘤中的EWS-FLI1[23]和肺泡橫紋肌肉瘤中的PAX3-FKHR[26-27]。因為通過反向方法定義的肽不都是在腫瘤細胞中加工,所以在臨床應用之前需要嚴格評價這些合成肽。事實上,來自12名患有慢性骨髓性白血病[28],12名患有尤文氏肉瘤[26]和4名患有肺泡橫紋肌肉瘤的患者中,僅在具有尤文氏肉瘤的單個患者中導致腫瘤緩解。PBF來源的多肽可以進一步有效地提高骨肉瘤患者的存活率,特別是對當前化療方案沒有效果的患者。抗原肽-MHC-I 類分子復合物的形式表達于細胞表面,供特異性 CD8+T 細胞識別[28-29]。天然 CTL 表位與 MHC-I 的親和力較弱,也容易引起機體的免疫耐受,并且在體內易受蛋白酶的攻擊水解。針對這些不足,國內外許多學者采用了不同的方法對天然 CTL 表位進行改造[22]。1993年,Sundara等[30]證明HLA-A2.1結合基序可以被定位在位置2(P2)的亮氨酸(L)或甲硫氨酸(M)和位置9(P9)的亮氨酸(L)、纈氨酸(V)或異亮氨酸(I)。Tourdot等[31]表明,酪氨酸P1的替代可以提高HLA-A2-限制性表位的免疫原性。
預測T細胞表位的生物信息學方法很多,在本次研究中,選擇NetCTL 1.2、SYFPEITHI和IEDB等預測軟件,綜合這3個軟件的打分結果進行初步的表位篩選,篩選出的優勢表位,在氨基酸1、2、9位置進行適當的替換,所有的表位進行結合力實驗,從結合力實驗看出,經過氨基酸替換后的表位,可以提高MHC分子與表位肽的結合。隨后對親和力較高的表位進行體外免疫活性檢測,結果顯示,P412、P412-1Y、P416和P416-1Y2L9V多肽表位疫苗能檢測到特異性T細胞免疫,可以分泌較多的IFN-γ。并且這4條肽對靶細胞具有殺傷作用。表位的改造可以增強HLA的結合能力和T細胞(抗原)受體(T-cell receptor,TCR)的識別能力,可以更加有效的打破免疫耐受,氨基酸替換在多肽表位中可以有效地誘導肽特異性CTLs。多肽進行修飾可增加多肽在體內的半衰期,防止酶類的降解,提高其穩定性。對天然性多肽進行修飾是一條值得探索的腫瘤免疫治療途徑。
[1] Ferrari S, Palmerini E. Adjuvant and neoadjuvant combination chemotherapy for osteogenic sarcoma[J]. Curr Opin Oncol, 2007, 19(4):341-346.
[2] Ebata T, Yokoyama Y, Sugawara G, et al. Concept of perihilar cholangiocarcinoma in the General Rules for Cli-nical and Pathological Studies on Cancer of the Biliary Tract, 6th edition[J]. Nihon Geka Gakkai Zasshi, 2014, 115(4):201-205.
[3] Jahdasani R, Jamnani FR, Behdani M, et al. Identification of the immunogenic epitopes of the whole venom component of theHemiscorpiuslepturusscorpion using the phage display peptide library[J]. Toxicon, 2016, 124:83-93.
[4] Marasini N, Giddam AK, Khalil ZG, et al. Double adjuvanting strategy for peptide-based vaccines: trimethyl chitosan nanoparticles for lipopeptide delivery[J]. Nanome-dicine (Lond), 2016, 11(24):3223-3235.
[5] Walker KB, Guo M, Guo Y, et al. Novel approaches to preclinical research and TB vaccine development[J]. Tuberculosis (Edinb), 2016, 99 (Suppl 1):S12-S15.
[6] Alam A, Ali S, Ahamad S, et al. From ZikV genome to vaccine: in silico approach for the epitope-based peptide vaccine against Zika virus envelope glycoprotein[J]. Immunology, 2016, 149(4):386-399.
[7] Kwon AJ, Moon JY, Kim WK, et al. Protection efficacy of the Brucella abortus ghost vaccine candidate lysed by the N-terminal 24-amino acid fragment (GI24) of the 36-amino acid peptide PMAP-36 (porcine myeloid antimicrobial peptide 36) in murine models[J]. J Vet Med Sci, 2016, 78(10):1541-1548.
[8] Maki RG. Future directions for immunotherapeutic intervention against sarcomas[J]. Curr Opin Oncol, 2006, 18(4):363-368.
[9] Sato N, Hirohashi Y, Tsukahara T, et al. Molecular pathological approaches to human tumor immunology[J]. Pathol Int, 2009, 59(4):205-217.
[10] Boeckle S, Pfister H, Steger G. A new cellular factor recognizes E2 binding sites of papillomaviruses which mediate transcriptional repression by E2[J]. Virology, 2002, 293(1):103-117.
[11] Tsukahara T, Nabeta Y, Kawaguchi S, et al. Identification of human autologous cytotoxic T-lymphocyte-defined osteosarcoma gene that encodes a transcriptional regulator, papillomavirus binding factor[J]. Cancer Res, 2004, 64(15):5442-5448.
[12] Tsukahara T, Kawaguchi S, Torigoe T, et al. Prognostic impact and immunogenicity of a novel osteosarcoma antigen, papillomavirus binding factor, in patients with osteosarcoma[J]. Cancer Sci, 2008, 99(2):368-375.
[13] Sichtig N, Silling S, Steger G. Papillomavirus binding factor (PBF)-mediated inhibition of cell growth is regulated by 14-3-3β[J]. Arch Biochem Biophys, 2007, 464(1):90-99.
[14] Tsukahara T, Kimura S, Ichimiya S, et al. Scythe/BAT3 regulates apoptotic cell death induced by papillomavirus binding factor in human osteosarcoma[J]. Cancer Sci, 2009, 100(1):47-53.
[15] Jordanovski D, Herwartz C, Pawlowski A, et al. The hypoxia-inducible transcription factor ZNF395 is controlled by IκB kinase-signaling and activates genes involved in the innate immune response and cancer[J]. PLoS One, 2013, 8(9):e74911.
[16] Hasegawa R, Tomaru Y, de Hoon M, et al. Identification of ZNF395 as a novel modulator of adipogenesis[J]. Exp Cell Res, 2013, 319(3):68-76.
[17] Tsukahara T, Kawaguchi S, Torigoe T, et al. HLA-A*0201-restricted CTL epitope of a novel osteosarcoma antigen, papillomavirus binding factor[J]. J Transl Med, 2009, 7:44.
[18] 范柳笛, 劉 輝, 袁 磊, 等. 胰腺癌高表達抗原MUC4 CTL表位肽的篩選與改造[J]. 中國病理生理雜志, 2017, 33(5):811-816.
[19] 時冉冉, 李伯和, 袁 磊, 等. 腫瘤抗原PIWIL2的HLA-A2限制性CTL表位鑒定[J]. 中國病理生理雜志, 2015, 31(7):1315-1319.
[20] Zhu YH, Gao YF, Chen F, et al. Identification of novel T cell epitopes from efflux pumps of Mycobacterium tuberculosis[J]. Immunol Lett, 2011, 140(1-2): 68-73.
[21] Wu ZY, Gao YF, Wu YH, et al. Identification of a novel CD8+T cell epitope derived from cancer-testis antigen MAGE-4 in oesophageal carcinoma[J]. Scand J Immunol, 2011, 74(6):561-567.
[22] Liu W, Zhai M, Wu Z, et al. Identification of a novel HLA-A2-restricted cytotoxic T lymphocyte epitope from cancer-testis antigen PLAC1 in breast cancer[J]. Amino Acids, 2012, 42(6):2257-2265.
[23] Zhu B, Chen Z, Cheng X, et al. Identification of HLA-A*0201-restricted cytotoxic T lymphocyte epitope from TRAG-3 antigen[J]. Clin Cancer Res, 2003, 9(5):1850-1857.
[24] Li J, Shayan G, Avery L, et al. Tumor-infiltrating Tim-3+T cells proliferate avidly except when PD-1 is co-expressed: evidence for intracellular cross talk[J]. Oncoimmunology, 2016, 5(10):e1200778.
[25] Bacchi M, Jullian M, Sirigu S, et al. Total chemical synthesis, refolding, and crystallographic structure of fully active immunophilin calstabin 2 (FKBP12.6) [J]. Protein Sci, 2016, 25(12):2225-2242.
[26] Zou C, Zhao P, Xiao Z, et al. γδ T cells in cancer immunotherapy[J]. Oncotarget, 2017, 8(5):8900-8909.
[27] 陳紅蓮, 劉 輝, 楊旭光, 等. Notch3信號通路介導SAHA誘導的小細胞肺癌H446細胞凋亡[J]. 中國病理生理雜志, 2016, 32(9):1556-1561.
[28] Rosenberg SA, Restifo NP, Yang JC, et al. Adoptive cell transfer: a clinical path to effective cancer immunotherapy[J]. Nat Rev Cancer, 2008, 8(4):299-308.
[29] Xu X, Gu Y, Bian L, et al. Characterization of immune response to novel HLA-A2-restricted epitopes from zinc transporter 8 in type 1 diabetes[J]. Vaccine, 2016, 34(6):854-862.
[30] Sundara YT, Kostine M, Cleven AH, et al. Increased PD-L1 and T-cell infiltration in the presence of HLA class I expression in metastatic high-grade osteosarcoma: a ra-tionale for T-cell-based immunotherapy[J]. Cancer Immunol Immunother, 2017, 66(1):119-128.
[31] Tourdot S, Scardino A, Saloustrou E, et al. A general strategy to enhance immunogenicity of low-affinity HLA-A2.1-associated peptides: implication in the identification of cryptic tumor epitopes[J]. Eur J Immunol, 2000, 30(12): 3411-3421.
(責任編輯: 盧 萍, 羅 森)
Identification and molecular modification of cytotoxic T-lymphocyte epitopes from osteosarcoma high-expressing antigen PBF
ZHANG Jian-xin1, SHI Ran-ran2
(1XuchangUniversity,Xuchang461000,China;2LuoheMedicalCollege,Luohe462002,China.E-mail:ranranpeptide@163.com)
AIM: To observe whether modified epitopes from osteosarcoma high-expressing antigen papillomavirus-binding factor (PBF) have HLA-A2 restricted antitumor ability, and to develop peptide-based immunotherapy for osteosarcoma.METHODSRT-PCR and Western blot were used to determine the expression of PBF in the osteosarcoma cell lines U2OS and Saos-2. HLA-A2 epitopes from PBF protein were predicted by NetCTL 1.2, SYFPEITHI and IEDB. The modified peptides from PBF containing HLA-A2 binding anchor motifs were designed by replacing the anchor residues. The peptides were synthesized by standard solid-phase methods, and the binding affinity of the peptides to HLA-A*0201 was evaluated by T2A2 cell binding assay. ELISPOT assay was used to investigate the seretion of interferon-γ (IFN-γ) from the peptide-induced specific cytotoxic T-lymphocytes (CTLs). The ability of inducing T-cell response was analyzed by lactate dehydrogenase (LDH) release assay and carboxyfluorescein succinimidyl ester (CFSE) cytotoxicity assayinvitro.RESULTSThe expression of PBF was observed in the U2OS and Saos-2 cells. The candidate peptides P75-1Y2L, P412-1Y, P416-1Y2L9V, P107-1Y and P435-1Y2L showed moderate affinity toward HLA-A2 molecule. The modified peptides showed significantly higher affinity with HLA-A2 than the native peptide. ELISPOT assay showed that P412, P412-1Y, P416, P416-1Y2L9V and P435-1Y2L induced specific CTLs to secrete IFN-γ, and P412-1Y and P416-1Y2L9V induced more secretion of IFN-γ than the native peptide. The CTLs induced by P412, P412-1Y, P416 and P416-1Y2L9V lysed U2OS cells. P412-1Y and P416-1Y2L9V peptide-specific CTLs showed higher cytotoxicity against U2OS cells than the native peptide-specific CTLs.CONCLUSIONCompared with the native peptide, modified epitopes P412-1Y and P416-1Y2L9V have higher binding affinity with HLA-A*0201 and retain immunogenecity. In addition, the anti-tumor immunity effects of modified epitopes P412-1Y and P416-1Y2L9V are stronger than the native peptide. The peptides P412-1Y and P416-1Y2L9V is excellent HLA-A*0201 restricted CTL epitopes from tumor antigen PBF, which could serve as new candidates towards antitumor peptide vaccines.
Papillomavirus-binding factor; Epitopes; Cytotoxic T-lymphocyte; Osteosarcoma
1000- 4718(2017)11- 1993- 07
2017- 05- 04
2017- 06- 06
河南省科技廳科技發展計劃項目(No. 142102310203);漯河醫學高等專科學校科研基金資助項目(No. 2017-S-LMC-3)
△通訊作者 Tel: 0395-2964509; E-mail: ranranpeptide@163.com
R738.1; R392.3
A
10.3969/j.issn.1000- 4718.2017.11.012

