HSF1對LPS誘導的急性肺損傷小鼠的保護作用及其相關差異表達基因的篩選*
肖 歸, 王桂良, 陳廣文, 王小莉, 張華莉, 王慷慨, 劉梅冬, 劉 可, 肖獻忠△
(1中南大學湘雅醫學院病理生理學系, 湖南 長沙 410008; 2海南醫學院國際護理學院, 海南 海口 571199; 3贛南醫學院附屬萍鄉醫院消化內科, 江西 萍鄉 337000)
·短篇論著·
HSF1對LPS誘導的急性肺損傷小鼠的保護作用及其相關差異表達基因的篩選*
肖 歸1,2, 王桂良3△, 陳廣文1, 王小莉1, 張華莉1, 王慷慨1, 劉梅冬1, 劉 可1, 肖獻忠1△
(1中南大學湘雅醫學院病理生理學系, 湖南 長沙 410008;2海南醫學院國際護理學院, 海南 海口 571199;3贛南醫學院附屬萍鄉醫院消化內科, 江西 萍鄉 337000)
目的探討熱休克因子1(heat shock factor 1,HSF1)減輕脂多糖(lipopolysaccharide,LPS)誘導的小鼠急性肺損傷的作用及其分子機制。方法采用氣管滴注LPS的方法制備小鼠急性肺損傷模型,觀察HSF1野生型小鼠(HSF1+/+)和HSF1敲除小鼠(HSF1-/-)肺大體改變和肺組織病理改變,檢測支氣管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中總蛋白、血管內皮生長因子(vascular endothelial growth factor, VEGF)、腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)、白細胞介素(interleukin,IL)-1β和IL-6的蛋白表達。 采用基因芯片技術篩選經LPS處理后的HSF1+/+和HSF1-/-小鼠肺組織中的差異表達基因,并進一步采用real-time PCR對CXC趨化因子受體2(CXC chemokine receptor 2,CXCR2)的表達進行驗證。結果與經LPS刺激后的HSF1+/+小鼠相比,經LPS刺激的HSF1-/-小鼠肺大體和病理損傷加重,BALF中總蛋白、VEGF、TNF-α、IL-1β和IL-6的含量升高,差異具有統計學意義(P<0.05)。 基因芯片分析發現,與經LPS處理的HSF1+/+小鼠相比,HSF1-/-小鼠共篩選出918個差異基因,有65個基因表達差異明顯,其中Atg7、ccr1、cxcr2、Tbl1xr1、Mmp9、Pparg、Plcb2、Arrb2、Cntn1、Col4a6等共 28個基因在HSF1-/-小鼠的肺組織中表達明顯上調;Fgfr1、Fgfr2、Map4k4、Ddx58、Tfg、Stat3、Smad4、Lamc1、Sdc3等共37個基因表達明顯下調。 Real-time PCR結果顯示,CXCR2的mRNA水平在LPS刺激的HSF1-/-小鼠肺組織較HSF1+/+小鼠表達明顯上調,表達趨勢與基因芯片結果一致。結論HSF1能減輕LPS誘導的小鼠急性肺損傷,CXCR2可能參與了對肺組織的保護作用。
急性肺損傷; 熱休克因子1; 基因芯片; 差異基因表達
急性肺損傷(acute lung injury,ALI)指由各種非心源性因素造成肺部炎癥和通透性增加的綜合征,主要表現為肺毛細血管內皮細胞以及肺泡上皮細胞損傷和急性進行性缺氧性呼吸衰竭[1],主要病因為感染、膠原血管疾病、藥物攝入、吸入有害物質、休克、急性嗜酸性肺炎、免疫介導的肺出血和血管炎及放射性肺炎等。ALI發病率和病死率極高且各種治療方法效果不理想,因此在臨床治療和基礎研究中都引起了高度的重視[2-3]。脂多糖(lipopolysaccharide,LPS)是革蘭氏陰性菌細胞壁外膜的主要成分,采用氣管滴注LPS的方式可用來制備ALI模型[4]。
當生物體遭受感染、毒物、高溫、自由基等應激原作用時,機體會出現熱休克反應(heat shock response,HSR)[5]。HSR受轉錄因子家族精細調控,熱休克因子1(heat shock factor 1,HSF1)是其中最重要的轉錄因子。本科室在前期研究中也發現,HSF1-/-小鼠對LPS的敏感性顯著增強,HSF1對LPS所致的內毒素血癥具有明顯的抑制作用[6],但是HSF1對ALI是否具有抑制作用以及具體機制目前尚不明確。
基因芯片可通過探針分子與樣品分子雜交,檢測雜交信號的強弱從而獲得樣品分子的數量和序列信息,具有高效率和便捷的優點[7]。本研究以HSF1+/+小鼠和HSF1-/-小鼠為研究動物,經氣管滴注LPS制備ALI模型,分析HSF1對ALI的保護作用,并采用基因芯片技術篩選HSF1+/+小鼠和HSF1-/-小鼠ALI模型中肺組織基因表達譜的差異,探索HSF1在LPS誘導的ALI中起保護作用的潛在分子機制。
材 料 和 方 法
1動物
SPF級HSF1-/-和HSF1+/+小鼠,由美國德克薩斯大學西南研究中心Ivor J. Benjamin惠贈,喂養在中南大學湘雅醫學院實驗動物中心,由專人負責小鼠基因型檢測,獲取雄性HSF1-/-和HSF1+/+小鼠,2~3月齡,25 g左右。將小鼠分為HSF1+/++生理鹽水(NS)組、HSF1+/++LPS組、HSF1-/-+NS組以及HSF1-/-+LPS組,其中,HSF1+/++LPS組和HSF1-/-+LPS組按照5 mg/kg的劑量從氣管滴注LPS(濃度0.8 g/L),而HSF1+/++NS組和HSF1-/-+NS組從氣管滴注同等體積的NS。
2主要試劑
LPS購于Sigma;BCA蛋白定量試劑盒和4%多聚甲醛購于北京鼎國生物公司;血管內皮生長因子(vascular endothelial growth factor,VEGF)、腫瘤壞死因子α(tumor necrosis factor α, TNF-α)、白細胞介素(interleukin,IL)-1β和IL-6的ELISA試劑盒購買自欣博盛生物科技公司;Trizol試劑購于Invitrogen;PCR反轉錄試劑盒以及Taq聚合酶均購自TaKaRa;GeneChip? Mouse Transcriptome Assay 1.0為Affymetrix產品(含23 000個基因)。
3主要方法
3.1小鼠急性肺損傷模型的建立 用1.5%水合氯醛(10 mL/kg)腹腔注射麻醉小鼠,暴露小鼠氣管后,用1 mL注射器緩慢滴加LPS(5 mg/kg, 濃度為0.8 g/L)入氣管內,豎立起小鼠,旋轉,使LPS分布均勻,對照組給予NS氣管內滴注。
3.2觀察小鼠肺大體變化情況 造模6 h后處死小鼠,取出肺組織,用濾紙吸去表面血漬,肉眼觀察不同組小鼠肺組織的大小、顏色、形狀等指標。
3.3小鼠肺組織病理變化的觀察 小鼠肺組織取材后,使用4%多聚甲醛固定24 h,經石蠟包埋后做成10 μm切片,切片使用二甲苯脫蠟后,經各級乙醇至水洗環節,HE染色5~15 min,常規清洗、脫水、封片,置于光學顯微鏡觀察肺部組織學改變,顯微鏡下隨機選擇3~5個視野,于200倍和400倍拍照,不同染色相同視野采用Adobe Photoshop CS6軟件疊加合成。
3.4ELISA法測定小鼠支氣管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中細胞因子的含量 暴露小鼠氣管,用1 mL注射器抽1 mL PBS緩慢注入支氣管,用手指輕輕振蕩小鼠胸廓1 min,然后回抽液體,保存在EP管中,1 500 r/min離心5 min,上清用于BCA蛋白定量和VEGF、TNF-α、IL-1β和IL-6的蛋白含量檢測。
3.5肺組織 RNA 的提取 用Trizol試劑抽提小鼠肺組織的總RNA,用DNA酶消化除去總RNA中的DNA, 1.0%瓊脂糖凝膠電泳檢測總RNA,紫外分光光度計測量A260/A280比值。
3.6基因芯片檢測 在PCR管配制總RNA變性反應體系,變性反應結束后配制cDNA第一鏈合成反應體系,體系內含Cy3/Cy5熒光標記。取出經定量的Cy3和Cy5標記的探針,混合于PCR管內,加入雜交緩沖液和甲酰胺。將雜交芯片水平放入加有PBS的雜交盒,置42 ℃雜交箱中避光雜交,結束后,將芯片盒用Affymetrix 掃描儀掃描獲取圖像并導入圖像分析軟件,采用 GeneChip Scanner 3000 對芯片結果進行掃描,用 Command Console Softeware 4.0 讀取原始數據,采用 Expression Console對合格數據進行歸一化處理。使用GeneSpring和Cluster分析軟件進行聚類分析,用Pathway進行基因信號通路分析。
3.7Real-time PCR的驗證 采用Real-time PCR的方法對在HSF1+/+和HSF1-/-小鼠肺組織中表達有差異的關鍵基因CXCR2進一步驗證。檢測基因引物序列由金斯瑞公司設計合成,CXCR2上游引物為5’-TCTGCCACAAAAGCGTCTA-3’,下游引物為5’-GAGTGGCATGGGTTAGTTGG-3’;以β-actin 作為內參照,上游引物為5’-GGGAAATCGTGCGTGACAT-3’,下游引物為5’-CAGGAGGAGCAATGATCTT-3’。配制20 μL的反應體系:上游引物 0.5 μL,下游引物 0.5 μL,SYBR Enzyme 10 μL,cDNA 1 μL,無酶水8 μL。反應條件為: 95 ℃預變性10 min, 95 ℃變性30 s, 60 ℃延伸1 min,40 個循環。
4統計學處理
采用SPSS 19.0統計軟件對數據進行分析,計量資料以均數±標準差(mean±SD)表示,兩組樣本之間比較選用獨立樣本t檢驗,以P<0.05為差異有統計學意義。
結 果
1HSF1減輕LPS誘導的ALI小鼠肺大體損傷
未經LPS刺激的HSF1+/+和HSF1-/-小鼠中,肺大體標本無明顯損害,經LPS刺激后,HSF1+/+和HSF1-/-小鼠肺體積變大,水腫明顯,且顏色明顯變黑,HSF1-/-組的肺組織病變損傷程度明顯重于HSF1+/+組,見圖1。
2HSF1減輕LPS誘導的ALI小鼠肺組織病理學損傷
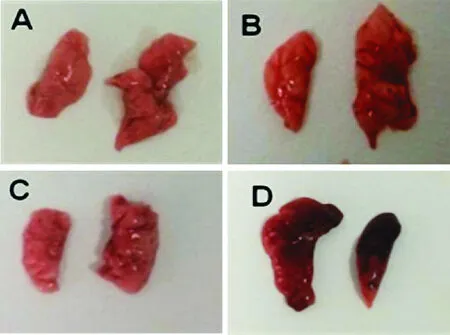
Figure 1. Macroscopic changes of the lung tissue ofHSF1-/-andHSF1+/+mice with ALI induced by LPS. A:HSF1+/++NS group; B:HSF1+/++LPS group; C:HSF1-/-+NS group; D:HSF1-/-+LPS group.
圖1LPS誘導的急性肺損傷HSF1-/-小鼠和HSF1+/+小鼠肺大體標本觀察
未經LPS刺激的HSF1+/+和HSF1-/-小鼠中,肺組織切片均未見明顯異常,經LPS刺激后,HSF1+/+和HSF1-/-小鼠肺泡壁毛細血管充血明顯,細支氣管腔內存在大量脫落炎性細胞及滲出物,肺泡腔及間質內可見大量紅細胞和多形核白細胞浸潤,并伴有血栓形成,HSF1-/-組小鼠較HSF1+/+小鼠肺組織的損傷明顯加重,見圖2。
Figure 2. Pathological changes of the lung tissue ofHSF1-/-andHSF1+/+mice with ALI induced by LPS (HE staining, ×40). A:HSF1+/++NS group; B:HSF1+/++LPS group; C:HSF1-/-+NS group; D:HSF1-/-+LPS group.
圖2LPS誘導的急性肺損傷HSF1-/-小鼠和HSF1+/+小鼠肺組織病理觀察
3HSF1降低LPS誘導的ALI小鼠BALF中蛋白總量和VEGF濃度
未經LPS刺激的HSF1+/+和HSF1-/-小鼠中,肺組織中總蛋白和VEGF表達均較低,差異無統計學顯著性;經LPS刺激后,HSF1+/+和HSF1-/-小鼠肺組織中總蛋白和VEGF表達均顯著升高,HSF1-/-組比與HSF1+/+組更高,差異具有統計學意義(P<0.05),見圖3。
Figure 3. The changes of the concentrations of total protein and VEGF in BALF ofHSF1-/-andHSF1+/+mice with ALI induced by LPS. Mean±SD.n=6.##P<0.01vsHSF1+/++NS group;△△P<0.01vsHSF1-/-+ NS group.*P<0.05,**P<0.01vsHSF1+/++LPS group.
圖3LPS誘導的急性肺損傷HSF1-/-小鼠和HSF1+/+小鼠BALF中總蛋白和VEGF濃度的變化
4HSF1降低LPS誘導的ALI小鼠BALF中TNF-α、IL-1β和IL-6濃度
ELISA結果顯示,未經LPS刺激的HSF1+/+和HSF1-/-小鼠BALF中TNF-α、IL-1β和IL-6的蛋白表達均較低,差異無統計學顯著性;經LPS刺激后,HSF1+/+和HSF1-/-小鼠BALF中TNF-α、IL-1β和IL-6炎癥因子的蛋白表達均顯著升高,HSF1-/-組比與HSF1+/+組更高,差異具有統計學意義(P<0.05),見圖4。
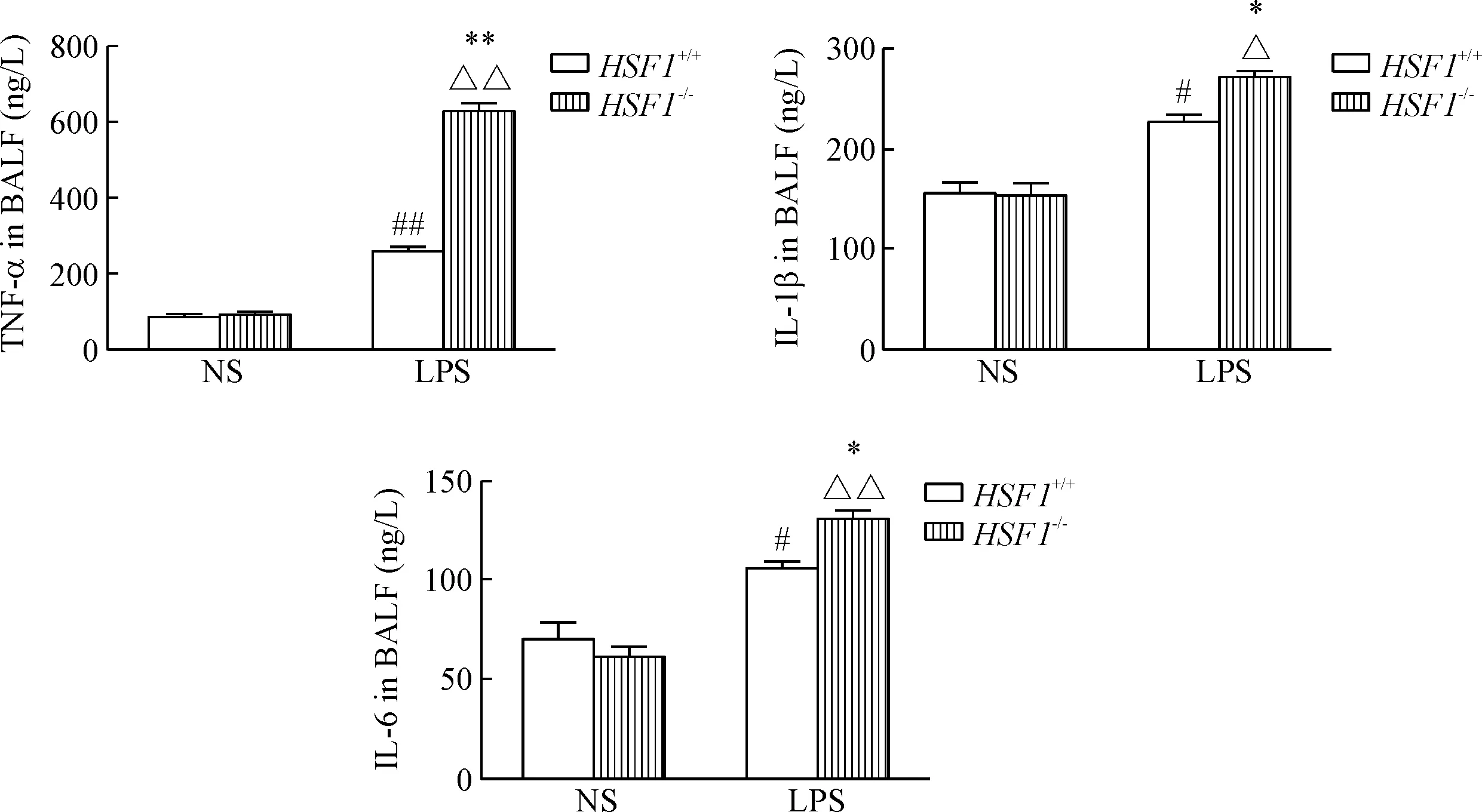
Figure 4. The concentrations of inflammatory factors in the BALF ofHSF1-/-andHSF1+/+mice with LPS-induced ALI. Mean±SD.n=6.#P<0.05,##P<0.01vsHSF1+/++NS group;△P<0.05,△△P<0.01vsHSF1-/-+NS group;*P<0.05,**P<0.01vsHSF1+/++LPS group.
圖4LPS誘導的急性肺損傷HSF1-/-小鼠和HSF1+/+小鼠BALF中炎癥因子濃度的變化
5芯片結果的聚類分析
基因進行聚類分析顯示發現:與HSF1+/+小鼠相比,HSF1-/-小鼠一共篩選到918個差異基因,其中有188個基因表達下調,730個基因表達上調。
6芯片結果的信號通路分析
與HSF1+/+小鼠相比,HSF1-/-小鼠肺組織中65個信號通路相關基因表達具有顯著差異,有28個基因表達水平上調,有37個基因表達水平下調。GO 信息分析顯示上述差異基因主要與代謝調控、應激反應、炎癥因子分泌調控、趨化因子調控、蛋白修飾、自身免疫性疾病等密切相關。
7Real-timePCR驗證實驗結果
研究證明,CXCR2與ALI密切相關,因此我們選定CXCR2來進行驗證。結果顯示,未經LPS刺激的HSF1+/+和HSF1-/-小鼠肺組織中CXCR2的mRNA表達均較低,差異無統計學顯著性;經LPS刺激后,HSF1+/+和HSF1-/-小鼠肺組織CXCR2的mRNA表達均顯著升高,HSF1-/-組比與HSF1+/+組更高,差異具有統計學意義(P<0.05),變化趨勢與基因芯片結果一致,見圖5。
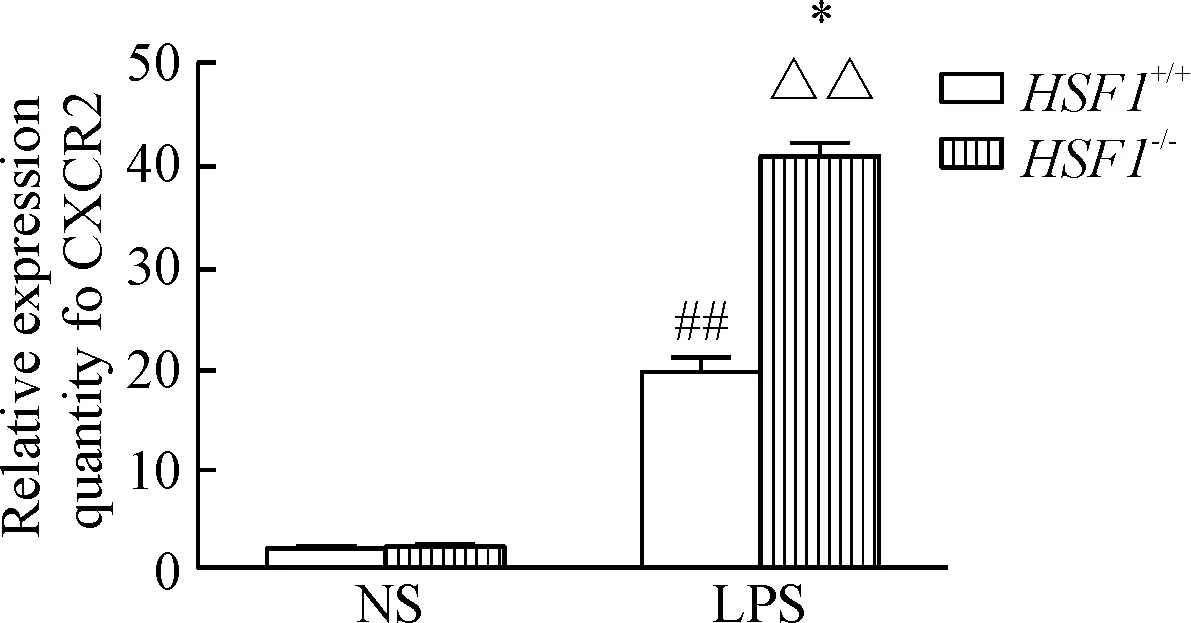
Figure 5. The mRNA level of CXCR2 in the lung tissue ofHSF1-/-andHSF1+/+mice with LPS-induced ALI. Mean±SD.n=6.##P<0.01vsHSF1+/++NS group;△△P<0.01vsHSF1-/-+NS group;*P<0.05vsHSF1+/++LPS group.
圖5LPS誘導的急性肺損傷HSF1-/-小鼠和HSF1+/+小鼠肺組織中CXCR2的mRNA表達
討 論
ALI的臨床表現主要為進行性呼吸窘迫綜合征和低氧血癥,它發病機制非常復雜,炎癥反應是其重要的機制之一[8-9]。眾多研究證明,ALI的嚴重程度與中性粒細胞和巨噬細胞活化的程度以及遷移到肺泡的數目密切相關,活化的中性粒細胞和巨噬細胞能夠產生許多細胞毒性物質,包括顆粒酶、活性氧、活性脂、各種促炎細胞因子和中性粒細胞胞外陷阱,它們通過網織形成陷阱捕獲細胞外的病原體,這對于ALI發展至關重要[10-12]。
眾多研究證明,HSF1是必不可少的熱休克基因,HSF1-/-動物的細胞在遭受高溫等刺激時,相比于野生型動物更容易凋亡,這證明了HSF1能夠提高細胞的存活率[13]。HSF1能夠提高存活率這一現象在很多動物中也有證實。本科室在前期研究中也發現,HSF1-/-小鼠對LPS的敏感性顯著增強,并且其生存率顯著降低,且HSF1能夠有效減少內毒素血癥中TNF-α、IL-1β、IL-6等炎癥因子的表達水平,這些結果表明,HSF1對LPS所導致的內毒素血癥具有明顯的抑制作用[14-15]。但是HSF1對ALI小鼠是否具有保護作用以及具體機制目前尚不明確。本研究結果顯示, 未經LPS刺激的HSF1+/+和HSF1-/-小鼠中, 肺組織的大體標本和病理無明顯異常,肺組織中總蛋白、VEGF、TNF-α、IL-1β和IL-6的蛋白表達均較低且無統計學差異;經LPS刺激后,HSF1+/+和HSF1-/-小鼠肺組織的大體標本和病理標本出現損傷、肺組織中總蛋白、VEGF、TNF-α、IL-1β和IL-6炎癥因子的蛋白表達均顯著升高;HSF1-/-+LPS組與HSF1+/++LPS組小鼠相比,肺組織的損傷更重,肺組織中總蛋白、VEGF、TNF-α、IL-1β和IL-6炎癥因子的蛋白進一步升高,以上結果表明LPS能誘導小鼠ALI,在非刺激的狀態下,HSF1對HSF1肺組織中總蛋白、VEGF、TNF-α、IL-1β和IL-6炎癥因子的表達不起調節作用,經LPS刺激后,HSF1能減輕LPS所致的ALI小鼠血管通透程度,抑制肺組織中總蛋白、VEGF、TNF-α、IL-1β和IL-6炎癥因子的表達從而減輕肺部的損傷情況。
為了進一步了解HSF1對ALI的炎癥相關基因的調控,本研究采用基因芯片技術,篩選出了LPS刺激的HSF1-/-小鼠中918個差異基因,其中Atg7、ccr1、cxcr2、Tbl1xr1、Mmp9、Pparg、Plcb2、Arrb2、Cntn1、Col4a6等共 28個基因明顯上調,Fgfr1、Fgfr2、Map4k4、Ddx58、Tfg、Stat3、Smad4、Lamc1、Sdc3等共37個基因明顯下調,這些表達差異明顯的基因主要與代謝調控應激反應、細胞因子分泌、炎癥應答、趨化蛋白調控、自身免疫反應等分子生物學過程相關。通過查閱文獻[16-17],我們最終選定CXCR2來鑒定。CXCR2是趨化中性粒細胞的主要趨化因子受體之一,主要通過和IL-8(CXCL8)等趨化因子結合后產生效應,其主要功能是能夠趨化中性粒細胞等炎癥細胞到損傷部位,參與機體的防御反應或者中性粒細胞的大量增加從而產生更為廣泛的組織損傷。CXCR2是一個與ALI密切相關的基因,但目前尚無文獻報道HSF1與 CXCR2 在調控 LPS誘導的ALI中的作用。本研究通過基因芯片技術和 real-time PCR結果顯示未經LPS刺激的HSF1+/+和HSF1-/-小鼠肺組織中CXCR2 mRNA表達均較低且無統計學差異;經LPS刺激后,HSF1+/+和HSF1-/-小鼠肺組織CXCR2 mRNA表達均顯著升高,HSF1-/-組比與HSF1+/+組更高,說明HSF1對 LPS 誘導的ALI炎癥保護機制可能是通過下調CXCR2的表達實現的,但HSF1是否通過與CXCR2的啟動子區直接結合而調控其表達,是否和其它轉錄因子協同調控其表達等問題,尚需進一步研究。
總之,本研究證明了HSF1對LPS誘導的急性肺損傷小鼠具有保護作用, CXCR2可能參與了對肺組織的保護作用,這對進一步揭示 ALI/ARDS 的潛在防治靶點有著重要意義。
[1] Restrepo MI, Chalmers JD, Song Y, et al. Year in review 2016: Respiratory infections, acute respiratory distress syndrome, pleural diseases, lung cancer and interventional pulmonology[J]. Respirology, 2017, 22(3):602-611.
[2] ARDS Definition Task Force, Ranieri VM, Rubenfeld GD, et al. Acute respiratory distress syndrome: the Berlin Definition[J]. JAMA, 2012, 307(23):26-33.
[3] Zochios V, Parhar K, Tunnicliffe W, et al. The right ventricle in ARDS[J]. Chest, 2017, 152(1):181-193.
[4] Driscoll KE, Costa DL, Hatch G, et al. Intratracheal instillation as an exposure technique for the evaluation of respiratory tract toxicity: uses and limitations[J]. Toxicol Sci, 2000, 55(1):24-35.
[5] Dokladny K, Myers OB, Moseley PL. Heat shock response and autophagy-cooperation and control[J]. Autophagy, 2015, 11(2):200-213.
[6] 陳淑華. HSF1對內毒素血癥小鼠多器官損傷的保護作用及其機制[D]. 長沙: 中南大學, 2012.
[7] Marshall A, Hodgson J. DNA chips: an array of possibilities[J]. Nat Biotechnol, 1998, 16(1):27-31.
[8] 姜遠旭, 徐世元, 張雪萍, 等. 右美托咪定聯合烏司他丁減輕脂多糖誘導的大鼠急性肺損傷[J]. 中國病理生理雜志, 2014, 30(1):96-101.
[9] Shen H, Wu N, Wang Y, et al. Chloroquine attenuates paraquat-induced lung injury in mice by altering inflammation, oxidative stress and fibrosis[J]. Int Immunopharmacol, 2017, 46:16-22.
[10] Slater TW, Finkielsztein A, Mascarenhas LA, et al. Neutrophil microparticles deliver active myeloperoxidase to injured mucosa to inhibit epithelial wound healing[J]. J Immunol, 2017, 198(7):2886-2897.
[11] Gerin F, Sener U, Erman H, et al. The effects of quercetin on acute lung injury and biomarkers of inflammation and oxidative stress in the rat model of sepsis[J]. Inflammation, 2016, 39(2):700-705.
[12] 高 陽, 劉 斌, 哈尼再爾·熱合曼, 等. 黑木耳多糖對內毒素誘導急性肺損傷大鼠肺組織的保護作用[J]. 中國病理生理雜志, 2015, 31(9): 1704-1708, 1714.
[13] Verghese J, Abrams J, Wang Y, et al. Biology of the heat shock response and protein chaperones: budding yeast (Saccharomycescerevisiae) as a model system[J]. Microbiol Mol Biol Rev, 2012, 76(2):115-158.
[14] Chen S, Zuo X, Yang M, et al. Severe multiple organ injury in HSF1 knockout mice induced by lipopolysaccharide is associated with an increase in neutrophil infiltration and surface expression of adhesion molecules[J]. J Leukoc Biol, 2012, 92(4):851-857.
[15] Xiao X, Zuo X, Davis AA, et al. HSF1 is required for extra-embryonic development, postnatal growth and protection during inflammatory responses in mice[J]. EMBO J, 1999, 18(21):5943-5952.
[16] Bajrami B, Zhu H, Kwak HJ, et al. G-CSF maintains controlled neutrophil mobilization during acute inflammation by negatively regulating CXCR2 signaling[J]. J Exp Med, 2016, 213(10):1999-2018.
[17] Hoegl S, Ehrentraut H, Brodsky KS, et al. NK cells regulate CXCR2+neutrophil recruitment during acute lung injury[J]. J Leukoc Biol, 2017, 101(2):471-480.
(責任編輯: 盧 萍, 羅 森)
Protective effect of HSF1 on mice with LPS-induced acute lung injury and screening of relevant differentially-expressed genes
XIAO Gui1, 2, WANG Gui-liang3, CHEN Guang-wen1, WANG Xiao-li1, ZHANG Hua-li1, WANG Kang-kai1, LIU Mei-dong1, LIU Ke1, XIAO Xian-zhong1
(1DepartmentofPathophysiology,XiangyaSchoolofMedicine,CentralSouthUniversity,Changsha410008,China;2DepartmentofInternationalSchoolofNursing,HainanMedicalUniversity,Haikou571199,China;3DigestionDepartmentofGannanMedicalUniversityPingxiangHospital,Pingxiang337000,China.E-mail:xiaoxianzhongcsu@163.com;gui-liangwang@126.com)
AIM: To study the protective effect of heat shock factor1 (HSF1) on the mice with lipopolysaccharide (LPS)-induced acute lung injury (ALI), and to screen the relevant differentially-expressed genes.METHODSALI mouse model was established by LPS intracheal instillation. The macroscopic and pathological changes of the lung tissue were observed, and the concentrations of total protein, TNF-α, IL-β, IL-6 and VEGF in the bronchoalveolar lavage fluid (BALF) were analyzed. Differentially-expressed genes in the lung tissues ofHSF1+/+mice andHSF1-/-mice with ALI induced by LPS were screened by gene chips. The key gene was verified by real-time qPCR.RESULTSThe macroscopic and pathological changes of the lung injury inHSF1-/-+LPS mice were more serious than those inHSF1+/++LPS mice. The concentrations of total protein, VEGF, TNF-α, IL-1β and IL-6 in the BALF ofHSF1-/-+LPS mice were significantly higher than those ofHSF1+/++LPS mice (P<0.05). Compared with theHSF1+/+mice, a total of 918 differentially-expressed genes were indentified in theHSF1-/-mice, among which the expression levels of 65 genes had obvious diffe-rence, with 28 genes up-regulated, includingAtg7,ccr1,cxcr2,Tbl1xr1,Mmp9,Pparg,Plcb2,Arrb2,Cntn1,Col4a6, etc, and 37 genes down-regulated, includingFgfr1,Fgfr2,Map4k4,Ddx58,Tfg,Stat3,Smad4,Lamc1,Sdc3, etc. The results of real-time qPCR showed that the mRNA level of CXCR2 inHSF1-/-+ LPS mice was significantly higher than that inHSF1+/++ LPS mice, which was consistent with the results of gene chips.CONCLUSIONHSF1 has protective effect on the mice with LPS-induced ALI. CXCR2 may be involved in the protective effect of HSF1 on this process.
Acute lung injury; Heat shock factor 1; Gene chips; Differential gene expression
1000- 4718(2017)11- 2073- 06
2017- 04- 17
2017- 06- 20
國家自然科學基金資助項目(No. 81360080;No. 81671895)
△通訊作者 肖獻忠 Tel: 13873102115; E-mail: xiaoxianzhongcsu@163.com; 王桂良 Tel: 15879456496; E-mail: guiliangwang@126.com
R363; R563
A
10.3969/j.issn.1000- 4718.2017.11.024

