干擾3T3-L1脂肪細胞生長激素受體對生長激素誘導的細胞炎癥因子表達和分泌的影響*
錢慧琳, 黃 靚, 巢 汝, 周 凡, 屈順林, 張 弛
(南華大學心血管病研究所, 動脈硬化學湖南省重點實驗室, 湖南 衡陽 421001)
干擾3T3-L1脂肪細胞生長激素受體對生長激素誘導的細胞炎癥因子表達和分泌的影響*
錢慧琳, 黃 靚, 巢 汝, 周 凡, 屈順林, 張 弛△
(南華大學心血管病研究所, 動脈硬化學湖南省重點實驗室, 湖南 衡陽 421001)
目的探討干擾3T3-L1脂肪細胞生長激素受體(GHR)對生長激素(GH)誘導的脂肪細胞核因子κB(NF-κB)激活及炎癥細胞因子mRNA表達和分泌的影響。方法采用RNA干擾技術抑制3T3-L1脂肪細胞中GHR的表達;Western blot檢測GHR的蛋白表達;雙螢光素酶報告基因系統分析GHR對GH激活的3T3-L1脂肪細胞NF-κB轉錄活性的影響;real-time RT-PCR和ELISA技術檢測GHR對GH誘導的3T3-L1脂肪細胞炎癥因子mRNA表達和分泌的影響。結果干擾3T3-L1脂肪細胞GHR的表達能夠顯著抑制生長激素誘導的細胞NF-κB的激活,并減少TNF-α、IL-1β和IL-6等炎癥細胞因子的mRNA表達和分泌。結論干擾3T3-L1脂肪細胞GHR可抑制GH誘導的炎癥細胞因子表達和分泌。
慢性低度炎癥; 脂肪細胞; 生長激素; 生長激素受體; 炎癥細胞因子
生長激素(growth hormone,GH)是體內調節生長發育和糖脂代謝的重要激素。GH通過與細胞膜上的生長激素受體(growth hormone receptor,GHR)結合,激活胞質內的Janus激酶2(Janus kinase 2,JAK2),繼而活化信號轉導與轉錄活化因子5(signal transducer and activator of transcription 5,STAT5)。STAT5發生細胞核移位,并與靶基因啟動子的特殊序列結合,激活基因轉錄,調節細胞的增殖、分化、凋亡及免疫等多種生理功能[1]。研究發現,GH能夠拮抗胰島素的作用[2]。GH分泌異常還與肥胖、高胰島素血癥和胰島素抵抗等代謝功能紊亂密切相關[3]。另外,1型糖尿病患者血漿GH水平顯著高于正常人[4-5]。這些結果說明GH及其信號通路障礙可能是胰島素抵抗及糖尿病發病機制的重要環節。
脂肪組織是人體必需的組成部分,它不僅參與能量代謝,而且還能夠分泌多種脂肪細胞因子、炎癥細胞因子及生長因子[6]。研究發現,GH可誘導3T3-F442A前脂肪細胞核因子κB(nuclear factor-κB,NF-κB)激活,使NF-κB/p65亞單位磷酸化水平增加,并促進腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)、白細胞介素(interleukin,IL)-1β、IL-4、IL-6、誘導型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、單核細胞趨化蛋白1 (monocyte chemotactic protein 1,MCP-1)及巨噬細胞炎癥蛋白1α(macrophage inflammatory protein-1α,MIP-1α)的表達[7]。脂肪細胞的這些變化可誘發脂肪組織慢性低度炎癥,促進胰島素抵抗的形成。在此基礎上本研究進一步探討了抑制GHR表達對GH誘導的3T3-L1脂肪細胞NF-κB轉錄激活和炎癥細胞因子表達及分泌的影響。
材 料 和 方 法
1材料
小鼠3T3-L1前脂肪細胞由美國典型培養物保藏中心(American Type Culture Collection,ATCC)提供;青霉素、鏈霉素、3-異丁基-1-甲基黃嘌呤、地塞米松、胰島素和重組人生長激素(hGH)購自Sigma-Aldrich;新生牛血清和高糖DMEM細胞培養液購自Gibco;si-RNA-GHR和siRNA-duplex購自Origene;siLentFect脂質試劑和iScriptTMReverse Transcription Supermix購自Bio-Rad;抗鼠GHR抗體購自Santa Cruz;抗鼠GAPDH抗體購自Cell Signaling Technology;pNF-κB-Luciferase質粒和pRL-TK 質粒購自Clontech;雙螢光素酶報告基因檢測試劑盒購自Promega;Trizol購自Invitrogen;Power SYBR? Green PCR Master Mix購自Applied Biosystems;抗小鼠IL-6、TNF-α和IL-1β雙抗體夾心酶聯免疫試劑盒購自BioLegend。
2方法
2.13T3-L1前脂肪細胞的培養及誘導分化 采用本研究所已經建立的方法[8],用含10%新生牛血清、1×105U/L青霉素和0.1 g/L鏈霉素的高糖DMEM 培養液,在 37 ℃、5%CO2條件下培養。待細胞生長至80%~90%融合時,加入誘導培養液(含0.5 mmol/L 3-異丁基-1-甲基黃嘌呤、1 μmol/L 地塞米松、1.67 μmol/L胰島素和10%新生牛血清的高糖DMEM培養液)培養48 h。然后更換細胞分化培養液(含1 mg/L胰島素和10%新生牛血清的高糖DMEM 培養液)培養 5~7 d,每2 d更換分化培養液1次。3T3-L1前脂肪細胞誘導分化成熟后90 %呈脂肪細胞表型,可用于后續實驗。
2.2GHR基因沉默 參考文獻報道的方法[9],通過siRNA沉默脂肪細胞GHR的表達。轉染采用siLentFect脂質試劑,以siRNA-duplex作為對照。操作步驟按照試劑說明書進行。細胞經胰酶消化后計數,然后按每孔1×105的密度接種至細胞24孔板中培養。將20 nmol/L siRNA-duplex與siLentFect脂質試劑按體積比1∶1混合后加入細胞培養基中,使siRNA-duplex終濃度為1 nmol/L。24 h后換完全培養基繼續培養。培養48 h后采用Western blot檢測siRNA-GHR對GHR的沉默效果,以GAPDH的表達量作為內參照。
2.3NF-κB雙螢光素酶報告基因活性測定 分別將pNF-κB-Luciferase質粒(50 ng)和內參照pRL-TK 質粒(10 ng)與siRNA-GHR(或siRNA-control)共轉染脂肪細胞,48 h后采用無血清培養液繼續培養2h,將重組人生長激素加入細胞培養液中,并使之達到實驗所需的細胞處理濃度,24 h后收獲細胞,按雙螢光素酶報告基因檢測試劑盒技術手冊操作,記錄螢火蟲螢光素酶和海腎螢光素酶激發值,以兩者的比值評價NF-κB報告基因的激活程度。
2.4Real-time RT-PCR分析炎癥細胞因子的mRNA表達水平 Trizol法提取細胞總 RNA,并使用NanoDrop 2000微量分光光度計進行RNA定量。DNase I 消化 RNA 中可能污染的DNA。逆轉錄反應采用iScriptTMReverse Transcription Supermix,操作按照試劑盒說明書進行。Real-time RT-PCR采用Power SYBR? Green PCR Master Mix,反應在ABI 7500 型實時熒光定量PCR系統中進行。以GAPDH作為內參照,反應結束后通過分析 Ct 值,計算定量結果。所需的引物序列如表1所示。

表1 引物設計
2.5ELISA檢測細胞上清中TNF-α、IL-1β和IL-6的水平 細胞處理完畢后收集細胞培養液,經3 000g離心20 min,棄去沉淀后,取上清備用。采用ELISA法測定細胞培養上清液中 IL-6、TNF-α和IL-1β的水平。檢測步驟按試劑盒說明書進行。
3統計學處理
實驗數據采用SPSS 13.0軟件進行分析。計量資料用均數±標準差(mean±SD)表示,多組間數據比較采用單因素方差分析,兩組間數據比較采用t檢驗,以P<0.05表示差異有統計學意義。
結 果
1分析siRNA-GHR對3T3-L1脂肪細胞GHR的沉默效率
為確定siRNA-GHR對3T3-L1脂肪細胞GHR的沉默效率,將siRNA-GHR或siRNA-control轉染3T3-L1脂肪細胞24 h后,換完全培養基繼續培養48 h,采用Western blot檢測GHR的表達水平,結果顯示,與siRNA-control組比較,siRNA-GHR組GHR的表達水平下降了85.1%(P<0.05),見圖1。
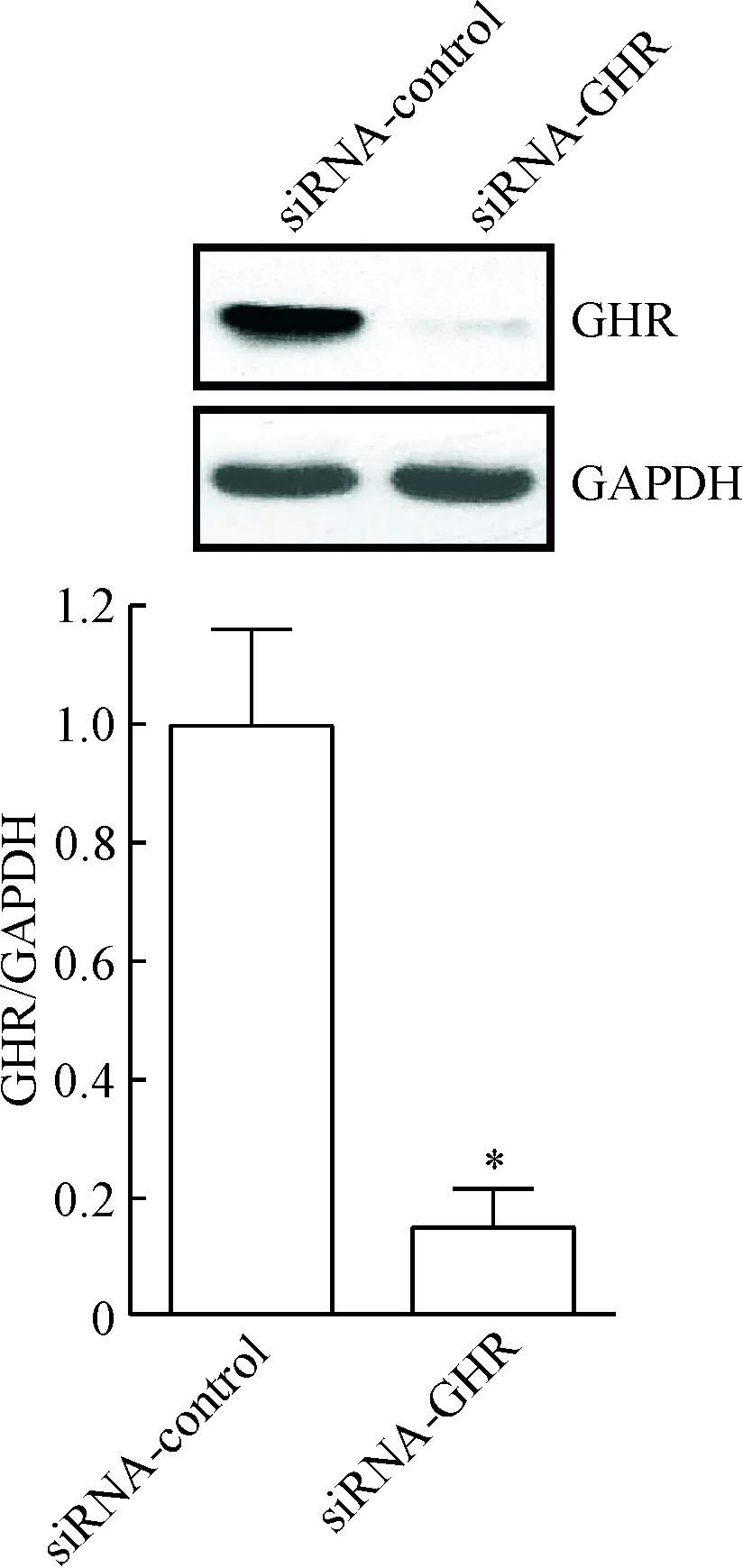
Figure 1. The protein expression of GHR was diminished after transfection with siRNA-GHR. Mean±SD.n=3.*P<0.05vssiRNA-control group.
圖1siRNA-GHR可顯著抑制3T3-L1脂肪細胞GHR的表達
2抑制GHR表達對hGH激活的3T3-L1脂肪細胞NF-κB轉錄活性的影響
為觀察抑制GHR表達對hGH誘導的脂肪細胞NF-κB轉錄活性的影響,將siRNA-GHR或siRNA-control分別與質粒pNF-κB-Luciferase和內參照質粒pRL-TK共轉染3T3-Ll脂肪細胞,并將共轉染siRNA-control、pNF-κB-Luciferase、pRL-TK且未經hGH處理的細胞組螢火蟲螢光素酶激發熒光值與海腎螢光素酶激發熒光值的比值設定為1,其它各組細胞的絕對比值與之相比較, 計算相對比值,結果顯示,隨著hGH處理濃度的增加,細胞NF-κB的轉錄活性逐漸增強(即圖中siRNA-control組);而抑制GHR的表達能夠顯著降低150 μg/L hGH及500 μg/L hGH對細胞NF-κ-B的轉錄激活作用(P<0.05),見圖2。
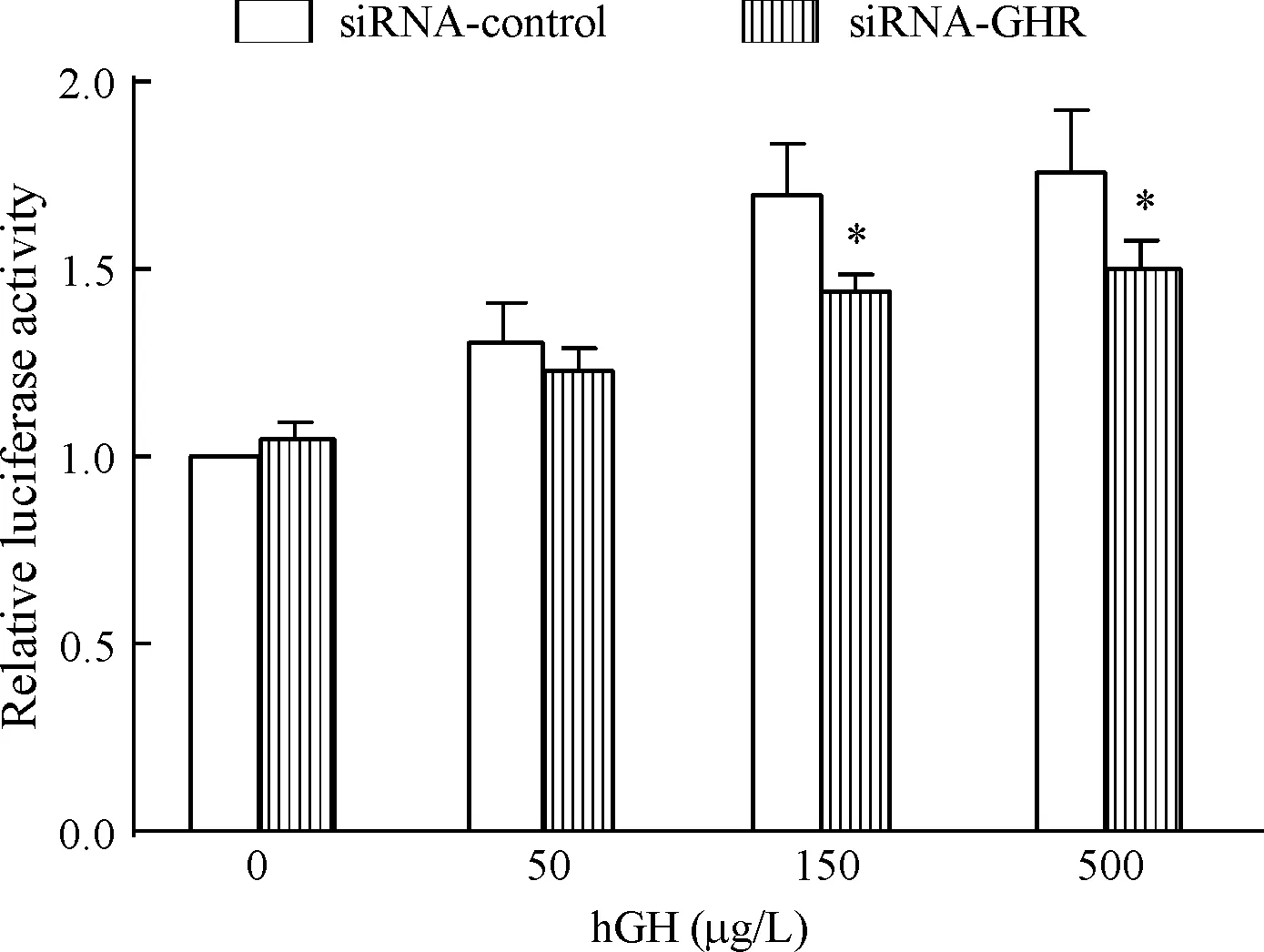
Figure 2. Dual-luciferase reporter system analysis revealed thatGHRknockdown resulted in attenuation of GH-stimulated NF-κB activation in 3T3-L1 adipocytes.Mean±SD.n=3.*P<0.05vssiRNA-control group.
圖2抑制3T3-L1脂肪細胞GHR表達可降低hGH對NF-κB的轉錄激活作用
3抑制GHR表達對hGH誘導的3T3-L1脂肪細胞炎癥因子mRNA表達的影響
將siRNA-GHR或siRNA-control轉染3T3-L1脂肪細胞24 h后,換完全培養基繼續培養48 h,接著用150 μg/L hGH處理細胞24 h后用real-time RT-PCR技術檢測細胞TNF-α、IL-1β、IL-6、MCP-1和MIP-1α等炎癥細胞因子mRNA表達的變化,結果顯示,經150 μg/L hGH處理24 h后,TNF-α、IL-1β、IL-6、MCP-1和MIP-1α mRNA的表達水平均較對照組顯著升高(P<0.05);而抑制脂肪細胞GHR的表達后,再用hGH誘導的細胞TNF-α、IL-1β、IL-6、MCP-1和MIP-1α mRNA表達水平均較siRNA-control+GH組顯著降低(P<0.05),見圖3。
4抑制GHR表達對hGH誘導的3T3-L1脂肪細胞炎癥因子分泌的影響
我們進一步用ELISA檢測了抑制GHR表達后hGH誘導的脂肪細胞TNF-α、IL-1β和IL-6 等炎癥細胞因子分泌的情況,結果顯示,細胞經150 μg/L hGH處理24 h后,上清液中TNF-α、IL-1β和IL-6的水平較對照組分別上升了50.1%(P<0.05)、87.6%(P<0.05)和167.2%(P<0.05);而抑制脂肪細胞GHR的表達后,再用hGH誘導的細胞上清液中TNF-α、IL-1β和IL-6的水平較si-control+GH組分別下降了21.3%(P<0.05)、36.2%(P<0.05)和43.6%(P<0.05),見圖4。

Figure 3. Knockdown ofGHRexpression attenuated mRNA expression of inflammatory cytokines induced by GH in 3T3-L1 adipocytes. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vssiRNA-control+GH group.
圖3抑制3T3-L1脂肪細胞的GHR表達可降低hGH誘導的炎癥細胞因子mRNA的表達

Figure 4. Knockdown ofGHRexpression attenuated the secretion of inflammatory cytokines induced by GH in 3T3-L1 adipocytes. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vssiRNA-control+GH group.
圖4抑制3T3-L1脂肪細胞GHR表達可降低hGH誘導的炎癥細胞因子的分泌
討 論
慢性低度炎癥與代謝綜合征、肥胖、動脈粥樣硬化和糖尿病等慢性病密切相關,而胰島素抵抗又是這些慢性疾病共同的病理生理基礎。胰島素抵抗與慢性輕度炎癥相互聯系、相互促進,加速了疾病的發生和發展。慢性低度炎癥的產生涉及多種組織、器官和系統,發病機制仍未完全闡明。研究發現,脂肪組織不僅是貯存能量的器官,還是人體最大的內分泌器官,具有活躍的內分泌功能。脂肪組織可通過生理性肥大將超出機體代謝所需的能源物質以甘油三酯的形式儲存在細胞內。然而,當多余的能源物質超過脂肪細胞的儲脂能力時,脂肪組織則會發生病理性肥大,表現為組織新生血管不足、供氧減少及內分泌功能異常活化等,導致大量脂肪細胞因子(瘦素、脂聯素、抵抗素和網膜素等)、炎癥細胞因子(TNF-α、IL-1β和IL-6等)的分泌,這些細胞因子反過來又作用于脂肪細胞,進一步加重脂肪組織的功能障礙,形成脂肪組織慢性低度炎癥狀態[10]。也有研究表明脂肪組織既是胰島素作用的重要靶器官,又通過分泌多種脂肪細胞因子和細胞炎癥因子等調節胰島素的敏感性,降低炎癥水平[11],而具體機制尚未明確。但是Kumar等[7]發現,GH可誘導3T3-F442A前脂肪細胞NF-κB的激活,并促進多種細胞炎癥因子的表達。本研究也發現3T3-L1脂肪細胞經150 μg/L hGH處理24 h后,TNF-α、IL-1β、IL-6、MCP-1和MIP-1α mRNA的表達水平均較對照組顯著升高,這與Kumar等報道的實驗結果一致。本研究通過RNA干擾技術,觀察了基因沉默GHR后,GH誘導的脂肪細胞炎癥因子分泌的變化。結果發現,抑制GHR表達能夠顯著降低hGH誘導的3T3-L1脂肪細胞炎癥因子表達和分泌。這說明GH促脂肪細胞炎癥反應是通過與細胞膜上的GHR結合,進而激活胞內NF-κB信號通路而實現的。
GH是體內促進生長發育和代謝的重要激素。生長激素通過與細胞膜上的GHR結合,激活胞質內的JAK2。JAK2使GHR發生磷酸化,并在JAK2和GHR共同作用下,活化STAT5。隨后STAT5發生細胞核移位,并與靶基因啟動子的特殊序列結合,激活基因的轉錄,進而對細胞的增殖、分化、凋亡及免疫等多種生理功能發揮調節作用[1]。Bartke等[12]的系列研究發現,GHR敲除小鼠的壽命顯著延長,并具有抗氧化應激能力強、循環血炎癥細胞因子水平低、脂肪酸β-氧化活性增強和胰島素敏感性高等特點。然而,導致GHR敲除小鼠循環血炎癥因子水平顯著降低的發生機制仍不十分清楚。本研究的實驗結果發現,在3T3-L1脂肪細胞中抑制GHR表達能夠抑制GH誘導的NF-κB的激活,并減輕炎癥細胞因子的表達和分泌。這在一定程度上解釋了GHR敲除小鼠盡管其體脂率(體內脂肪重量在總體重中所占的比例)較GHR雜合子小鼠顯著增加,但空腹血糖水平和胰島素敏感性等糖代謝功能仍顯著優于GHR雜合子小鼠的原因。然而,在胰島素抵抗形成的緩慢進程中,引起脂肪組織慢性低度炎癥狀態的誘因還有許多,如TNF-α和游離脂肪酸水平升高等,沉默細胞GHR基因表達是否仍具有抑制脂肪細胞炎癥反應的作用還有待進一步研究。
[1] Carter-Su C, Schwartz J, Argetsinger LS.Growth hormone signaling pathways[J]. Growth Horm IGF Res, 2016, 28(4):11-15.
[2] Pollak M. The insulin and insulin-like growth factor receptor family in neoplasia: an update[J]. Nat Rev Cancer, 2012, 12(3):159-169.
[3] Shikata K, Ninomiya T, Kiyohara Y. Diabetes mellitus and cancer risk: review of the epidemiological evidence[J]. Cancer Sci, 2013, 104(1):9-14.
[4] Brooks AJ, Waters MJ. The growth hormone receptor: mechanism of activation and clinical implications[J]. Nat Rev Endocrinol, 2010, 6(9):515-525.
[5] American Diabetes Association. Diagnosis and classification of diabetes mellitus[J]. Diabetes Care, 2014, 37 (Suppl 1):S64-S71.
[6] Morigny P, Houssier M, Mouisel E, et al. Adipocyte lipolysis and insulin resistance[J]. Biochimie, 2016, 125(6):259-266.
[7] Kumar PA, Chitra PS, Lu C, et al. Growth hormone (GH) differentially regulates NF-κB activity in preadipocytes and macrophages: implications for GH’s role in adipose tissue homeostasis in obesity[J]. J Physiol Biochem, 2014, 70(2):433-440.
[8] She M, Hou H, Wang Z, et al. Melatonin rescues 3T3-L1 adipocytes from FFA-induced insulin resistance by inhibiting phosphorylation of IRS-1 on Ser307[J]. Biochimie, 2014, 103(8):126-130.
[9] Basu R, Wu S, Kopchick JJ. Targeting growth hormone receptor in human melanoma cells attenuates tumor progression and epithelial mesenchymal transition via suppression of multiple oncogenic pathways[J]. Oncotarget, 2017, 8(13):21579-21598.
[10] Dalmas E, Toubal A, Alzaid F, et al. Irf5 deficiency in macrophages promotes beneficial adipose tissue expansion and insulin sensitivity during obesity[J]. Nat Med, 2015, 21(6):610-618.
[11] 李 新, 姜 黎, 楊 杪, 等.CTRP3下調炎癥因子表達改善胰島素抵抗的3T3-L1脂肪細胞胰島素敏感性[J]. 中國病理生理雜志, 2014, 30(10):1833-1838.
[12] Bartke A, Sun LY, Longo V. Somatotropic signaling: trade-offs between growth, reproductive development, and longevity[J]. Physiol Rev, 2013, 93(2):571-598.
(責任編輯: 林白霜, 羅 森)
Knockdown of growth hormone receptor prevents growth hormone induced inflammatory cytokine production in 3T3-L1 adipocytes
QIAN Hui-lin, HUANG Liang, CHAO Ru, ZHOU Fan, QU Shun-lin, ZHANG Chi
(InstituteofCardiovascularDisease,KeyLaboratoryforArteriosclerologyofHunanProvince,UniversityofSouthChina,Hengyang421001,China.E-mail:zhangchi9966@163.com)
AIM: To investigate the effect of growth hormone receptor (GHR) knockdown on nuclear factor-κB (NF-κB) activity and inflammatory cytokine production stimulated by growth hormone (GH) in 3T3-L1 adipocytes.METHODSThe specific siRNA forGHRwas transfected into 3T3-L1 adipocytes to silenceGHRexpressions. The effects of GH on NF-κB activation and inflammatory cytokine production in 3T3-L1 adipocytes transfected with siRNA-GHR or siRNA-control were measured by dual-luciferase system analysis, real-time RT-PCR and ELISA.RESULTSThe protein expression of GHR was diminished after transfection withGHRspecific siRNA. Dual-luciferase reporter system analysis revealed thatGHRknockdown resulted in attenuation of GH-stimulated NF-κB activation in the 3T3-L1 adipocytes.GHRknockdown ameliorated the GH-induced production of inflammatory cytokines TNF-α, IL-1β, IL-6, MCP-1 and MIP-1α in the 3T3-L1 adipocytes.CONCLUSIONKnockdown ofGHRmight be efficacious to prevent GH-induced inflammatory responses in the 3T3-L1 adipocytes.
Chronic low-grade inflammation; Adipocytes; Growth hormone; Growth hormone receptor; Inflammatory cytokines
1000- 4718(2017)11- 2090- 05
2017- 05- 04
2017- 07- 13
國家自然科學基金資助項目(No. 81100106; No. 81670424); 湖南省教育廳重點項目(No. 15A166)
△通訊作者 Tel: 0734-8281586; E-mail: zhangchi9966@163.com
R363.21; R541
A
10.3969/j.issn.1000- 4718.2017.11.027

