動態對比增強MRI衍生的藥代動力學參數鑒別診斷原發性中樞神經系統淋巴瘤與膠質母細胞瘤
張 禹,張 茜,駱祥偉,鄧雪飛,朱友志*
(1.中國人民解放軍第105醫院醫學影像科,安徽 合肥 230031;2.安徽醫科大學解剖教研室,安徽 合肥 230032)

動態對比增強MRI衍生的藥代動力學參數鑒別診斷原發性中樞神經系統淋巴瘤與膠質母細胞瘤
張 禹1,張 茜1,駱祥偉1,鄧雪飛2,朱友志1*
(1.中國人民解放軍第105醫院醫學影像科,安徽 合肥 230031;2.安徽醫科大學解剖教研室,安徽 合肥 230032)
目的探討原發性中樞神經系統淋巴瘤(PCNSL)與膠質母細胞瘤(GBM)動態對比增強MRI衍生的藥代動力學參數差異。方法收集17例PCNSL與21例GBM,均接受常規及動態對比增強MR檢查,測量雙室Tofts模型下藥代動力學參數容量轉移常數(Ktrans)、回流速率常數(Kep)、血管外細胞外間隙容積分數(Ve),及初始(60 s)對比劑濃度-時間曲線下面積(iAUC)。采用單因素方差分析比較PCNSL與GBM各自的強化瘤灶(ET)、瘤旁腦組織(PT)、正常側腦組織(NP)間各參數差異;采用獨立樣本t檢驗比較二者間ET、PT、NP各參數的差異。結果PCNSL與GBM間ET的Ktrans、Kep差異均有統計學意義(P均<0.05),PT的Kep差異有統計學意義(P<0.05)。PCNSL、GBM的ET與PT間Ktrans、Kep、Ve、iAUC差異均有統計學意義(P均<0.05);PCNSL的PT與NP間Ktrans差異有統計學意義(P<0.05);GBM的PT與NP間Ktrans及Kep差異均有統計學意義(P均<0.05)。結論動態對比增強MRI基于Tofts雙室模型的藥代動力學分析對PCNSL與GBM具有鑒別診斷價值。
中樞神經系統;淋巴瘤;膠質母細胞瘤;磁共振成像;藥代動力學
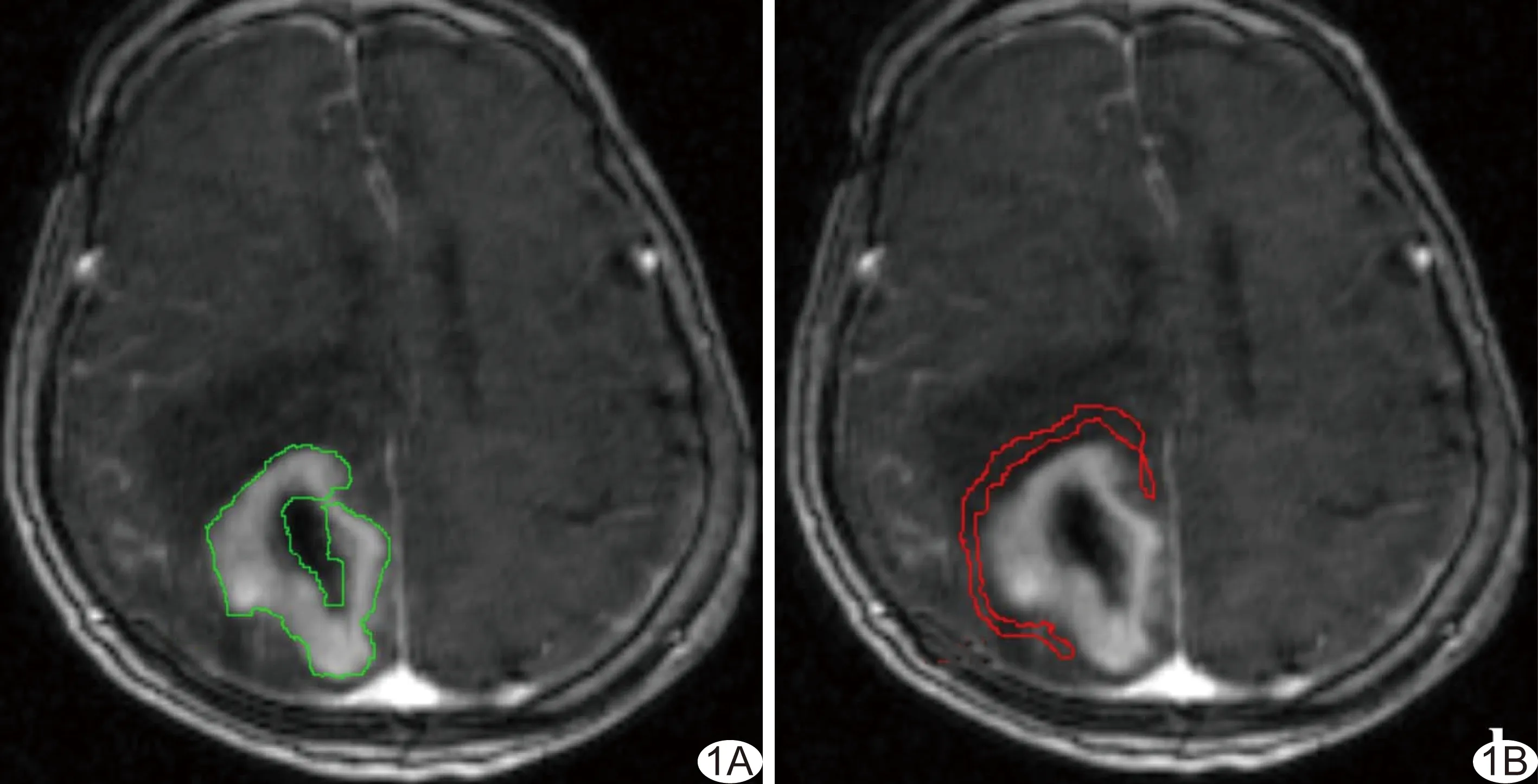
圖1 在腫瘤主體層面勾畫整個ET(A)及距離強化灶邊緣10 mm范圍內環繞勾畫PT(B),盡量避開明顯的囊變、壞死、大血管及顱骨
常規MRI鑒別診斷原發性中樞神經系統淋巴瘤(primary central nervous system lymphoma, PCNSL)與膠質母細胞瘤(glioblastoma, GBM)較困難。由于二者臨床處理路徑和預后不同,故準確診斷具有重要意義[1-2]。近年研究[3-4]表明,功能MRI,如DWI、DTI、PWI及MRS等,可為PCNSL與GBM鑒別診斷提供豐富信息,但某些方面仍存在局限性,如腫瘤出血影響參數值穩定性、b值選擇不統一、PWI及MRS仍為半定量分析等。基于動態增強(dynamic contrast enhanced, DCE)T1加權MRI藥代動力學參數可定量分析微血管功能,且重復性和穩定性較好、序列參數較易調整[5-7]。本研究回顧性分析PCNSL與GBM藥代動力學參數變化,旨在探討其在二者鑒別診斷中的價值。
1 資料與方法
1.1 一般資料 回顧性分析2010年1月—2014年12月在我院就診的17例PCNSL患者及21例GBM患者的資料。PCNSL患者年齡34~69歲,平均(52.9±11.5)歲;GBM患者28~83歲,平均(56.9±18.7)歲。所有患者均于術前或定向穿刺活檢前接受MR檢查。
1.2 儀器與方法 采用Siemens Verio 3T MR儀,8通道頭顱正交線圈。平掃序列及參數:SE-T1WI,TR 220 ms,TE 3.15 ms;TSE-T2WI,TR 4 200 ms,TE 108 ms;層厚5 mm,層間距15%,FOVread300 mm,FOVphase100%,激勵次數1~2,矩陣256×256。平掃后以高壓注射器經肘前靜脈團注Gd-DTPA注射液,采用隨機軌跡時間分辨率成像序列行DCE掃描,參數:A區15%,B區30%,TR 3.31 ms,TE 1.15 ms,FOVread300 mm,FOVphase100%,FA 25°,矩陣256×230,激勵次數1,并行加速因子2,首個時相9.6 s,其余每個時相3.8 s,層厚5 mm,層間距15%,掃描100個時相,共時間為6 min 32 s,首個時相后立即注射對比劑,劑量0.1mmol/kg體質量,流速4 ml/s,而后以同樣速率注入生理鹽水20 ml,DCE掃描后再行常規增強掃描。所有序列以前后聯合連線為基線,掃描范圍從枕骨大孔至顱頂。
1.3 圖像處理及數據分析 將DCE圖像傳至Siemens VB17獨立工作站TISSUE-4D軟件平臺。由2名具有5年以上MRI診斷經驗的醫師共同完成所有數據分析,意見不一致時請第3名醫師參與討論。選定右側大腦中動脈水平段,生成動脈輸入函數(arterial input function, AIF)曲線,在DCE后期選取腫瘤主體層面手動勾畫ROI,瘤灶ROI包含整個強化灶,瘤旁腦組織(peri-tumoral parenchymas, PT)的ROI在距離強化灶邊緣10 mm內環繞勾畫,正常側腦組織(contralateral normal parenchyma, NP)的ROI勾畫包含整個對側半卵圓中心主體層面,所有ROI盡量避開囊變/壞死區、大血管、顱骨(圖1)。選擇Tofts雙室模型,由軟件自動獲得容量轉移常數(Ktrans)、回流速率常數(Kep)、血管外細胞外間隙容積分數(Ve)和初始(60 s)對比劑濃度-時間曲線下面積(initial area under the Gd concentration-time curve, iAUC)值及偽彩圖。分別記錄GBM和PCNSL的強化瘤灶(enhancement tumors, ET)、PT、NP各參數值,偽彩圖色階由藍至紅代表參數值由低到高。
1.4 統計學分析 采用SPSS 21.0統計分析軟件。定量資料經正態性檢驗,符合正態分布,以±s表示。采用方差分析比較PCNSL、GBM的ET、PT、NP間Ktrans、Kep、Ve、iAUC值差異,兩兩比較采用SNK法;采用獨立樣本t檢驗比較PCNSL與GBM間ET、PT、NP的Ktrans、Kep、Ve、iAUC值差異。P<0.05為差異有統計學意義。
2 結果
2.1 PCNSL與GBM常規MRI表現 17例PCNSL均為彌漫大B細胞淋巴瘤,MR平掃瘤實質T1WI呈稍低信號(圖2A),T2WI呈稍高信號(圖2B);增強掃描12例呈較均勻明顯強化,5例呈環形強化(圖2C~2G),瘤周均見輕-中度水腫。21例GBM的MR平掃瘤實質T1WI呈不均勻稍低信號(圖3A),T2WI呈不均勻稍高信號(圖3B);增強掃描14例呈環形強化,7例呈不均勻強化(圖3C~3G),瘤周均見中度至明顯水腫。
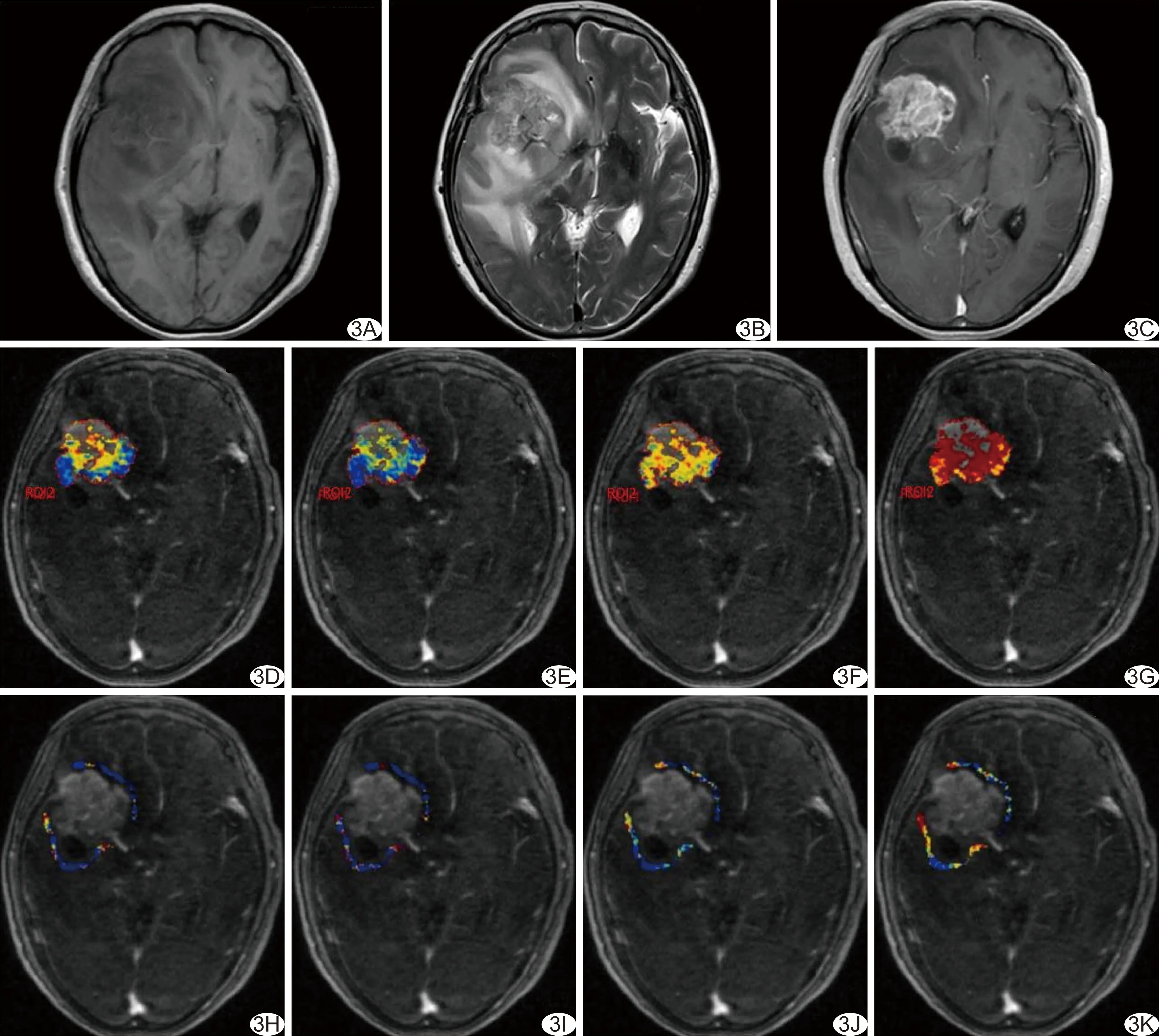
圖3 患者女,70歲右側額葉GBM A.T1WI呈不均勻稍低信號; B.T2WI呈不均勻稍高信號; C.增強掃描呈不均勻明顯強化; D~G.ET參數偽彩圖示Ktrans圖以藍黃色為主夾雜散在紅色, Ktrans值0.299 min-1(D),Kep圖以藍黃色為主,Kep值0.608 min-1(E),Ve圖以黃色為主,Ve值0.515(F),iAUC圖以紅色為主夾雜黃色,iAUC值41.385(G);H~K.PT參數為彩圖示Ktrans圖以藍色為主夾雜散在黃色,Ktrans值0.141 min-1(H),Kep圖以藍色為主夾雜紅黃色,Kep值0.295 min-1(I),Ve圖以藍色為主夾雜散在黃色,Ve值0.071(J),iAUC圖呈藍黃紅色混雜,iAUC值8.555(K)
2.2 各參數的比較 PCNSL患者中,ET的Ktrans大于PT(P=0.014),PT大于NP(P=0.001);ET的Kep、Ve和iAUC均大于PT(P=0.001、<0.001、<0.001)和NP(P均<0.001),PT與NP的Kep、Ve、iAUC差異均無統計學意義(P=0.504、0.598、0.482)。見圖2H~2K。
GBM患者中,ET的Ktrans、Kep、Ve、和iAUC均大于PT(P<0.001、0.030、<0.001、<0.001)和NP(P=0.010、<0.001、<0.001、0.044);PT的Ktrans、Kep和iAUC大于NP(P=0.01、0.006、0.044),PT與NP的Ve差異無統計學意義(P=0.304)。見表1、圖3H~3K。
PCNSL與GBM的NP間Ktrans、Kep、Ve及iAUC差異均無統計學意義,見表1。PCNSL與GBM的ET間Ktrans和Kep差異均有統計學意義(t=-2.110,P=0.042;t=-2.955,P=0.007),Ve和iAUC差異無統計學意義(t=0.957,P=0.348;t=0.320,P=0.751);PCNSL與GBM間PT的Kep差異有統計學意義(t=-5.218,P<0.001),Ktrans、Ve和iAUC差異無統計學意義(t=0.610,P=0.545;t=-0.641,P=0.526;t=-1.887,P=0.069)。
表1 PCNSL和GBM藥代動力學參數比較(±s)
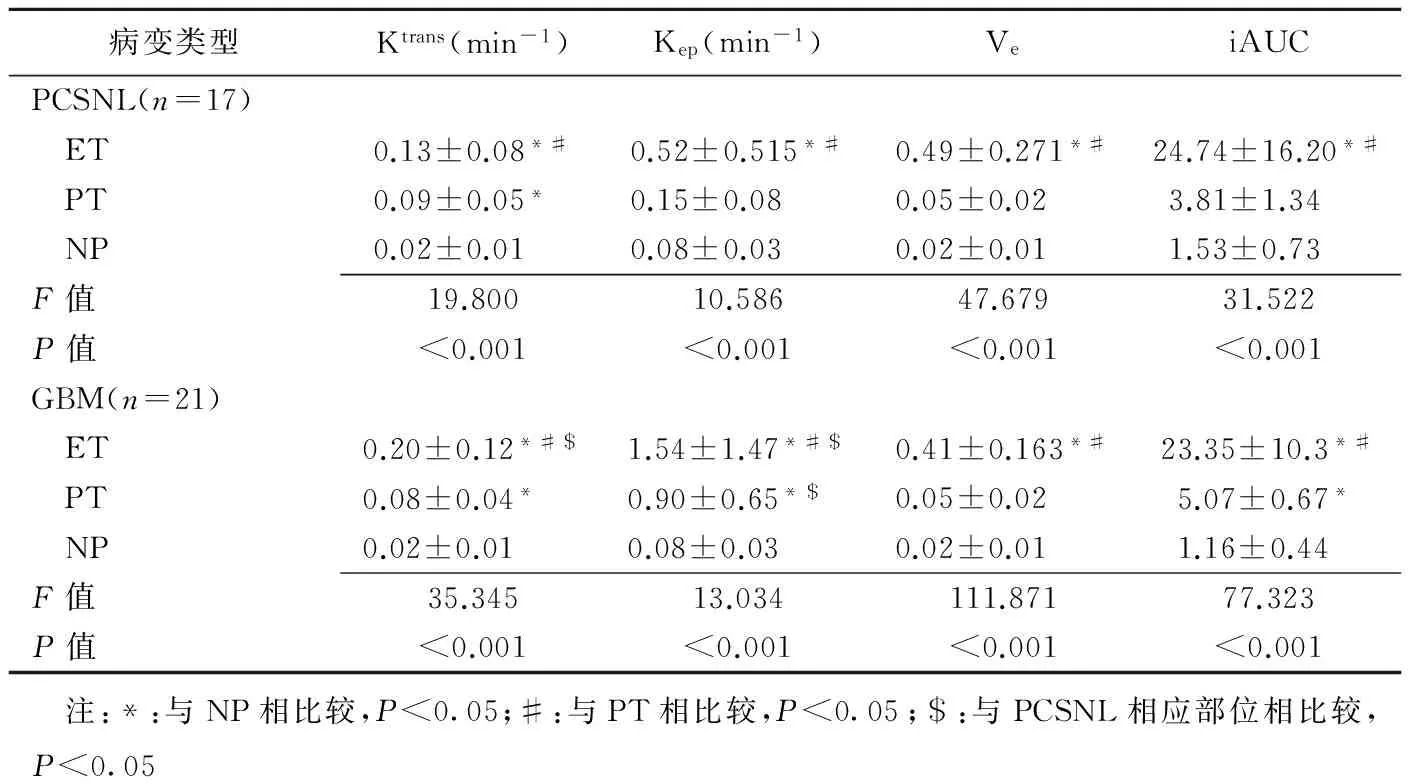
表1 PCNSL和GBM藥代動力學參數比較(±s)
病變類型Ktrans(min-1)Kep(min-1)VeiAUCPCSNL(n=17) ET0.13±0.08*#0.52±0.515*#0.49±0.271*#24.74±16.20*# PT0.09±0.05*0.15±0.080.05±0.023.81±1.34 NP0.02±0.010.08±0.030.02±0.011.53±0.73F值19.80010.58647.67931.522P值<0.001<0.001<0.001<0.001GBM(n=21) ET0.20±0.12*#$1.54±1.47*#$0.41±0.163*#23.35±10.3*# PT0.08±0.04*0.90±0.65*$0.05±0.025.07±0.67* NP0.02±0.010.08±0.030.02±0.011.16±0.44F值35.34513.034111.87177.323P值<0.001<0.001<0.001<0.001 注:*:與NP相比較,P<0.05;#:與PT相比較,P<0.05;$:與PCSNL相應部位相比較,P<0.05
3 討論
Tofts雙室模型將血漿視為中央室,而血管外細胞外間隙(extra-vascular extra-celluar space, EES)為周邊室[8],組織內對比劑濃度在兩室間的變化可用公式dCt/dt=KtransCp-KepCt來表示,Cp和Ct分別代表血漿和組織中對比劑濃度,其通過獲取AIF得到,計算得出各藥代動力學參數,如Ktrans、Kep、Ve等,這些參數均可反映血管通透性,但也受到多種血管生理因素的影響。Ktrans代表對比劑從血管進入組織間隙的速度,單位min-1,由血流速度、血管通透性、血管床面積等因素決定;Kep是組織中對比劑在微血管中每分鐘從EES回到血漿的速率,單位min-1,與血管通透性、腫瘤血管密度、血管內外交換速率有關;Ve代表ESS容積分數,反映對比劑在ESS空間容量,與細胞外基質性狀、ESS容積及其內對比劑被血管收集并流出的速度相關[6,9-10]。有關學者[11]嘗試多室模型藥代動力學DCE-MRI定量分析,但運算復雜,參數穩定性有待商榷,目前雙室模型臨床應用最廣泛。
研究[1-2]顯示,PCNSL新生血管少,微循環灌注低,其強化依賴于腫瘤對血腦屏障的破壞,而GBM是高度血管化的惡性腫瘤,其強化由新生血管增生及血腦屏障破壞共同決定[12]。由此推測除血腦屏障破壞外,GBM豐富且不成熟血管引起的高血管密度和血流速度、較大血管床面積及增加的通透性,均會導致對比劑分子更易“外漏”。GBM血腦屏障破壞及新生血管壁缺陷引起的通透性“雙重”增加,可能導致對比劑分子滲漏的速率、數量及從ESS回到血管內的交換速率均高于PCNSL,且PCNSL豐富的網狀纖維也使對比劑的滲透及回流受到束縛而緩慢[3-4]。這些因素可能是最終導致PCNSL與GBM的Ktrans、Kep存在差異的原因。
研究[1,13-15]認為PCNSL與GBM均可浸潤PT,且GBM的PT內有新生血管發生[14,16],PCNSL對PT的浸潤主要是破壞血腦屏障的完整性[15,17]。本研究發現PCNSL、GBM的PT與NP間Ktrans值均有統計學差異(P均<0.05),表明PT的微血管特性發生變化。但本研究中,PCNSL與GBM間PT的Ktrans差異無統計學意義(P>0.05)而Kep差異有統計學意義(P<0.05),提示二者PT受侵狀態不同。PCNSL和GBM對血腦屏障的破壞及GBM的新生血管通透性變化為不均質性[3-4,18],且二者浸潤PT引起的微血管性狀變化均較輕微[16-18]。PCNSL與GBM間PT的Ktrans,即反映對比劑分子滲漏速度的值,在不均勻、低強度的微血管功能變化基礎上保持相似性,但GBM對PT浸潤引起的微血管生成,可致Gd-DTPA接觸血管面積增大、局部血流加快,最終或許促進Gd-DTPA分子的回流,成為GBM瘤旁Kep值大于PCNSL的原因。張曉琦等[19]研究GBM與轉移瘤時有類似發現,即GBM瘤周Kep值高于轉移瘤周而接近瘤灶。
本研究顯示PCNSL與GBM的ET間Ve值差異無統計學意義(P>0.05),原因可能是二者均為高度惡性腫瘤,細胞密度高,ESS容量相似。但有研究[20]認為Ve穩定性較差,有時與Ktrans、Kep抵觸,這與血管內外水分子交換、體素內對比劑擴散運動、血管內外對比劑分布穩態等有關,可能無法單獨評價微血管功能。
iAUC與瘤內各種影響灌注和強化的生理因素有關,如血流量、組織間隙大小、間質壓力等,理論上可綜合反映Ktrans、Kep、Ve的變化,但其受多因素影響,重復性差,嚴格意義上其主要反映的是特定周期內組織的血容量情況[21]。本研究中,PCNSL與GBM間ET的iAUC差異無統計學意義(P>0.05),表明盡管二者組織中血管內外交換狀態及微循環灌注不同,但特定時間內通過及滯留于瘤內的Gd-DTPA總容量相似,這與二者均明顯強化的特點一致。此外,GBM的PT與NP間iAUC差異有統計學意義(P<0.05),而GBM與PCNSL間PT的iAUC差異無統計學意義(P>0.05),表明GBM的PT血容量可能升高,間接證實GBM瘤旁新生血管較豐富。
總之,PCNSL與GBM間基于Tofts雙室模型DCE-MRI藥代動力學參數存在差異。與正常腦組織相比,PCNSL與GBM瘤旁參數也有變化,意味著瘤周微血管特性已發生改變,且GBM較明顯。
[1] Wang S, Kim S, Chawla S, et al. Differentiation between glioblastomas, solitary brain metastases, and primary cerebral lymphomas using diffusion tensor and dynamic susceptibility contrast-enhanced MR imaging. Am J Neuroradiol, 2011,32(3):507-514.
[2] 張禹,張茜,朱友志,等.原發性中樞神經系統淋巴瘤ADC值與預后的相關性.中國醫學影像技術,2015,31(5):711-715.
[3] 張禹,張龍江,葛銳,等.原發性腦淋巴瘤的MRI功能成像和延遲強化特點.中國醫學計算機成像雜志,2011,17(2):97-103.
[4] 方向,黃周,孟倩,等.原發性中樞神經系統淋巴瘤MRI表現.中國介入影像與治療學,2016,13(1):37-41.
[5] 賈龍威,牛蕾,馬文帥,等.血流動力學雙室模型Extended Tofts Linear在腦膠質瘤DCE-MRI滲透性定量分析的復測性及有效性研究.磁共振成像,2015,6(8):571-574.
[6] Steingoetter A, Menne D, Braren RF. Assessing antiangiogenic therapy response by DCE-MRI: Development of a physiology driven Multi-Compartment model using population pharmacometrics. PLoS One, 2011,6(10):e26366.
[7] 張禹,鄧雪飛,張峰.軟骨定量MRI新技術的研究進展.中華解剖與臨床雜志,2015,20(4):361-364.
[8] Tofts PS, Brix G, Buckley DL, et al. Estimating kinetic parameters from dynamic contrast-enhanced T(1)-weighted MRI of a diffusable tracer: Standardized quantities and symbols. J Magn Reson Imaging, 1999,10(3):223-232.
[9] Kalpathy-Cramer J, Gerstner E, Emblem KE, et al. Advanced magnetic resonance imaging of the physical processes in human glioblastoma. Cancer Res, 2014,74(17):4622-4637.
[10] Eliat PA, Olivié D, Sa?kali S, et al.Can dynamic contrast-enhanced magnetic resonance imaging combined with texture analysis differentiate malignant glioneuronal tumors from other glioblastoma? Neurol Res Int, 2012,2012(5):195176.
[11] Steingoetter A, Menne D, Braren RF. Assessing antiangiogenic therapy response by DCE-MRI: Development of a physiology driven multi-compartment model using population pharmacometrics. PLoS One, 2011,6(10):e26366.
[12] Yamashita K, Yoshiura T, Hiwatashi A, et al.Differentiating primary CNS lymphoma from glioblastoma multiforme: Assessment using arterial spin labeling, diffusion-weighted imaging, and18F-fluorodeoxyglucose positron emission tomography. Neuroradiology, 2013,55(2):135-143.
[13] Blasel S, Jurcoane A, Baehr O, et al. MR perfusion in and around the contrast-enhancement of primary CNS lymphomas.J Neurooncol, 2013,114(1):127-134.
[14] Xing Z, You RX, Li J, et al.Differentiation of primary central nervous system lymphomas from High-Grade gliomas by rCBV and percentage of signal intensity recovery derived from dynamic susceptibility-weighted contrast-enhanced perfusion MR imaging. Clin Neuroradiol, 2014,24(4):329-336.
[15] Da Rocha AJ, Sobreira GB, Da Silveira DT, et al. Modern techniques of magnetic resonance in the evaluation of primary central nervous system lymphoma: Contributions to the diagnosis anddifferential diagnosis. Rev Bras Hematol Hemoter, 2016,38(1):44-54.
[16] Mangla R, Kolar B, Zhu T, et al. Percentage signal recovery derived from Mr dynamic susceptibility contrast imaging is useful to differentiate common enhancing malignant lesions of the brain. Am J Neuroradiol, 2011,32(6):1004-1010.
[17] Takeuchi H, Matsuda K, Kitai R, et al. Angiogenesis in primary central nervous system lymphoma (PCNSL). J Neurooncol, 2007,84(2):141-145.
[18] Chakravorty A, Steel T, Chaganti J. Accuracy of percentage of signal intensity recovery and relative cerebral blood volume derived from dynamic susceptibility-weighted,contrast-enhanced MRI in the preoperative diagnosis of cerebral tumours. Neuroradiol J, 2015,28(6):574-583.
[19] 張曉琦,李永麗,竇社偉,等.動態對比增強MRI在膠質母細胞瘤與腦轉移瘤鑒別診斷中的應用.中華放射學雜志,2015,49(6):410-413.
[20] Barnes SL, Quarles CC, Yankeelov TE.Modeling the effect of Intra-Voxel diffusion of contrast agent on the quantitative analysis of dynamic contrast enhanced magnetic resonance imaging. PLoS One, 2014,9(10):e108726.
[21] Mills SJ, Soh C, O'connor JP, et al. Enhancing fraction in glioma and its relationship to the tumoral vascular microenvironment: A dynamic contrast-enhanced MR imaging study. Am J Neuroradiol, 2010,31(4):726-731.
PharmacokineticparametersofdynamiccontrastenhancedMRIindifferentialdiagnosisofprimarycentralnervoussystemlymphomaandglioblastoma
ZHANGYu1,ZHANGQian1,LUOXiangwei1,DENGXuefei2,ZHUYouzhi1*
(1.DepartmentofMedicalImaging,the105thHospitalofPLA,Hefei230031,China; 2.TeachingandResearchSectionofHumanAnatomy,AnhuiMedicalUniversity,Hefei230032,China)
ObjectiveTo explore the difference of pharmacokinetic parameters derived from dynamic contrast enhanced (DCE) MRI between primary central nervous system lymphoma (PCNSL) and glioblastoma (GBM).MethodsData of 17 patients with PCNSL and 21 patients with GBM were retrospectively analyzed. All patients underwent DCE MRI. The pharmacokinetic parameters (Ktrans, Kep, Ve) and the initial (60 s) area under the Gd concentration-time curve (iAUC) of peri-tumoral parenchymas (PT), enhancement tumors (ET) and contralateral normal parenchyma (NP) were obtained. The differences of various parameters were compared among different regions of PCNSL and GBM using one-way ANOVA. The differences of various parameters of PT, ET and NP were compared using independent samplest-test.ResultsThere were statistical differences of Ktrans, Kepin ET, Kepin PT between PCNSL and GBM patients (allP<0.05), as well as of Ktrans, Kep, Ve, iAUC in PCNSL and GBM patients between ET and PT (allP<0.05). However, Ktransand Kepof PT showed statistical differences compared with those of NP in GBM patients (bothP<0.05), so did Ktransbetween PT and NP in PCSL patients (P<0.05).ConclusionThe pharmacokinetic parameters derived from DCE MRI based on extended Tofts Linear can promote differential diagnosis between PCNSL and GBM.
Central nervous system; Lymphoma; Glioblastoma; Magnetic resonance imaging; Pharmacokinetics
安徽省衛生和計劃生育委員會科研計劃項目(2016QK080)。
張禹(1980—),男,安徽滁州人,本科,主治醫師。研究方向:功能MRI。E-mail: zhangyu105fsk@163.com
朱友志,中國人民解放軍第105醫院醫學影像科,230031。E-mail: zyz105f@163.com
2017-01-19
2017-09-20
R739.41; R445.2
A
1003-3289(2017)11-1630-06
10.13929/j.1003-3289.201701111

