3.0T MRI預測三陰性乳腺癌
江 森,洪又佳,肖 瑩,張 凡,李仰康*
(1.汕頭大學醫(yī)學院附屬腫瘤醫(yī)院放射科,2.超聲科,3.腫瘤研究實驗室,廣東 汕頭 515041)

3.0TMRI預測三陰性乳腺癌
江 森1,洪又佳2,肖 瑩1,張 凡3,李仰康1*
(1.汕頭大學醫(yī)學院附屬腫瘤醫(yī)院放射科,2.超聲科,3.腫瘤研究實驗室,廣東 汕頭 515041)
目的探討3.0T MR影像特征中能夠預測三陰性乳腺癌(TNBC)的危險因素。方法收集接受3.0T MR檢查并經(jīng)病理證實的乳腺癌病例191例,其中三陰型乳腺癌25例(TNBC組),非三陰性乳腺癌166例(非TNBC組),比較2組年齡、病灶形態(tài)、腫塊數(shù)目、大小、形狀、邊緣、強化特征、T2WI信號、時間-信號強度曲線(TIC)、ADC值、瘤周血管的差異,并采用單因素及多因素分析法進行統(tǒng)計學分析。結果與非TNBC組比較,TNBC組病灶多表現(xiàn)為邊緣光滑(P=0.023)、圓形(P=0.001)腫塊,增強掃描多呈環(huán)形強化(P<0.001),病灶T2WI多呈高信號(P=0.003),ADC值相對較高(P=0.022),瘤周血管增多(P=0.046)。其中腫塊強化特征、T2WI信號、ADC值及瘤周血管納入Logistic回歸模型,為預測TNBC的獨立危險因素(P均<0.05),4個因素聯(lián)合預測TNBC的ROC曲線下面積為0.840。結論腫塊環(huán)形強化、T2WI高信號、ADC值相對較高、瘤周血管增多是預測TNBC的獨立危險因素。
乳腺腫瘤;三陰性乳腺癌;磁共振成像
乳腺癌是一類具有高度異質性的腫瘤,不同分子亞型其療效及預后差別很大[1]。目前臨床主要參照St.Gallen共識[2],運用免疫組織化學方法檢測雌激素受體(estrogen receptor, ER)、孕激素受體(progesterone receptor, PR)、人表皮生長因子(human epidermal growth factor 2, HER-2),根據(jù)結果將乳腺癌分為Luminal A型、Luminal B型、HER-2過表達型及三陰性乳腺癌(triple negative breast cancer, TNBC)。TNBC是指ER陰性、PR陰性、HER-2低表達的一類乳腺癌分子亞型。對比其他類型,TNBC侵襲性強,生長速度快,對內分泌治療及靶向治療效果差,易復發(fā)和轉移,預后差。因此,早期辨別TNBC的高危病例,對臨床選擇最佳治療方案有重要意義[3]。MRI作為一種無創(chuàng)影像學檢查方法,不僅已廣泛用于乳腺良惡性疾病的鑒別診斷,而且在乳腺癌術前評估、分型判斷、療效預測等方面的應用也逐漸增多[4]。近年來,應用MRI診斷TNBC的研究越來越多,然而既往研究多數(shù)僅限于形態(tài)學的研究,未完全發(fā)揮MRI的優(yōu)勢[5-6]。3.0T MR不僅可良好顯示乳腺癌的形態(tài),而且可無創(chuàng)評估腫瘤功能及瘤周血管情況,因此在預測TNBC方面具有很大潛力[7]。本研究采用3.0T MR對TNBC形態(tài)、功能及瘤周血管進行觀察,旨在發(fā)現(xiàn)MRI影像征象中能夠預測TNBC的危險因素,為早期發(fā)現(xiàn)TNBC高危患者、制定臨床治療方案提供影像學依據(jù)。
1 資料與方法
1.1 一般資料 收集2015年3月—2016年12月在我院接受MR檢查并確診為乳腺癌的患者191例,均為女性,年齡28~77歲,平均(50.2±10.3)歲。納入標準:①通過手術或穿刺獲得病理學結果;②經(jīng)免疫組化獲得ER、PR、HER-2表達結果,能夠區(qū)分不同的乳腺癌分子亞型;③MR檢查前均未接受化療或內分泌治療。
1.2 儀器與方法 采用GE Discovery MR750 3.0T MR儀,8通道乳腺專用相控陣表面線圈。患者取俯臥位,雙乳自然下垂。掃描范圍為雙側乳腺及腋窩區(qū)。掃描序列:快速自旋回波T1WI軸位、快速自旋回波T2WI脂肪抑制軸位、單次激發(fā)自旋回波 DWI(b=0、1 000 s/mm2)。動態(tài)增強掃描(dynamic contrast enhancement, DCE)采用三維乳腺評估容積成像進行雙乳多期軸位動態(tài)掃描,先掃蒙片,再采集6期圖像,最后行矢狀位掃描。各序列掃描參數(shù)見表1。MR增強掃描對比劑采用釓噴酸葡胺,劑量為0.1 mmol/kg體質量,速率3 ml/s。
1.3 MR圖像分析 采用AW 4.6工作站進行圖像后處理與血管重建。由2名資深影像診斷醫(yī)師在不知病理結果的前提下,根據(jù)乳腺影像報告和數(shù)據(jù)系統(tǒng)對MR圖像進行分析,如2名醫(yī)師意見不一致,則請第3名更高年資醫(yī)師審核確定。首先分析病變形態(tài)為腫塊或非腫塊,若為腫塊,則記錄腫塊數(shù)目、大小、形狀、邊緣、T2WI信號、強化特征等;若為多發(fā)病灶,則選擇最大病灶作為研究對象。在病變早期強化最明顯的時相,觀察病灶的整體形態(tài)及強化特點,根據(jù)分時間-信號強度曲線(time-intensity curve, TIC)分為3個強化類型,即流入型(Ⅰ型)、平臺型(Ⅱ型)、流出型(Ⅲ型)。取b=1 000 s/mm2的DWI圖像,避開壞死、囊變、出血區(qū)及正常腺體組織,選取3個包含4~9像素的ROI,獲得3個ADC值,取最低值。瘤周血管分析:選擇DCE強化最明顯期相減去蒙片,減影后的圖像進行3D MIP重建,通過多方位旋轉圖像觀察瘤周血管;根據(jù)Sardanelli等[8]提出的標準,血管長度≥3 cm且直徑≥2 mm,或長度<3 cm但直徑≥3 mm為有意義的血管,患側乳腺與健側比較血管計數(shù)差值≥2或有2支以上血管進入腫瘤,判斷為瘤周血管增多。
1.4 免疫組化分析 所有病例均經(jīng)手術或穿刺活檢獲得病理結果,并通過免疫組化染色,記錄分子標記物ER、PR、HER-2狀態(tài)。判斷標準如下:ER、PR指標以≥10%腫瘤細胞著色為陽性;反之則為陰性;根據(jù)HER-2檢查臨床實踐指南[9],HER-2染色(-)或(+)為HER-2低表達,(+++)為HER-2過表達,(++)的病例則加做熒光原位雜交進行驗證,結果為陽性則判定為HER-2過表達,結果為陰性則判定為HER-2低表達。ER、PR陰性且HER-2低表達者定義為TNBC,其他則為非TNBC。
1.5 統(tǒng)計學分析 采用SPSS 22.0統(tǒng)計分析軟件。對計量資料(年齡、病灶大小、ADC值)首先檢驗樣本的正態(tài)性及方差齊性,若符合正態(tài)分布時,以±s表示,差異的比較采用兩獨立樣本t檢驗;不符合正態(tài)分布時,采用中位數(shù)(上下四分位數(shù))表示,差異的比較采用非參數(shù)Mann-WhitneyU檢驗;對分類變量采用χ2檢驗或Fisher確切概率法。對差異有統(tǒng)計學意義的參數(shù)進行Logistic回歸分析,獲得獨立影響因素;繪制ROC曲線,并計算曲線下面積(area under curve, AUC),評價各指標的預測效能。P<0.05為差異有統(tǒng)計學意義。
2 結果
2.1 MRI特征及單因素分析結果 191例乳腺癌患者中,TNBC患者25例(TNBC組)、非TNBC患者166例(非TNBC組)。2組MR特征見表2。
2組間腫塊形狀、腫塊邊緣、腫塊強化特點、T2WI信號、ADC值、瘤周血管的差異有統(tǒng)計學意義(P均<0.05)。TNBC為腫塊時,多表現(xiàn)為圓形、邊緣光滑及環(huán)形強化;TNBC在T2WI上較非TNBC更傾向于表現(xiàn)為高信號;TNBC的ADC值高于非TNBC(圖1);TNBC瘤周血供更豐富(圖2)。而在年齡、病灶形態(tài)、腫塊數(shù)目、腫塊大小、TIC類型方面,2組差異均無統(tǒng)計學意義(P均>0.05)。
2.2 多因素分析 對單因素分析有統(tǒng)計學差異的各參數(shù)采用Logistic回歸分析,結果顯示腫塊強化特征、T2WI信號、ADC值、瘤周血管為預測TNBC的獨立危險因素(P均<0.05)。其OR值和95%可信區(qū)間見表3。病灶若為環(huán)形強化、T2WI呈高信號、較高ADC值、瘤周血管增多,則發(fā)生TNBC的風險性分別是非TNBC的7.1、15.6、1.6、3.3倍。
2.3 ROC曲線分析 根據(jù)多因素分析結果,繪制腫塊強化特點、T2WI、ADC值、瘤周血管及多因素分析的ROC曲線,見表4、圖3。強化特征、ADC值及瘤周血管單獨預測TNBC效能較好,而T2WI信號單獨預測效能較差。4個因素聯(lián)合診斷TNBC的AUC最高,為0.840。

表1 乳腺MRI掃描序列及參數(shù)
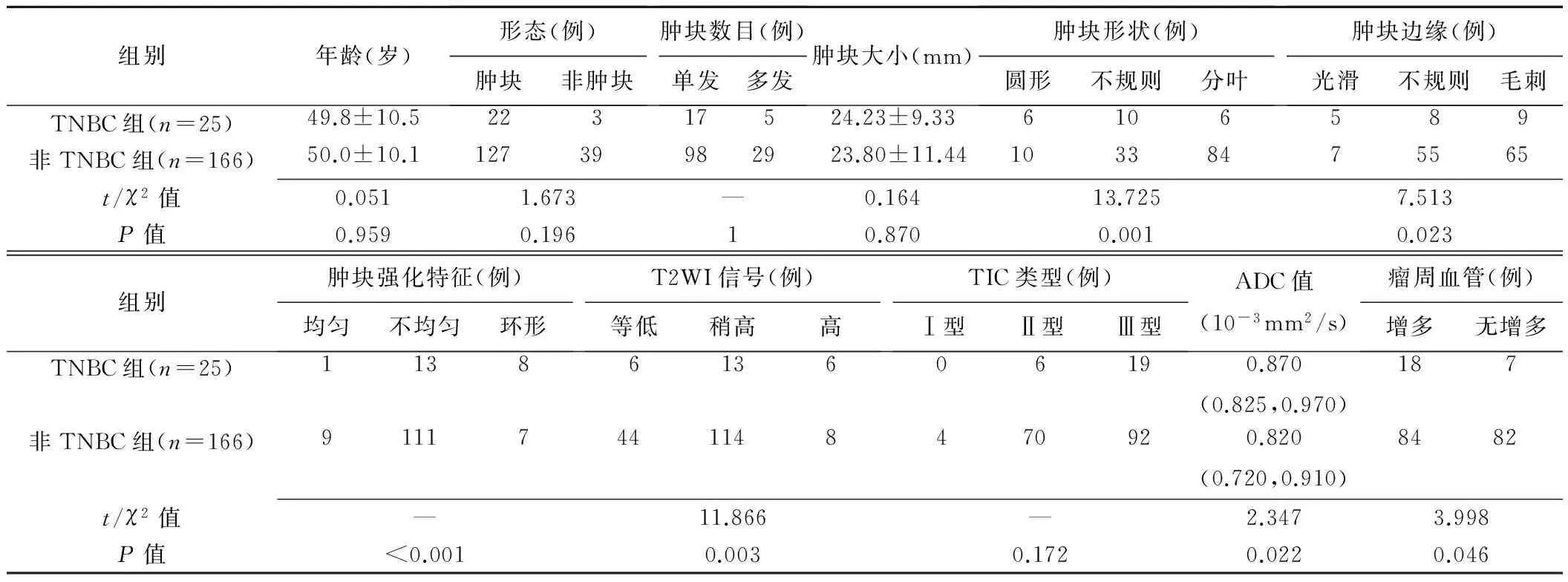
表2 各組乳腺癌MRI及病理特征
注:—:采用Fisher確切概率法
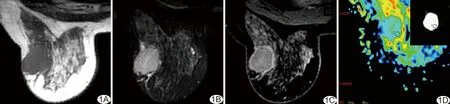
圖1 患者女,47歲,左側TNBC MRI表現(xiàn)為圓形腫塊,邊緣光滑,T1WI呈低信號(A),T2WI呈高信號(B),增強掃描呈環(huán)形強化(C),腫塊ROI的ADC值為0.836×10-3 mm2/s(D)
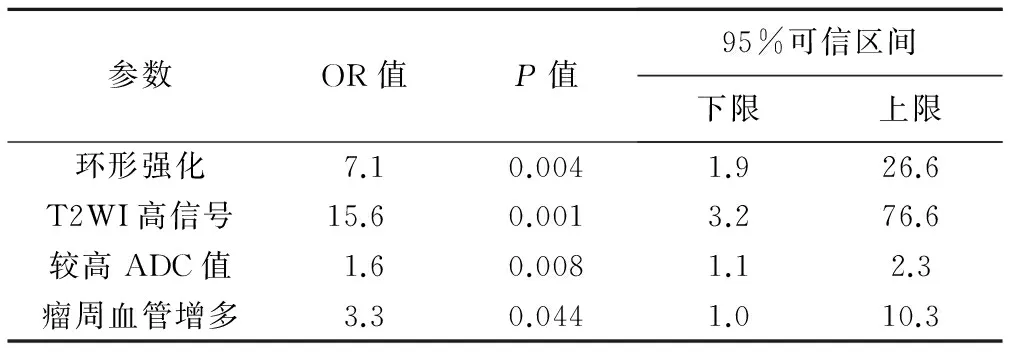
參數(shù)OR值P值95%可信區(qū)間下限上限環(huán)形強化7.10.0041.926.6T2WI高信號15.60.0013.276.6較高ADC值1.60.0081.12.3瘤周血管增多3.30.0441.010.3
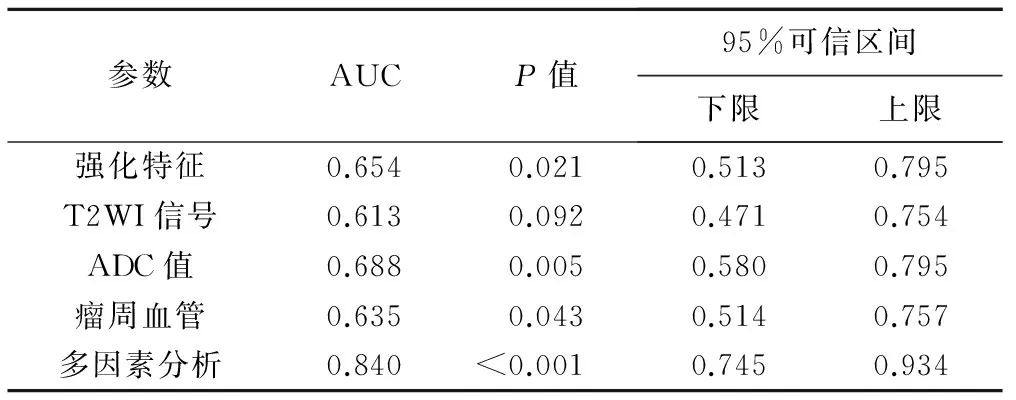
表4 ROC曲線分析
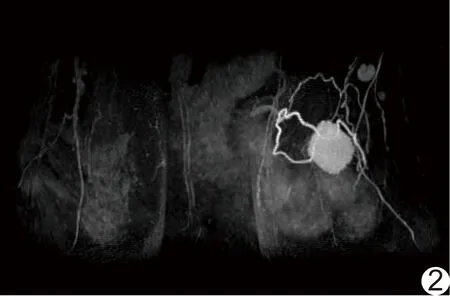
圖2 患者女,46歲,左側TNBC,MRI 3D MIP重建顯示瘤周血管增多
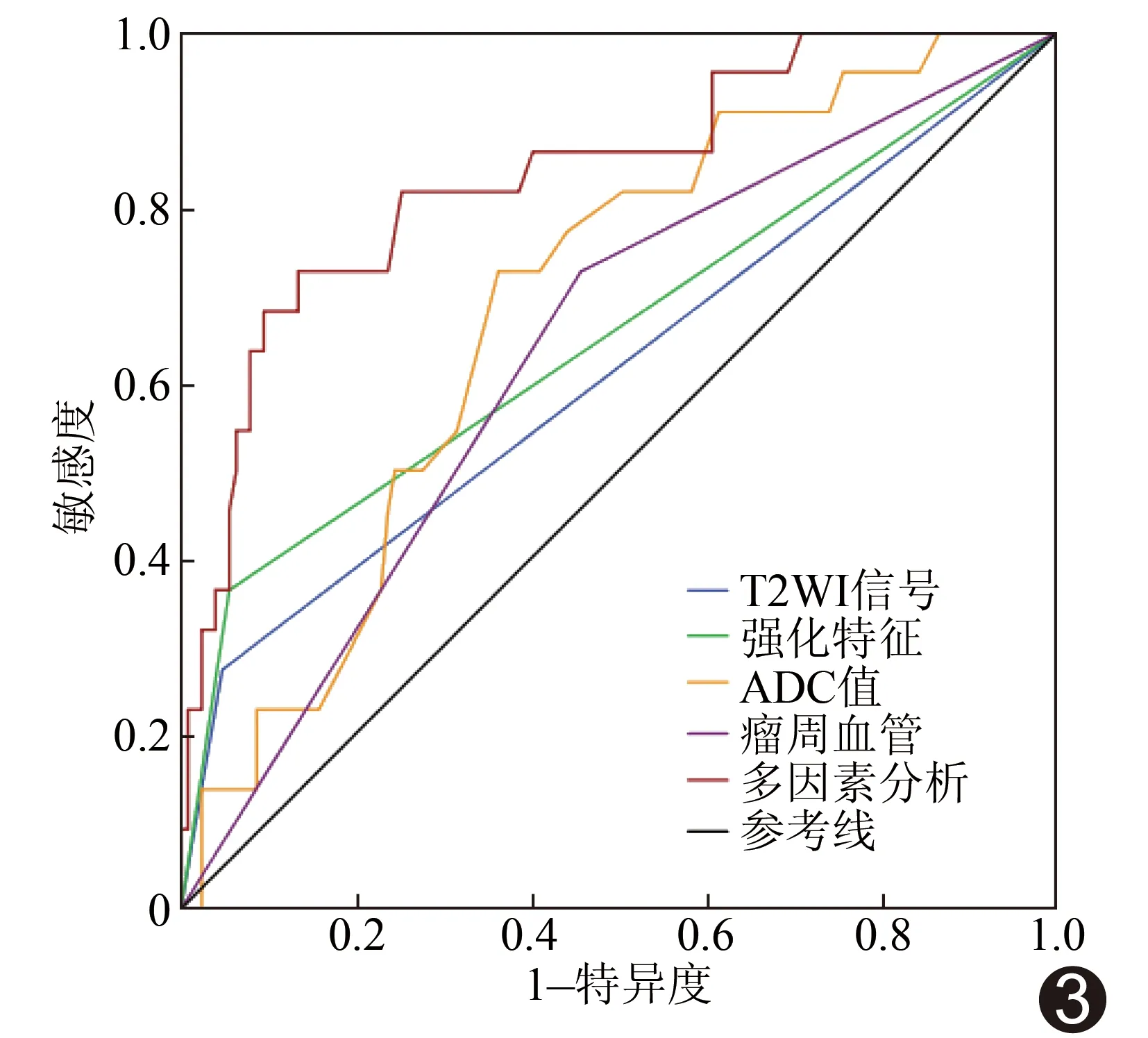
圖3 TNBC強化特征、T2WI信號、ADC值、瘤周血管及多因素分析的ROC曲線,4個因素聯(lián)合分析時效能最高,AUC最大
3 討論
TNBC約占乳腺癌的10%~17%,本研究TNBC組占13.09%(25/191),TNBC組與非TNBC組年齡差異無統(tǒng)計學意義。有學者[5,10]提出,腫瘤內部T2WI呈高信號是增加診斷TNBC準確率的一個特征。本研究中,TNBC組T2WI更多地表現(xiàn)為高信號。其可能由于TNBC生長快,易發(fā)生壞死、纖維化伴淋巴細胞浸潤導致T2WI信號增高[11]。此外,TNBC更多地表現(xiàn)為邊緣光滑的圓形腫塊,且增強掃描多呈環(huán)形強化,與既往研究[10-11]結果相似,表明圓形、邊緣光滑的乳腺病變不能輕易地作為診斷良性的征象,應結合其他征象排除惡性的可能。對于環(huán)形強化,Uematsu等[11]報道,56個TNBC中有80%腫塊表現(xiàn)為環(huán)形強化,邊緣光滑的腫塊更易表現(xiàn)為環(huán)形強化,而非TNBC多表現(xiàn)為不均勻強化。因此環(huán)形強化可作為判斷TNBC的重要特征之一。部分學者[12]認為這可能與病灶中心較容易形成瘢痕、病灶內部與邊緣的纖維化程度不同,或與炎癥細胞浸潤等因素有關。
一般細胞增殖越旺盛,組織細胞密度越大,ADC值越低[13]。然而對TNBC,腫瘤內部易壞死,壞死區(qū)域細胞密度減低,水分子更易擴散,因此ADC值相對增高(比非TNBC病灶高,但仍低于正常腺體組織)。Youk等[11]研究也表明,TNBC組平均ADC值高于HER-2過表達組,而腫瘤T2WI呈高信號與ADC值顯著相關。這也間接證明了TNBC組T2WI呈高信號傾向。本研究TNBC組ADC值中位數(shù)0.870×10-3mm2/s,高于非TNBC組,與研究[11]報道一致。
乳腺癌血供豐富,其生長及發(fā)展均依賴于腫瘤血管的生成及供血。利用乳腺MRI動態(tài)增強3D血管減影技術,能無創(chuàng)、清晰地顯示乳腺內部血管分布情況。國內外研究[14-15]均表明,乳腺癌一側血管數(shù)量較對側明顯增多,但尚鮮見應用MRI分析TNBC瘤周血管方面的報道。本研究通過與非TNBC組比較,發(fā)現(xiàn)TNBC組瘤周血管明顯增多,表明TNBC瘤周血管分布更密集,血供更豐富,符合其生長快、侵襲性強、惡性度高的特點。
本研究通過多因素Logistic回歸分析發(fā)現(xiàn),單因素分析中有意義的變量“腫塊形狀”、“腫塊邊緣”并未進入回歸模型,表明二者預測TNBC可能受其他參數(shù)影響,預測TNBC的價值不大。而病灶T2WI信號、腫塊強化特征、ADC值、瘤周血管則可作為預測TNBC的獨立危險因素。ROC表明4個因素聯(lián)合分析預測效能最高,如果病灶T2WI呈高信號,腫塊呈環(huán)形強化、ADC值相對較高,瘤周血管增多,則應視為TNBC的高危病例。
本研究不足之處在于,TNBC本身占乳腺癌比例較小,造成TNBC組樣本量相對較小,因此有待于今后對更多的病例進一步驗證。
[1] Dai X, Xiang L, Li T, et al. Cancerhallmarks, biomarkers and breast cancer molecular subtypes. J Cancer, 2016,7(10):1281-1294.
[2] Coates AS, Winer EP, Goldhirsch A, et al. Tailoring therapies—improving the management of early breast cancer: St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2015. Ann Oncol, 2015,26(8):1533-1546.
[3] Bosch A, Eroles P, Zaragoza R, et al. Triple -negative breast cancer:Molecular features, pathogenesis, treatment and current lines of research. Cancer Treat Rev, 2010,36(3):206-215.
[4] Fan M, Li H, Wang S, et al. Radiomic analysis reveals DCE-MRI features for prediction of molecular subtypes of breast cancer. PLoS One, 2017,12(2):e0171683.
[5] Sung JS, Jochelson MS, Brennan S, et al. MR imaging features of triple-negative breast cancers. Breast J, 2013,19(6):643-649.
[6] Osman NM, Chalabi N, Raboh NMA. Triple negative breast cancer: MRI features in comparison to other breast cancer subtypes with correlation to prognostic pathologic factors. The Egyptian Journal of Radiology & Nuclear Medicine,2014,45(4):1309-1316.
[7] 李艷玲,李曉婷,曹崑,等.三陰型乳腺癌的MRI特征.中國醫(yī)學影像技術,2015,31(2):244-247.
[8] Sardanelli F, Iozzelli A, Fausto A, et al. Gadobenate dimeglumine-enhanced MR imaging breast vascular maps: Association between invasive cancer and ipsilateral increased vascularity. Radiology, 2005,235(3):791-797.
[9] Wolff AC, Hammond ME, Schwartz JN, et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for human epidermal growth factor receptor 2 testing in breast cancer. J Clin Oncol, 2007,25(1):118-145.
[10] Youk JH, Son EJ, Chung J, et al. Triple-negative invasive breast cancer on dynamic contrast-enhanced and diffusion-weighted MR imaging: Comparison with other breast cancer subtypes. Eur Radiol, 2012,22(8):1724-1734.
[11] Uematsu T, Kasami M, Yuen S. Triple-negative breast cancer:Correlation between MR imaging and pathologic findings. Radiology, 2009,250(3):638-647.
[12] Jinguji M, Kajiya Y, Kamimura K, et al. Rimenhancement of breast cancers on contrast-enhanced MR imaging: Relationship with prognostic factors. Breast Cancer, 2006,13(1):64-73.
[13] Tang MY, Zhang XM, Chen TW, et al. Various diffusion magnetic resonance imaging techniques for pancreatic cancer. World J Radiol, 2015,7(12):424-437.
[14] Dietzel M, Baltzer PA,Vag T,et al. The adjacent vessel sign on breast MRI: New data and a subgroup analysis for 1,084 histologically verified cases. Korean J Radiol, 2010,11(2):178-186.
[15] 周海鷹,陳天武,張小明.乳腺血供不對稱性增加及鄰近血管征鑒別診斷乳腺良惡性病變,中國醫(yī)學影像技術,2016,6(32):900-904.
3.0TMRIinpredictingtriplenegativebreastcancer
JIANGSen1,HONGYoujia2,XIAOYing1,ZHANGFan3,LIYangkang1*
(1.DepartmentofRadiology, 2.DepartmentofUltrasound, 3.OncologyResearchLaboratory,CancerHospitalofShantouUniversityMedicalCollege,Shantou515041,China)
ObjectiveTo evaluate the related factors in 3.0T MR imaging features for predicting triple negative breast cancer (TNBC).MethodsTotally 191 patients with breast cancer confirmed by histopathology were enrolled, among them 25 were TNBC (TNBC group), while the other 166 were non-TNBC (non-TNBC group). All patients underwent 3.0T MR examination. Patient age, tumor size, shape, margin, enhancement pattern, signal intensity on T2WI, time-intensity curve (TIC), ADC value, and peritumoral vessel between the two groups were compared. Univariate and multivariateLogisticregression analyses were used to predict the related factors.ResultsCompared with non-TNBC group, smooth margin (P=0.023), round mass (P=0.001), rim enhancement (P<0.001), high signal intensity on T2WI (P=0.003), higher ADC value (P=0.022) and increased peritumoral vessel (P=0.046) were significantly associated with TNBC. Further multivariateLogisticregression analysis identified four independent risk factors of TNBC (allP<0.05), including enhancement pattern, signal intensity on T2WI, ADC value and increased peritumoral vessel. The area under ROC curve of combination of the 4 factors was 0.840.ConclusionRim enhancement of mass, high signal intensity on T2WI, higher ADC value, and increased peritumoral vessels are independent risk factors in predicting TNBC.
Breast neoplasms; Triple negative breast cancer; Magnetic resonance imaging
江森(1982—),男,廣東汕頭人,碩士,主治醫(yī)師。研究方向:腫瘤影像診斷。E-mail: jansn32888@yeah.net
李仰康,汕頭大學醫(yī)學院附屬腫瘤醫(yī)院放射科,515041。E-mail: liyangkang@yahoo.com
2017-04-27
2017-07-27
R737.9; R445.2
A
1003-3289(2017)11-1656-05
10.13929/j.1003-3289.201704140

