齊整小核菌SCL2010產小核菌多糖培養基優化的研究
張永剛,王 偉,張艷敏,董學前*
(山東省食品發酵工業研究設計院,山東 濟南 250013)
齊整小核菌SCL2010產小核菌多糖培養基優化的研究
張永剛,王 偉,張艷敏,董學前*
(山東省食品發酵工業研究設計院,山東 濟南 250013)
采用單因素和正交試驗對小核菌多糖高產菌株齊整小核菌(Sclerotium rolfsii)SCL2010的培養基成分進行了深入地篩選與優化。結果表明,最佳培養基配方為葡萄糖45.0 g/L,玉米漿1.5 g/L,NaNO32.0 g/L,K2HPO4·3H2O 2.0 g/L,檸檬酸0.7 g/L,MgSO4·7H2O 1.5 g/L,KCl 2.0 g/L。在此優化條件下,小核菌多糖的產量為31.81 g/L,碳源轉化率為70.69%。采用發酵罐進行小試放大試驗,小核菌多糖的產量達到31.86 g/L,碳源轉化率為70.80%,發酵液表觀黏度達到4 500 mPa·s,并將發酵時間縮短至60 h左右,具有顯著效果。
小核菌多糖;齊整小核菌;高產菌株;培養基;優化
小核菌多糖(scleroglucan)又稱硬葡聚糖,小核菌膠是由絲狀真菌齊整小核菌產生的非離子水溶性多糖,其分子是由含有β-D-(1,6)-葡萄糖殘基側鏈的線性β-D-(1,3)-葡萄糖殘基鏈組成。小核菌多糖的顯著特性是良好的流變性與穩定性,在廣泛的pH(1~12)、礦化度(0~200 000 g/L)和溫度(130℃)均具有良好的穩定性[1-3]。小核菌多糖在石油工業具有潛在的應用價值。在當前油田普遍進入三次、四次采用的趨勢下,小核菌多糖在用于提高原油采收率的助劑方面具有廣闊的市場前景[4-8]。但是,目前限制小核菌多糖應用的最主要因素是因為產量不高使其價格居高不下,這嚴重限制了其市場的開發拓展。因此,研究提高小核菌多糖的產率是相關研究的主要關注點。截止目前,已有通過高產菌株篩選誘變、培養基與發酵條件優化、發酵罐設計等提高小核菌多糖產量的相關研究[4,9-12]。
目前關于小核菌多糖發酵生產的相關研究所采用的菌株主要有齊整小核菌(Sclerotium rolfsii)ATCC 201126、ATCC 15205、MTCC 2156[12-14],發酵培養基成分基本相同,發酵碳源為蔗糖,有機氮源為酵母膏發酵產率多在20 g/L左右[15-17]。為提高小核菌多糖的發酵產率,篩選得一株顯著高產小核菌多糖的絲狀真菌,通過18SrDNA測序比對,該菌株屬于齊整小核菌,命名為齊整小核菌(Sclerotium rolfsii)SCL2010。經初步發酵研究表明齊整小核菌SCL2010合成小核菌多糖的發酵過程與現有報道具有顯著區別。在已有研究報道中,發酵液的pH變化基本一致,由4.5逐漸下降至2.0左右,而菌株SCL2010發酵過程中pH由初始的4.5迅速下降至2.8左右后緩慢回升至3.8,其高產特性可能與其獨特的pH變化有關。本研究采用齊整小核菌SCL2010作為生產菌株,通過對發酵培養基的優化提出了適合于高產菌株齊整小核菌SCL2010發酵產小核菌多糖的培養基組成及其比例,為后續工業化制備奠定了良好的基礎。
1 材料與方法
1.1 材料與試劑
1.1.1 菌種
齊整小核菌(Sclerotium rolfsii)SCL2010:已保藏于中國典型培養物保藏中心(China center for type culture collection,CCTCC),保藏編號:NO.M2014325。
1.1.2 化學試劑
葡萄糖、NaNO3、K2HPO4·3H2O、檸檬酸、MgSO4·7H2O、KCl、蔗糖、果糖等(均為分析純):國藥集團化學試劑有限公司;玉米淀粉、馬鈴薯淀粉、可溶性淀粉、玉米漿:西王集團有限公司;酵母膏、蛋白胨(均為生化試劑):安琪酵母股份有限公司。
1.1.3 培養基
發酵培養基:葡萄糖50.0 g/L,酵母膏2.0 g/L,NaNO32.0 g/L,K2HPO4·3H2O 1.0 g/L,檸檬酸0.7 g/L,MgSO4·7H2O 0.5 g/L,KCl 0.5 g/L,pH 4.5,115℃滅菌20 min。
1.2 儀器與設備
CF16RN臺式高速離心機:日本日立公司;ZQWY-200振蕩培養箱:上海知楚儀器有限公司;10 L自動生物反應器:上海百侖生物科技有限公司;FM200高剪切均質機:上海弗魯克流體機械制造有限公司;GZX-9030MBE電熱鼓風干燥箱:上海博迅實業有限公司;DV2T型黏度計:美國Brookfield公司。
1.3 方法
1.3.1 小核菌多糖搖瓶及發酵罐培養條件[4,11,16]
搖瓶發酵培養條件:搖瓶裝液量80 mL/500 mL,接種量10%,發酵溫度28℃,搖床轉速300 r/min,發酵時間72 h。
發酵罐發酵培養條件:裝液量60%,接種量10%,發酵溫度28℃,攪拌轉速350 r/min,發酵時間72 h。
1.3.2 小核菌多糖產量和生物量[16]
取10 mL發酵液中和后用蒸餾水稀釋3~4倍,80℃水浴30 min,均質1~2 min后8 000×g離心30 min。上清液加兩倍體積分數為95%的乙醇沉淀小核菌多糖,過濾后再用體積分數為95%的乙醇洗滌一次后所得沉淀在85℃條件下干燥,稱質量測定小核菌多糖產量。離心所得沉淀用蒸餾水溶解洗滌后8 000×g離心30 min,所得沉淀在80℃條件下干燥至恒質量,稱質量即為生物量。

1.3.3 分析測定
發酵液表觀黏度采用DV2T型黏度計測定:64號轉子,60 r/min、25℃。
1.0 %多糖溶液黏度采用DV2T型黏度計測定:63號轉子,60 r/min、25℃。
采用斐林試劑法測定發酵液中的殘糖量[18]。
1.3.4 小核菌多糖發酵培養基配方優化單因素試驗
單因素試驗采用搖瓶發酵條件,以小核菌多糖產量作為主要考察指標,根據不同實驗要求選擇增加其他輔助考察指標如生物量、1%多糖溶液黏度、殘糖、碳源轉化率、發酵液表觀黏度等,考察不同的碳源(玉米淀粉、馬鈴薯淀粉、木薯淀粉、蔗糖、葡萄糖、麥芽糖、乳糖、可溶性淀粉、果糖)、葡萄糖添加量(35 g/L、40 g/L、45 g/L、50 g/L、55 g/L、60 g/L、65 g/L)、有機氮源(酵母膏、玉米漿、蛋白胨、大豆蛋白胨、水解豆粉)、玉米漿添加量(0.5 g/L、1.0 g/L、1.5 g/L、2.0 g/L、2.5 g/L、3.0 g/L)、無機鹽添加量(NaNO3、K2HPO4、MgSO4、KCl)對小核菌多糖發酵的影響。
1.3.5 小核菌多糖發酵培養基配方優化正交試驗
在單因素試驗基礎上,以多糖產量作為考察指標,以葡萄糖、玉米漿、K2HPO4和MgSO4添加量作為影響因素,采用4因素3水平正交試驗設計進行培養基配方的進一步優化,正交試驗因素與水平見表1。

表1 小核菌多糖發酵培養基配方優化正交試驗因素與水平Table 1 Factors and levels of orthogonal experiments for medium formula optimization of scleroglucan fermentation
2 結果與分析
2.1 碳源對發酵產小核菌多糖的影響
選擇玉米淀粉、馬鈴薯淀粉、木薯淀粉、蔗糖、葡萄糖、麥芽糖、乳糖、可溶性淀粉、果糖等作為碳源,添加量均為30 g/L,發酵時間為72 h,考察不同碳源對發酵產小核菌多糖的影響,結果見圖1。

圖1 不同碳源對產小核菌多糖的影響Fig.1 Effects of different carbon sources on scleroglucan production
由圖1可知,以玉米淀粉、馬鈴薯淀粉和葡萄糖作為碳源時,小核菌多糖的產量相對較高,蔗糖和木薯淀粉次之,其他碳源則不利于多糖的合成;蔗糖與葡萄糖作為碳源時,1.0%小核菌多糖溶液的黏度較高;玉米淀粉、馬鈴薯淀粉和木薯淀粉作為碳源時,菌體生物量較高。綜合考慮小核菌多糖的產量與產品品質,選擇葡萄糖作為菌株SCL2010發酵生產小核菌多糖的碳源。
2.2 葡萄糖添加量對發酵產小核菌多糖的影響

圖2 不同的葡萄糖添加量對產小核菌多糖的影響Fig.2 Effects of different glucose addition on scleroglucan production
由圖2可知,隨著葡萄糖添加量的增加,小核菌多糖產量呈上升趨勢;當葡萄糖添加量為45 g/L時,小核菌多糖產量達到29.80 g/L,生物量為15.04 g/L,碳源轉化率達到66.2%;但當葡萄糖添加量>45 g/L后,多糖產量增加放緩,碳源轉化率開始顯著下降,殘糖量急劇上升。因此,該菌株發酵生產小核菌多糖適宜葡萄糖添加量為45 g/L。
2.3 有機氮源對發酵產小核菌多糖的影響

圖3 不同有機氮源對產小核菌多糖的影響Fig.3 Effects of different organic nitrogen sources on scleroglucan production
由圖3可知,當以玉米漿為有機氮源時,小核菌多糖產量和菌體生物量分別達到28.51 g/L和10.72 g/L,都高于其他4種有機氮源,因此菌株SCL2010適合的有機氮源為玉米漿。氮源的種類對1.0%多糖產品的黏度影響不大。綜合考慮小核菌多糖的產量與產品品質,選擇玉米漿作為菌株SCL2010發酵生產小核菌多糖的有機氮源。
2.4 玉米漿添加量對發酵產小核菌多糖的影響
由圖4可知,隨著玉米漿添加量的增加,菌體生物量呈上升趨勢;當玉米漿添加量為1.5 g/L時,多糖產量最大,為28.23 g/L;小核菌多糖產量在玉米漿添加量>2.0 g/L時變化不大,小核菌多糖的合成量開始下降。因此,玉米漿適宜添加量為1.5 g/L。

圖4 不同玉米漿添加量對產小核菌多糖的影響Fig.4 Effects of different corn steep liquor addition on scleroglucan production
2.5 無機鹽對發酵產小核菌多糖的影響

圖5 無機鹽對小核菌多糖產量的影響Fig.5 Effects of inorganic salt on scleroglucan production
由圖5可知,K2HPO4和MgSO4在一定范圍內對小核菌多糖的產量影響顯著,因此選擇作為后續正交試驗優化的培養基組分;其他兩種無機鹽NaNO3和KCl則分別選擇2.0 g/L、2.0g/L作為優化后培養基中的添加量。
2.6 培養基配方優化正交試驗
在單因素試驗基礎上,對影響較顯著的葡萄糖添加量(A)、玉米漿添加量(B)、K2HPO4添加量(C)、和MgSO4添加量(D)進行了4因素3水平的正交試驗優化,結果與分析見表2、方差分析見表3。
由表2可知,各因素對小核菌多糖產量影響由大到小依次為A>B>D>C,即葡萄糖>玉米漿>MgSO4>K2HPO4。由極差分析得出正交試驗優化后培養基組成為A3B2C3D1,即葡萄糖50.0 g/L;玉米漿1.5 g/L;K2HPO42.0 g/L和MgSO41.5g/L。在此優化培養基條件下進行驗證試驗,多糖產量為32.15 g/L,碳源轉化率達到64.30%。在正交試驗中最優配方組合A2B2C3D1,即葡萄糖45.0 g/L;玉米漿1.5 g/L;K2HPO42.0g/L和MgSO41.5g/L條件下,小核菌多糖的產量為31.81g/L;碳源轉化率為70.69%。在以多糖產量為主要參考指標綜合考慮碳源轉化率后,選擇小核菌多糖的最佳發酵培養基配方為A2B2C3D1,即葡萄糖45.0 g/L;玉米漿1.5 g/L;K2HPO42.0 g/L和MgSO41.5 g/L。

表2 小核菌多糖培養基配方優化正交試驗優化結果與分析Table 2 Results and analysis of orthogonal experiments for medium formula optimization of scleroglucan fermentation

表3 正交試驗結果方差分析Table 3 Variance analysis of orthogonal experiments results
由表3可知,葡萄糖和玉米漿添加量對小核菌多糖產量的影響顯著(P<0.05),其他因素對小核菌多糖產量影響不顯著(P>0.05)。
2.7 發酵罐放大實驗
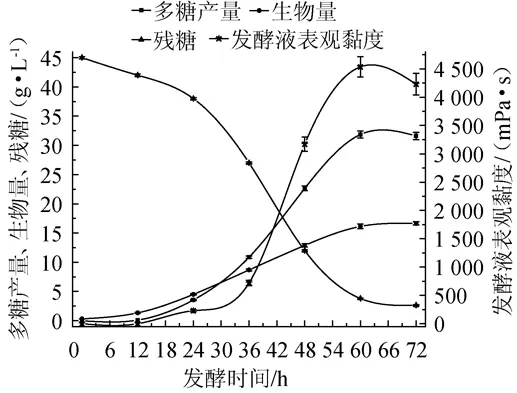
圖6 小核菌多糖發酵罐發酵曲線Fig.6 Fermentation curve of scleroglucan in fermentor
以小核菌多糖高產菌株齊整小核菌SCL2010為生產菌株,采用優化后的發酵培養基在10 L自動發酵罐進行放大試驗,其發酵過程如圖6所示。由圖6可知,小核菌多糖的產量達到31.86 g/L,碳源轉化率為70.80%,與搖瓶驗證試驗結果基本符合;發酵液表觀黏度達到4 500 mPa·s,顯著高于現有研究報道[9-17];多糖產量達到最高點在發酵60 h左右比搖瓶發酵速度快。
3 結論
對小核菌多糖高產菌株齊整小核菌SCL2010的培養基成分進行了篩選與優化,通過單因素和正交試驗優化,獲得了小核菌多糖的高產優化培養基,其組成為葡萄糖45.0g/L;玉米漿1.5g/L;NaNO32.0g/L;K2HPO4·3H2O2.0g/L;檸檬酸0.7 g/L;MgSO4·7H2O 1.5 g/L;KCl 2.0 g/L。在此最佳發酵培養基配方條件下,小核菌多糖的產量為31.81 g/L;碳源轉化率為70.69%,達到了小核菌多糖的高產目的。最后采用10 L發酵罐進行小試放大試驗,小核菌多糖的產量達到31.86 g/L,碳源轉化率為70.80%,發酵液表觀黏度達到4 500 mPa·s,顯著高于現有研究報道[9-17],并將發酵時間縮短至60 h左右。研究結果對于小核菌多糖的工業化生產具有顯著促進作用。
[1]FARI?A J I,SI?ERIZ F,MOLINA O E,et al.Isolation and physicochemical characterization of soluble scleroglucan fromSclerotium rolfsii.Rheological properties,molecular weight and conformational characteristics[J].Carbohyd Polym,2001,44(1):41-50.
[2]FARI?A J I,VI?ARTA S C,CATTANEO M,et al.Structural stability of Sclerotium rolfsiiATCC 201126 β-glucan with fermentation time:a chemical,infrared spectroscopic and enzymatic approach[J].J Appl Microbiol,2009,106(1):221-232.
[3]VI?ARTA S C,DELGADO O D,FIGUEROA L I C,et al.Effects of thermal,alkaline and ultrasonic treatments on scleroglucan stability and flow behavior[J].Carbohyd Polym,2013,94(1):496-504.
[4]SCHMID J,MEYER V,SIEBER V.Scleroglucan:biosynthesis,production and application of a versatile hydrocolloid[J].Appl Microbiol Biotechnol,2011,91(4):937-947.
[5]天津市工業微生物研究所.小核菌硬葡聚糖發酵液作為油田鉆井液處理劑的應用,CN201210587334.4[P].2013-05-08.
[6]李 冰,張建法,蔣鵬舉.真菌硬葡聚糖的生產及在油田上的應用[J].微生物學通報,2003,30(5):99-102.
[7]杜冠樂,段 凡.天然高分子在油田鉆井液的應用研究[J].石油化工應用,2013,32(8):1-4.
[8]HALLIBURTON ENERGY SERVICES,INC.Inhibiting salting out of diutan or scleroglucan in well treatment:US,20140378353 A1[P].2014-12-25.
[9]天津市工業微生物研究所.小核菌硬葡聚糖在線發酵提取方法及系統,CN201110006769.0[P].2013-06-05.
[10]TASKINM,ERDALS,CANLIO.Utilizationofwasteloquat(Eriobotrya JaponicaLindley)kernels as substrate for scleroglucan production by locally isolatedSclerotium rolfsii[J].Food Sci Biotechnol,2010,19(4):1069-1075.
[11]SURVASE S A,SAUDAGAR P S,SINGHAL R S.Production of scleroglucan fromSclerotium rolfsiiMTCC 2156[J].Bioresour Technol,2006,97(8):989-993.
[12]WANG Y,MCNEIL B.Scleroglucan and oxalic acid formation bySclerotium glucanicumin sucrose supplemented fermentations[J].Biotechnol Lett,1994,16(6):605-610.
[13]FARI?A J I,SANTOS V E,PEROTTI N I,et al.Influence of the nitrogen source on the production and rheological properties of scleroglucan produced bySclerotium rolfsiiATCC 201126[J].World J Microbiol Biotechnol,1999,15(2):309-316.
[14]SCHILLING B M,RAU U,MAIER T,et al.Modeling and scale-up of the unsterile scleroglucan production process withSclerotium rolfsii ATCC 15205[J].Bioprocess Eng,1999,20(3):195-201.
[15]SURVASESA,SAUDAGARPS,SINGHALRS.Useofcomplexmedia for the production of scleroglucan bySclerotium rolfsiiMTCC 2156[J].Bioresource Technol,2007,98(7):1509-1512.
[16]FARI?A J I,SI?ERIZ F,MOLINA O E,et al.High scleroglucan production bySclerotium rolfsii:influence of medium composition[J].Biotechnol Lett,1998,20(9):825-831.
[17]SCHILLINGBM.Sclerotium rolfsiiATCC 15205 in continuous culture:Economical aspects of scleroglucan production[J].Bioprocess Eng,2000,22(1):57-61.
[18]楊林娥,彭曉光,楊慶文,等.斐林試劑法測定還原糖方法的改進[J].中國釀造,2010,29(5):160-161.

ZHANG Yonggang,WANG Wei,ZHANG Yanmin,DONG Xueqian*
(Shandong Food Ferment Industry Research&Design Institute,Jinan 250013,China)
Q93-335
0254-5071(2017)11-0049-05
10.11882/j.issn.0254-5071.2017.11.011
2017-09-01
山東省重點研發計劃項目(2015GGX102015)
張永剛(1985-),男,工程師,碩士,研究方向為微生物聚合物發酵生產技術與產業化應用。
*通訊作者:董學前(1978-),男,研究員,碩士,研究方向為微生物聚合物及資源化利用。

