康艾注射液輔助化療治療晚期肺癌的臨床觀察
路顏增,譚柏清,孫東平,羅維曉(1.勝利油田中心醫院檢驗科,山東東營57038;.山東博科生物產業有限公司,濟南 5000)
康艾注射液輔助化療治療晚期肺癌的臨床觀察
路顏增1*,譚柏清2#,孫東平2,羅維曉2(1.勝利油田中心醫院檢驗科,山東東營257038;2.山東博科生物產業有限公司,濟南 250200)
目的:探討康艾注射液輔助化療治療晚期肺癌的臨床療效及安全性。方法:選取2013年5月-2014年4月晚期肺癌患者146例,根據入院單雙號分為觀察組和對照組,各73例。對照組患者給予GP(吉西他濱+順鉑)方案化療;觀察組患者在對照組基礎上加用康艾注射液60 mL加入生理鹽水250 mL中,qd,ivgtt,每個化療周期連用14 d。兩組患者化療期間均采用托烷司瓊5 mg預防胃腸道反應。3周為一個療程,兩組患者均治療3個療程。比較兩組患者臨床療效及治療前后血清炎性因子[超敏C反應蛋白(hs-CRP)、腫瘤壞死因子α(TNF-α)、干擾素γ(IFN-γ)、白細胞介素10(IL-10)]、免疫功能指標(CD3+、CD4+、CD8+、CD4+/CD8+)、腫瘤標志物[鱗狀細胞癌相關抗原(SCC-Ag)、癌胚抗原(CEA)、糖類抗原(CA)50、CA72-4]水平,并記錄不良反應發生情況。結果:觀察組患者的臨床有效率、疾病控制率分別為39.73%、84.93%,顯著高于對照組的23.29%、71.23%,差異均有統計學意義(P<0.05)。治療前,兩組患者血清炎性因子、免疫指標、腫瘤標志物水平比較,差異均無統計學意義(P>0.05);治療后,兩組患者hs-CRP、TNF-a、INF-γ水平均顯著低于治療前,IL-10顯著高于治療前,且觀察組上述指標均顯著優于于對照組,差異均有統計學意義(P<0.05);對照組CD4+、CD4+/CD8+水平顯示降低,且顯著低于觀察組,差異均有統計學意義(P<0.05);兩組患者血清SCC-Ag、CEA、CA50、CA72-4水平均顯著降低,且觀察組顯著低于對照組,差異均有統計學意義(P<0.05)。觀察組患者血小板減少、中性粒細胞減少、肝功能異常、惡心嘔吐、貧血的發生率均顯著低于對照組,差異均有統計學意義(P<0.05)。結論:康艾注射液輔助化療能有效緩解晚期肺癌患者的炎癥狀態,減輕毒副反應,增強免疫功能,提高近期療效,且安全性較高。
晚期肺癌;康艾注射液;炎性因子;免疫功能;腫瘤標志物
肺癌是我國城鎮居民發病率最高的一種惡性腫瘤,給人民的生命健康造成了極大的威脅。晚期肺癌患者失去手術機會,只能采取化療、放療等姑息性治療手段,以延長壽命、改善生活質量[1]。化療藥物的副反應較重,在殺滅腫瘤細胞的同時,給患者體內正常組織細胞和免疫功能均造成了極大的損傷[1]。康艾注射液是一種中藥制劑,具有免疫調節作用,可以減輕化療毒副反應并提高化療效果[2]。本研究探討了用康艾注射液靜脈注射輔助化療對晚期肺癌患者血清炎性因子、免疫功能指標及腫瘤標志物的影響。
1 資料與方法
1.1 納入與排除標準
納入標準:(1)經病理學檢查確診為肺癌;(2)晚期肺癌且伴有不同程度的遠處轉移病灶;(3)原發灶和轉移灶引起了較為明顯的腫瘤相關癥狀;(4)卡氏功能狀態評分(KPS)≥60分。
排除標準:(1)嚴重心、肝、腎等臟器功能不全者;(2)對化療藥物或康艾注射液過敏者。
1.2 研究對象
選擇2013年5月-2014年4月我院收治的晚期肺癌患者146例,根據入院單雙號分為觀察組和對照組,各73例。兩組患者一般資料比較,差異無統計學意義(P>0.05),具有可比性,詳見表1。本研究方案經醫院醫學倫理委員會批準,患者知情同意并簽署知情同意書。

表1 兩組患者一般資料比較Tab 1 Comparison of general information of patients between 2 groups
1.3 治療方法
兩組患者均采用GP化療方案:注射用鹽酸吉西他濱(辰欣藥業股份有限公司,批準文號:國藥準字H-20113371,規格:0.2 g)150 mg/m2,ivgtt(d1)+注射用順鉑(齊魯制藥有限公司,批準文號:國藥準字H37021357;規格:20 mg)75 mg/m2,ivgtt(d1、d3)。觀察組患者在對照組基礎上加用康艾注射液(長白山制藥股份有限公司,批準文號:國藥準字Z20026868,規格:10 mL)60 mL加入生理鹽水250 mL中,ivgtt,qd,每個周期連用14 d。每3周為1個療程,兩組患者均連續治療3個療程,化療期間均常規應用托烷司瓊5 mg預防胃腸道反應。
1.4 觀察指標
(1)觀察兩組患者臨床療效。根據世界衛生組織(WHO)實體瘤療效判斷標準[3]——完全緩解(CR):可測病灶完全消失,時間至少維持1個月;部分緩解(PR):可測病灶直徑縮小≥50%,時間至少維持1個月;穩定(NC):可測病灶直徑縮小<50%或增大<25%;進展(PD):可測病灶直徑增大≥25%。總有效=CR+PR,控制=CR+PR+NC。(2)觀察兩組患者治療前后血清炎癥因子[超敏C反應蛋白(hs-CRP)、腫瘤壞死因子α(TNF-α)、干擾素γ(IFN-γ)、白細胞介素10(IL-10)]、免疫指標(CD3+、CD4+、CD8+、CD4+/CD8+)、腫瘤標志物[鱗狀細胞癌相關抗原(SCC-Ag)、癌胚抗原(CEA)、糖類抗原(CA)50(CA50)、CA72-4]水平。采集患者空腹靜脈血4 mL,3 000 r/min離心10 min(離心半徑3 cm),采用日立7600型全自動生化分析儀檢測hs-CRP、TNF-α、IFN-γ、IL-10以及SCC-Ag、CEA、CA50、CA72-4水平,采用貝克曼庫爾特CytoFLEX流式細胞儀檢測CD3+、CD4+、CD8+水平,計算 CD4+/CD8+比值。檢測方法為酶聯免疫吸附法,所有試劑均購自北京晶美生物工程有限公司,嚴格按說明書操作。(3)參照WHO抗癌藥物毒性分級標準[4],記錄兩組患者不良反應發生情況。
1.5 統計學方法
采用SPSS 21.0軟件對數據進行統計分析。計量資料以x±s表示,采用t檢驗;計數資料和等級資料均以率表示,前者采用χ2檢驗,后者采用秩和檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者臨床療效比較
觀察組患者的總有效率為39.73%、控制率為84.93%,顯著高于對照組的23.29%、71.23%,差異均有統計學意義(P<0.05),詳見表2。
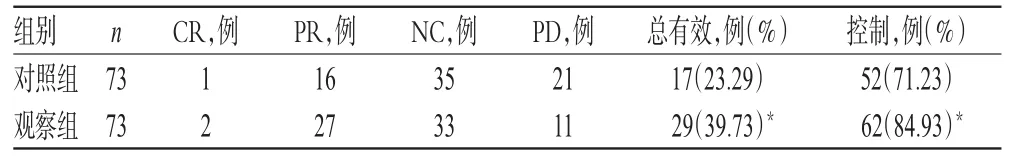
表2 兩組患者臨床療效比較Tab 2 Comparison of clinical efficacies between 2 groups
2.2 兩組患者治療前后血清炎癥因子水平比較
治療前,兩組患者血清hs-CRP、TNF-α、INF-γ、IL-10水平比較,差異均無統計學意義(P>0.05);治療后,兩組患者hs-CRP、TNF-α、INF-γ水平均顯著降低,IL-10水平顯著升高,且觀察組顯著優于對照組,差異均有統計學意義(P<0.05),詳見表3。
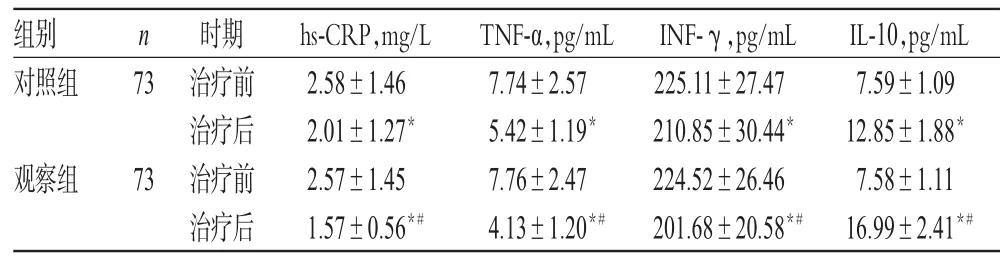
表3 兩組患者治療前后炎癥因子水平比較(x±s)Tab 3 Comparison of inflammatory factor levels between 2 groups before and aftertreatment(x±s)
2.3 兩組患者治療前后免疫功能指標比較
治療前,兩組患者CD3+、CD4+、CD8+、CD4+/CD8+水平比較,差異均無統計學意義(P>0.05)。治療后,對照組患者CD4+、CD4+/CD8+水平顯著降低,且顯著低于觀察組,差異均有統計學意義(P<0.05);觀察組患者治療前后CD3+、CD4+、CD8+、CD4+/CD8+水平及對照組患者治療前后CD3+、CD8+水平比較,差異均無統計學意義(P>0.05),詳見表4。
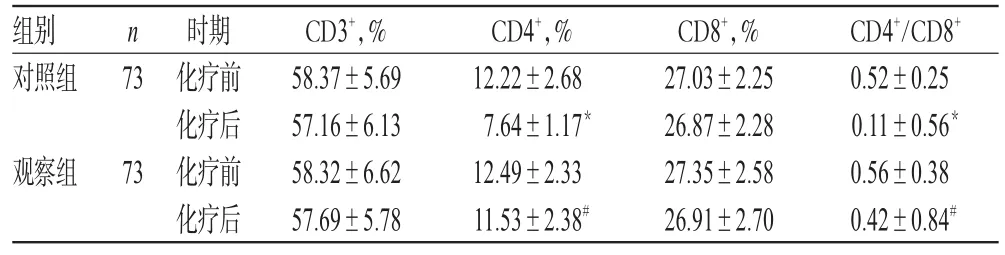
表4 兩組患者治療前后免疫功能指標水平比較(x±s)Tab 4 Comparison of immune function indexes levels between 2 groups before and after treatment(x±s)
2.4 兩組患者治療前后腫瘤標志物水平比較
治療前,兩組患者血清 SCC-Ag、CEA、CA50、CA72-4水平比較,差異均無統計學意義(P>0.05);治療后,兩組患者血清SCC-Ag、CEA、CA50、CA72-4水平均顯著降低,且觀察組顯著低于對照組,差異均有統計學意義(P<0.05),見表5。
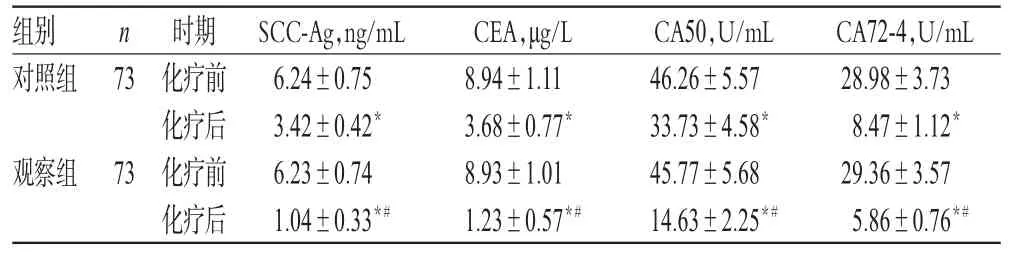
表5 兩組患者治療前后腫瘤標志物水平比較(x±s)Tab 5 Comparison of serum tumor markers levels between 2 groups beforeand aftertreatment(x±s)
2.5 不良反應
觀察組患者血小板減少發生率為35.62%、中性粒細胞減少發生率為45.21%、肝功能異常發生率為10.96%、惡心嘔吐發生率為46.58%,顯著低于對照組的73.97%、93.15%、23.29%、73.97%,差異均有統計學意義(P<0.05);觀察組患者貧血發生率為24.66%,與對照組的38.36%比較,差異無統計學意義(P>0.05)。
3 討論
康艾注射液是從人參、黃芪、苦參素等中藥中提取的有效成分制備的一種中藥抗癌注射液。人參總皂苷可促進造血干細胞(CFU-A)增殖,進而影響骨髓基質細胞、IL-6的表達[5];黃芪富含氨基酸與多種微量元素,能夠調節骨髓造血微環境,增加骨髓基質細胞與造血干細胞接觸機會,促進粒細胞集落刺激因子分泌,對免疫系統、血液系統有明顯改善作用,可明顯緩解化療藥物所致骨髓毒性;苦參素可抑制血管內皮細胞的增殖;黃芪多糖無明顯細胞毒性,可誘導腫瘤細胞凋亡,其作用機制可能與上調促凋亡蛋白與下調抑制凋亡蛋白的表達水平有關[6]。相關研究表明,康艾注射液輔助化療能夠減輕肺癌化療的骨髓抑制,緩解消化系統不良反應,保護造血系統[7]。本文研究結果與其基本一致。
C反應蛋白是急性炎癥反應的一種非特異性炎癥標志物;IL-10由活化Th2細胞產生,主要生物學效應是抑制細胞因子的產生;TNF-α、INF-γ主要由活化巨噬細胞、自然殺傷(NK)細胞、T細胞合成分泌。上述炎癥因子與晚期肺癌惡性生物學行為密切相關[8]。本研究結果顯示,觀察組患者治療后血清hs-CRP、TNF-α、INF-γ明顯低于對照組,IL-10明顯高于對照組,提示康艾注射液輔助化療能夠發揮協同作用,有助于改善晚期肺癌患者血清炎癥因子表達。
康艾注射液具有益氣扶正、增強機體免疫力的作用,可減輕惡性腫瘤放化療造成的副反應,尤其具有較好的升白細胞功效,能有效預防感染等并發癥[9]。人體免疫細胞中,CD4+為輔助性淋巴細胞,可分化產生抗體;CD8+細胞為效應細胞,主要抑制抗體的合成與分泌;CD4+/CD8+的動態平衡維持著機體正常免疫應答,若CD4+/CD8+比值下降意味著機體出現免疫抑制現象[10]。本研究結果顯示,觀察組患者治療后CD4+、CD4+/CD8+水平無明顯下降,且均明顯高于對照組,提示康艾注射液有助于緩解晚期肺癌患者化療過程中的免疫功能受損。
SCC-Ag是從腫瘤相關抗原TA4提取的一個糖蛋白片段,是一種特異性鱗癌標志物;CEA為非器官特異性腫瘤相關抗原,其升高程度與癌細胞數量直接相關,在肺部腫瘤患者中表達明顯升高,但在肺部良性病變中也有表達,診斷特異性較差[11];CA50是一種唾液酸酯與唾液酸糖蛋白,為一種非特異性廣譜腫瘤標志物;CA72-4在肺癌患者中均有不同程度的升高,且表達水平與腫瘤分期明顯相關,是一種具有較高敏感性和特異性的腫瘤標志物[12]。本研究結果顯示,兩組患者治療后血清SCC-Ag、CEA、CA50和CA72-4均明顯降低,觀察組表達水平明顯低于對照組,且觀察組患者的總有效率及控制率均顯著高于對照組,這一方面證實化療是治療晚期肺癌的有效方法,另一方面說明康艾注射液可以增強化療藥物的抗腫瘤作用。
綜上所述,康艾注射液輔助化療能有效緩解晚期肺癌患者的炎癥狀態,減輕毒副反應,增強免疫功能,提高近期療效,且安全性較高。因受到樣本對象來源與數量的限制,本研究缺乏對血清炎癥因子、免疫功能、腫瘤標志物的動態觀察,也未對遠期療效進行比較,可能會對結論造成偏倚,有待于今后擴大樣本作進一步的研究。
[1]Soria JC,Mark Z,Zatloukal P,et al.Randomized phaseⅡstudy of dulanermin in combination with paclitaxel,carboplatin,and bevacizumab in advanced non-small-cell lung cancer[J].J Clin Oncol,2011,29(33):4442-4451.
[2]何曦冉,王權,姜雷,等.康艾聯合順鉑加長春瑞賓化療方案治療非小細胞肺癌的Meta分析[J].現代腫瘤醫學,2011,19(12):2437-2441.
[3]Eisenhauer EA,Therasse P,Boqaerts J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline:version 1.1[J].Eur J Cancer,2009,45(2):228-247.
[4]Kinoshita T,Azuma K,Sasada T,et al.Chemotherapy for non-small cell lung cancer complicated by idiopathic interstitial pneumonia[J].Oncol Lett,2012,4(3):477-482.
[5]張建群.吉西他濱聯合康艾注射液在30例非小細胞肺癌化療中的應用觀察[J].山東醫藥,2013,53(31):87-88.
[6]明海霞,陳彥文,張帆,等.黃芪多糖聯合順鉑處理降低Lewis肺癌移植瘤CD44表達并降低血清Ⅳ型膠原蛋白和透明質酸的水平[J].細胞與分子免疫學雜志,2015,31(7):909-913.
[7]趙曉光,宋明霞,徐潔.康艾注射液聯合單藥化療治療老年晚期非小細胞肺癌臨床療效觀察[J].中國醫師進修雜志,2013,36(s1):139-140.
[8]Sanchez-Lara K,Turcott JG,Juarez E,et al.Association of nutrition parameters including bioelectrical impedance and systemic inflammatory response with quality of life and prognosis in patients with advanced non-small-cell lung cancer:a prospective study[J].Nutr Cancer,2012,64(4):526-534.
[9]孫遠南,陸明榮,倪慧,等.肺癌患者肺部真菌感染應用伏立康唑聯合康艾注射液治療的療效觀察[J].中華醫院感染學雜志,2015,25(23):5377-5379.
[10]郭玉嬌,袁紅宇.康艾注射液聯合化療對非小細胞肺癌療效的Meta分析[J].中國藥房,2012,23(35):3350-3353.
[11]高卓維,曾少容,黃景彬,等.康艾注射液對鼻咽癌患者外周血 T細胞亞群的影響[J].中醫研究,2015,28(7):5-7.
[12]張云,肖艷林,李賢斌.兩種不同化療方案對NSCLC的療效和腫瘤標志物水平的影響及作用機制[J].海南醫學院學報,2015,21(9):1265-1267.
Clinical Observation of Kang’ai Injection Adjuvant Chemotherapy for Advanced Lung Cancer
LU Yanzeng1,TAN Baiqing2,SUN Dongping2,LUO Weixiao2(1.Dept.of Laboratory,Shengli Oil Field Central Hospital,Shandong Dongying 257038,China;2.Shandong Biobase Biological Industry Co.,Ltd.,Jinan 250200,China)
OBJECTIVE:To investigate clinical efficacy and safety of Kang’ai injection adjuvant chemotherapy for advanced lung cancer.METHODS:A total of 146 patients with advanced lung cancer during May 2013-Apr.2014 were divided into observation group and control group according to odd-even admission number,with 73 cases in each group.Control group was given GP(gemcitabine+cisplatin)chemotherapy.Observation group was additionally given Kang’ai injection 60 mL added into normal saline 250 mL,qd,ivgtt,for consecutive 14 d each chemotherapy cycle,on the basis of control group.Both groups were given tropisetron 5 mg for preventing gastrointestinal reaction during chemotherapy.A treatment course lasted for 3 weeks,and both groups were treated for 3 courses.Clinical efficacies of 2 groups were compared;the levels of serum inflammatory factors(hs-CRP,TNF-α,IFN-γ,IL-10),immune function indexes(CD3+,CD4+,CD8+,CD4+/CD8+)and tumor markers(SCC-Ag,CEA,CA50,CA72-4)were compared before and after treatment.The occurrence of ADR were recorded in 2 groups.RESULTS:The response rate and disease control rate of observation group were 39.73%and 84.93%,which were significantly higher than 23.29%and 71.23%of control group,with statistical significance(P<0.05).Before treatment,there was no statistical significance in the levels of serum inflammatory factors,immune function indexes or tumor markers between 2 groups(P>0.05).After treatment,the levels of hs-CRP,TNF-α and IFN-γ in 2 groups were significantly lower than before treatment,while the level of IL-10 was significantly higher than before treatment;above indexes of observation group were significantly better than control group,with statistical significance(P<0.05).The levels of CD4+and CD4+/CD8+in control group were decreased significantly and lower than observation group,with statistical significance(P<0.05).Serum levels of SCC-Ag,CEA,CA50 and CA72-4 in 2 groups were decreased significantly,and observation group was significantly lower than control group,with statistical significance(P<0.05).The incidence of thrombocytopenia,neutropenia,abnormal liver function,nausea and vomiting,anemia in observation group were significantly lower than control group,with statistical significance(P<0.05).CONCLUSIONS:Kang’ai injection adjuvant chemotherapy can effectively relieve inflammation symptoms of patients with advanced lung cancer,reduce toxic reactions,enhance immune function,and improve short-term therapeutic efficacy with good safety.
Advanced lung cancer;Kang’ai injection;Inflammatory factors;Immune function;Tumor markers
R730.5
A
1001-0408(2017)35-4984-04
DOI10.6039/j.issn.1001-0408.2017.35.24
*主管技師。研究方向:臨床體外診斷研究。電話:0546-8551614。E-mail:914438254@qq.com
#通信作者:主任醫師,碩士。研究方向:臨床體外診斷項目開發。電話:0531-58626068。E-mail:tbq@biobase.cn
2017-01-24
2017-09-16)
(編輯:黃 歡)

