自噬在大鼠急性胰腺炎中的變化
蘇濤 劉丕 柯華婧 楊曉娟 李驥
·短篇論著·
自噬在大鼠急性胰腺炎中的變化
蘇濤 劉丕 柯華婧 楊曉娟 李驥
急性胰腺炎(AP)是各種原因引起胰酶激活、以炎癥局部反應為主要特征、伴或不伴有其他器官改變的疾病[1]。目前AP的發病機制仍不是很清楚,臨床治療上難度較大。研究顯示[2],AP時腺泡細胞中有空泡的積累,且大多數空泡為自噬空泡,自噬可能與炎癥反應及細胞的死亡關系密切[3-4]。本研究旨在探討自噬在牛膽酸鈉誘導的大鼠AP發病過程中的變化情況。
一、材料和方法
1.材料:健康清潔雌性SD大鼠54只,體重200~250 g,由南昌大學醫學院動物部提供。其他材料包括LC3B兔多克隆抗體(Abcam公司),p62鼠單克隆抗體(Abcam公司),牛磺膽酸鈉(Sigma公司),二步法兔二抗和鼠二抗(北京中杉金橋生物技術有限公司)。
2.動物分組:將54只大鼠按照隨機分配原則分為假手術組(SO)、急性水腫性胰腺炎(AEP)組、急性壞死性胰腺炎(ANP)組,每組18只。每組再隨機分成3、6、12 h 3個時間點,每時間點6只。
3.大鼠胰腺炎模型的建立和標本的獲取:AEP組采用胰膽管逆行注射1%牛磺膽酸鈉(0.1 ml/100 g體重)、ANP組注射5%牛磺膽酸鈉(0.1 ml/100 g體重)的方法建模,假手術組與模型組相同手術方式,但不注射藥物。每組大鼠分別于術后第3、6、12 h取標本。
4.觀察的指標與檢測:(1)血清淀粉酶:由南昌大學第一附屬醫院檢驗科采用全自動生化儀檢測。(2)胰腺組織病理學:由病理醫師閱片,選取5個高倍視野,采用改良Schmidt評分標準對胰腺的損傷進行評分。(3)超微結構觀察:取各組3 h點的胰腺組織制作電鏡標本,采用JEOL-1200EX透射電鏡觀察,MORADA-G2記錄。隨機選取10個不同的視野,記錄每個視野下自噬體和自噬溶酶體的數量。(4)免疫組織化學染色:組織切片經免疫組織化學染色,隨機觀察5個不重復的高倍視野。免疫組化評分由陽性染色深度評分乘以陽性細胞比率評分得出。
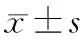
二、結果
1.胰腺組織病理學改變:光鏡下觀察,SO組胰腺無明顯病理變化。AEP 3 h點可見局部葉間隙水腫,少量炎癥細胞浸潤,6、12 h點可見彌漫性葉間隙水腫,小葉分離,腺泡間隙增寬,大量炎癥細胞浸潤,偶見少量出血。ANP組可見灶狀或大片狀壞死,腺泡結構破壞,炎癥細胞及紅細胞浸潤,并隨時間延長而加重。AEP組病理損傷評分較SO組顯著增加,ANP組評分又較AEP組顯著增加,差異均有統計學意義。AEP組6、12 h點評分較3 h點顯著增加(P<0.05),但6、12 h點之間差異無統計學意義。ANP組損傷評分隨時間延長而增加,各時間點差異有統計學意義(P<0.05,表1)。
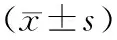
表1 各組不同時間點胰腺組織病理評分
注:與SO組比較,aP<0.05;與AEP組比較,bP<0.05;與3 h AEP組比較,cP<0.05;與6 h ANP組比較,dP<0.05
2.血淀粉酶水平變化:AEP組、ANP組血清淀粉酶水平均較SO組明顯升高。
3.胰腺組織超微結構改變:造模后3 h SO組細胞核核膜較完整,細胞器形態正常,偶見自噬溶酶體和自噬體;AEP組可見線粒體腫脹,并見較多自噬溶酶體和自噬體;ANP組見線粒體腫脹,內膜損傷明顯,并可見較多自噬溶酶體和自噬體。每個電鏡視野AEP組自噬體與自噬溶酶體為(3.90±1.60)個,ANP組為(7.10±2.56)個,均較SO組中(1.40±1.17)個數量增加(P<0.05),ANP組又較AEP組增加(P<0.05,圖1)。
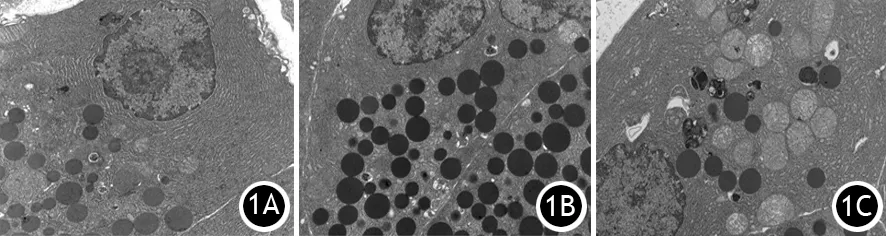
圖1 SO組(1A)、AEP組(1B)、ANP組(1C)自噬體與自噬溶酶體電鏡圖(×15000)
4.胰腺組織LC3B、p62蛋白表達量變化:LC3B蛋白主要表達在腺泡細胞胞質和胰島細胞胞質中,p62蛋白表達在腺泡細胞、胰島細胞胞質。SO組各時間點可見LC3B及p62少量表達,且各時間點之間的差異無統計學意義;AEP組、ANP組LC3B及p62表達均較SO組顯著增強,差異有統計學意義(P值均<0.05)。AEP組6、12 h點LC3B表達較3 h點明顯增加,差異有統計學意義(P<0.05),而6、12 h點LC3B表達及各時間點p62表達的差異無統計學意義。ANP組LC3B表達隨著時間的延長而增加,各時間點的差異有統計學意義(P<0.05,表2,圖2),而各時間點p62表達無明顯變化。
討論自噬是細胞內細胞器以及其他結構的減員和自然更新的途徑,但其功能損傷時可引起一系列的病理反應[5]。自噬過程被ATG基因所調控。LC3是哺乳動物細胞中酵母ATG8基因的同源物,LC3分為Ⅰ(A)型和Ⅱ(B)型。自噬發生時LC3-Ⅰ經過與自噬膜結合合成LC3-Ⅱ。因為LC3-Ⅱ始終結合在自噬體的膜上,所以其含量的多少與自噬體數量的多少呈正比[6-7]。p62(又名SQSTM1)是一種泛素結合蛋白,可與LC3-Ⅱ形成復合物,并將蛋白質轉入自噬溶酶體中,然后被降解。p62水平與自噬的活性呈反比,是檢測自噬活性的一個標志蛋白[8]。通過對LC3檢測可以評價自噬體的數量,對p62檢測可以評估自噬的活性。
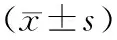
表2 各組LC3B、p62評分
注:與SO組比較,aP<0.05;與AEP組比較,bP<0.05;與3 h AEP組比較,cP<0.05;與6 h ANP組比較,dP<0.05

圖2 SO組(2A),AEP組3、6、12 h(2B、2C、2D),ANP組3、6、12 h(2E、2F、2G)LC3B(上)和p62(下)表達(×200)
本研究結果顯示,AEP組、ANP組與SO組比較,LC3B表達明顯增加,且隨病理損傷的加重而增加,ANP組與AEP比較,LC3B的表達量也明顯增加。此外在電鏡下也發現AEP和ANP組中自噬體和自噬溶酶體數目明顯增多。說明自噬在AP中表達是增強的。
本結果顯示,p62蛋白在SO組未見積累,在AEP組和ANP組p62開始積累,但AEP組和ANP組中各時間點的積累無明顯變化。電鏡下觀察到AEP組和ANP組線粒體腫脹,其中ANP中可見線粒體損傷明顯。既然在AP中自噬是增加的,那么底物蛋白p62也應該不斷的被降解,但結果恰好相反,可以解釋為自噬的降解水平降低了,表明自噬的功能受損。另外Mareninova等[2]同樣發現與饑餓時相比,胰腺炎中自噬的效率減低,使降解受抑制。
本研究的缺陷在于僅僅發現AP中自噬損傷的現象,但自噬損傷的機制并不明確,需要進一步對自噬通路以及自噬與胰酶激活關系進行研究。
[1] 中華醫學會消化病學會胰腺疾病學組.中國急性胰腺炎診治指南(2013,上海)[J].中華胰腺病雜志,2013,13(2):73-78. DOI:10.3760/cma.j.issn.1674-1935.2013.02.001.
[2] Mareninova OA, Hermann K, French SW,et al. Impaired autophagic flux mediates acinar cell vacuole formation and trypsinogen activation in rodent models of acute pancreatitis[J]. J Clin Invest,2009,119(11): 3340-3355. DOI: 10.1172/JCI38674.
[3] 徐冉,魏瓏瓏,李志強.BNIP3在細胞凋亡與自噬中的作用[J].山東醫藥,2013,53(28),105-108.DOI: 10.3969/j.issn.1002-266X.2013.28.041.
[4] Jones SA, Mills KH, Harris J. Autophagy and inflammatory diseases[J]. Immunol Cell Biol.2013,91(3):250-258. DOI: 10.1038/icb.2012.82.
[5] 喻琴琴,楊俊,李馨欣.自噬及其抑制劑的研究進展[J].實用醫學雜志,2013,17(29):417-419.DOI: 10.3969/j.issn.1006-5725.2013.17.053.
[6] Tanida I.Autophagosome formation and molecular mechanism of autophagy[J]. Antioxid Redox Signal, 2011,14(11): 2201-2214. DOI: 10.1089/ars.2010.3482.
[7] Wild P, Mcewan DG, Dikic I. The LC3 interactome at a glance[J]. J CellSci, 2014, 127(Pt 1): 3-9. DOI: 10.1242/jcs.140426.
[8] Yao TP. The role of ubiquitin in autophagy-dependent protein aggregate processing[J]. Genes Cancer, 2011,1(7) :779-786.DOI:10.1177/1947601910383277.
10.3760/cma.j.issn.1674-1935.2017.06.011
國家自然基金項目(81560112)
518172 廣東深圳,深圳市龍崗區人民醫院消化科(蘇濤);南昌大學第一附屬醫院(蘇濤、劉丕、柯華婧、楊曉娟、李驥)
劉丕,Email:liupi1974@sina.com
2016-08-15)
冀凱宏)

