試論守恒法在高中化學解題中的應用分析
陳惠澤
(山東省青島市開發區第一中學高三十三班 266555)
試論守恒法在高中化學解題中的應用分析
陳惠澤
(山東省青島市開發區第一中學高三十三班 266555)
守恒法為高中化學中應用較為廣泛的方法,在化學學科的知識架構中也存在多種形式的守恒關系,應用守恒法進行化學解題,便是遵循物質在其變化過程中某一特定的物質定量不會發生改變的規律來解決實際應用問題,通過對守恒法在高中化學解題中的應用進行深入探討,分析各種守恒法在解題過程中的具體應用方式,旨在促進對守恒法的靈活應用,促進解題效率的提升.
守恒法;應用;高中化學
在化學的知識世界中,物質隨時都會發生各種形式的演化和變化,但是在其變化過程中卻會遵循一定的變化規律,物質參與化學反應,其化合價的變化總數、質量變化總數或者原子總數、電荷總數都會遵循守恒規律,遵循各種守恒規律,進行化學解題計算,能夠快速的發掘提煉題目中存在的等量關系,進而找到解題思路,有效提升解題效率.
一、元素守恒
元素守恒是指在化學反應前后,發生反應的各元素的種類不變,原子個數不變,質量不變,物質的量也不變.元素守恒有兩種類型,一是離子守恒,即非氧化還原反應前后的離子數不變,二是原子守恒,即反應前后原子的種類、個數不變.根據元素守恒的原理來推導和解決問題時,不需要考慮化學反應式,而是只要找到在反應開始和終止時的離子的對應關系,就可以迅速準確地計算出結果.
例1 將0.8mol的二氧化碳完全通入1L1mol/L的氫氧化鈉溶液中,在充分反應后,溶液中碳酸氫鈉和碳酸鈉的物質的量的比為( )
A.3∶1B.1∶3C.1∶1D.2∶1
分析如果按照一般解題方式計算,就需要寫出關于此反應的兩個反應化學的方程式并求解,計算過程較為繁瑣,而如果應用元素守恒法來分析,因為反應前后原子的種類、個數都不會發生改變,所以在此反應中,碳原子和鈉離子守恒.可以假設碳酸氫納和碳酸鈉的物質的量分別為xmol,ymol,則根據鈉離子守恒可得x+2y=1mol,根據碳原子守恒可得x+y=0.8mol.解這兩個方程可得x=0.6,y=0.2.由此可得x∶y=3∶1,即碳酸氫鈉和碳酸鈉的物質的量的比為3∶1.故選A.
二、質量守恒
質量守恒是指在與周圍隔絕的物質系統中,不管發生什么樣的化學反應變化過程,在化學反應前后的反應物的總質量與生成物的質量始終保持不變,這也包括在配制或稀釋溶液的過程中,溶質的質量不變.
例2 碳酸氫銨在150℃時完全分解,產生氣態混合物,該混合物密度在相同條件下是氫氣密度的( )
A.32倍B.96倍C.48倍D.13倍

三、物質的量守恒
物質的量守恒是指在化學反應前后的原子總量不變.適用于在多步反應的化學問題的推導和計算,應用該方法可以有效簡化運算步驟,減少計算程序,快速得出計算結果.
例3 現有一定質量的氫氧化鉀樣本固體暴露在空氣中,已知該氫氧化鉀樣本固體中含有2.8%的水、7.2%的碳酸鉀.稱取1g該樣本固體置入50mL鹽酸中,鹽酸的濃度為3mol/L,又用了30.8mL的濃度為1.07mol/L的氫氧化鉀溶液來中和多余的鹽酸,并將中和后的溶液加熱蒸干,則所得固體的質量為( )
A.6gB.8.45gC.4.5gD.11.175g
分析本題化學反應復雜,數字處理繁瑣,若按照一般的解法按部就班地計算結果,將會顯得解題過程非常復雜.對已知條件進行細致分析可知最終所得固體為氯化鉀,而且其中的氫元素全部來自于鹽酸,因此根據物質的量守恒可知:n(KCl)=n(HCl)=3mol/L×0.05L=0.15mol,所以m(KCl)=74.5g/mol×0.15mol=11.175g.故選D.
例4 在高溫條件下,將0.8g鐵的氧化物使用足量的一氧化碳進行還原,將反應生產的二氧化碳氣體全部通入到澄清石灰水中,從而得到1.5g的固體沉淀物,則這種鐵的氧化物的化學式為( )
A.Fe4O6B.Fe3O4C.Fe2O3D.FeO
分析在題目所描述的化學反應中,鐵的氧化物中的氧原子最終全部轉移到了固體沉淀物碳酸鈣中,即n(O)=n(CO2)=n(CaCO3)=0.015mol,則m(O)=16g/mol×0.015mol=0.24g,所以m(Fe)=0.8g-0.24g=0.56g,因此n(Fe)=0.01mol,故n(Fe)∶n(O)=2∶3.因此這種鐵的氧化物為Fe2O3.故選C.
四、電子得失守恒
電子得失守恒是指在氧化還原反應中,還原劑失去的電子數等于氧化劑得到的電子數.這種守恒還存在于原電池或電解池中.電子得失守恒在氧化還原反應問題及電解產物的計算中被廣泛應用,意義重大.
例5 已知20mL的濃度為0.02mol/L的K2Cr2O7溶液,恰好可以與24mL濃度為0.05mol/L的Na2SO3溶液完全反應,則Cr在被還原的產物中的化合價為( )
A.+6B.0C.+2D.+3
分析題目要求的是Cr被還原的產物,因此失電子的物質必定是Na2SO3,得電子的物質必定是K2Cr2O7,其中,S的化合價從+4變為+6,Cr的化合價由+6變為+n(假設Cr在被還原的產物中的化合價為n).則有:
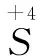
0.05×24×2 = 0.02×20×(6-n)×2
解得n=+3,故選D.
五、電荷守恒
電荷守恒是指對任一電中性體系,如混合物、濁液、化合物等,電荷的代數和為0,也就是說正電荷總數與負電荷總數相等.該守恒利用了化學反應前后離子所帶電荷總量不變的原理.利用該電荷守恒可以推導溶液中離子濃度關系,并計算有關反應中某些量.
例6 已知某混合溶液中所含離子的濃度(單位:mol/L)如下表所示:

所含離子H+Na+SO2-4Mn+NO-3濃度211a3
則Mn+及a的值可能是( )
A.Al3+、0.5B.Fe2+、2
C.Mg2+、1D.Ba2+、0.5

在使用守恒法解題時,必須明確每一種守恒方法的特點和適用范圍,同時必須研究挖掘題目中存在的守恒關系,由此巧妙選擇合適的解題方法:
(1)在某些復雜多步的化學反應中,某些元素的濃度和質量沒有發生變化,此時可以選用元素守恒法.
(2)在涉及與質量有關的題目中,可以選擇質量守恒.
(3)在涉及氧化還原反應中還原劑、氧化劑得失電子及化合價變化問題中,可以選用電子得失守恒法.
(4)在溶液中存在離子守恒,因此涉及溶液中離子問題中,可以考慮電荷守恒法和元素守恒法.
化學世界中的物質無時無刻不在進行著變化,但是在這個變化的過程中卻存在一個永恒的主題,那就是物質守恒定律.守恒法的實質是抓住物質變化過程中某一不變的量,正確分析題目已知條件中的隱藏關系及各量之間的聯系,從紛繁復雜的解題背景中找到簡單快捷的解題思路,以不變應萬變,從而順利解決問題.在高中化學解題中,如果能夠靈活巧妙地使用守恒法,將使復雜問題簡單化、抽象問題具體化,既可以簡化解題步驟,免去一些復雜的數學計算,只需考慮變化過程前后某些相互作用的量的始態和終態,較大程度地提高了解題的準確率,提高了解題速度,又可以培養靈活機變的創造性思維,培養創新精神,在這個高速發展的現代化社會中成長為高素質的優秀人才,取得事半功倍的學習效果,一舉數得,意義重大.
[1] 彭明永.守恒法在高中化學解題中的應用探析[J].中學生數理化:學研版,2016(5):67.
[2] 王佩文.高中化學解題中守恒法的應用與解題思路[J].課程教育研究,2016(27):247-248.
[3] 周建發.淺談守恒法在高中化學解題中的應用[J].數理化學習:高一二版,2016(11):57,61.
G632
A
1008-0333(2017)31-0083-02
2017-07-01
陳惠澤(2000.03-),女,山東青島人,山東省青島市開發區第一中學,高中在讀.
季春陽]

