新瓊四糖通過改善腸道微環境對力竭運動小鼠脂質代謝的影響
李 晶,張 娜,宋 佳,毛相朝,薛長湖,唐慶娟*
(中國海洋大學食品科學與工程學院,山東 青島 266003)
新瓊四糖通過改善腸道微環境對力竭運動小鼠脂質代謝的影響
李 晶,張 娜,宋 佳,毛相朝,薛長湖,唐慶娟*
(中國海洋大學食品科學與工程學院,山東 青島 266003)
目的:研究新瓊四糖對力竭運動所致脂質代謝紊亂的調節作用。方法:采用BALB/C雄性小鼠,并將其隨機分為3 組,即正常組、力竭運動組和新瓊四糖干預組。本研究采用小鼠轉輪式疲勞儀力竭運動模型,力竭運動組和新瓊四糖組小鼠給予力竭運動干預,而正常組保持正常活動。連續喂養16 d后,測定血清血脂指標并無菌收集小鼠糞便,進行腸道菌群的宏基因組分析。結果顯示:力竭運動導致小鼠脂質代謝紊亂,血清總膽固醇、低密度脂蛋白膽固醇和高密度脂蛋白膽固醇水平顯著升高(P<0.05),而甘油三酯水平顯著降低(P<0.05)。同時,新瓊四糖能顯著改變力竭運動小鼠腸道菌群結構以及菌群功能。總之,新瓊四糖可靶向調節腸道菌群結構,改善腸道菌群脂質代謝通路,調控脂肪酸氧化和脂質合成相關酶,進而緩解力竭運動導致的脂質代謝紊亂。
新瓊四糖;力竭運動;脂質代謝紊亂;腸道菌群;宏基因組
新瓊寡糖是一種以β-D-半乳糖殘基為還原性末端,以3,6內醚-α-L-半乳糖殘基為非還原性末端的寡糖,是瓊膠/瓊脂糖經瓊膠酶水解的產物[1-3]。其作為一種新的益生元,已成為國內外研究熱點。實驗室前期通過從海藻中提取瓊膠酶基因,在大腸桿菌中重組表達瓊膠酶,以瓊膠為底物,成功制備新瓊四糖。作為海洋來源的新瓊四糖,其生物活性和功能都有待探索。
宏基因組學通過直接從樣品中提取全部微生物的DNA,構建宏基因組文庫,利用基因組學的研究策略研究環境樣品所包含的全部微生物的遺傳組成及其群落功能[4]。利用宏基因組學可以全面分析微生物組成及功能的特點,可以將其應用到對一類物質生物活性的預測上。京都基因與基因組百科全書(Kyoto encyclopedia of genes and genomes,KEGG)以基因組信息和化學物質信息為構建模塊,通過代謝網絡將基因組和生物系統聯系起來,然后根據功能等級進行歸納分類。KEGG還為各種組學研究提供相關軟件,用于代謝途徑重建、遺傳分析和化合物比對。宏基因組學通常與KEGG相結合,能夠成功預測生物活性物質的功能[5-9]。
合理、適度的運動鍛煉能夠增強機體的免疫力,而力竭、缺氧等極端條件下的運動通常伴隨著多種疾病的發生。在劇烈運動中,機體器官受損,如肝細胞凋亡、心肌損傷、腎臟機能減退以及胃腸道的氧化損傷[10-12],同時伴有機體代謝紊亂。因此,本研究選用力竭運動模型,運用宏基因組學,對實驗室前期制備出的新瓊四糖的生物活性進行預測。豐富新瓊四糖的生物活性研究,為挖掘新瓊四糖的新用途提供實驗依據。
1 材料與方法
1.1 動物、材料與試劑
健康雄性BALB/C小鼠,4~6 周齡,18~22 g,SPF級(許可證號:SCXK(京)2012-0001),購自北京維通利華實驗動物技術有限公司。
新瓊四糖來源于實驗室自制瓊脂糖。通過從威海海岸的海藻中篩選出菌株Agarivorans gilvus WH0801,提取得到瓊膠酶基因,其所編碼的瓊膠酶agWH50A屬于糖苷水解酶GH50家族。將瓊膠酶基因與質粒pET-21(a+)構建重組表達載體,轉化至大腸桿菌BL21,實現了瓊膠酶基因的重組原核表達,制備了重組酶。重組瓊膠酶agWH50A和0.2%低熔點瓊脂糖混合,加入50 mmol/L KH2PO4-NaOH緩沖液(pH 6.0),于30 ℃孵育,降解瓊脂糖得到新瓊四糖[9]。
總膽固醇(total cholesterol,TC)測定試劑盒、總甘油三酯(total triglycerides,TG)測定試劑盒、高密度脂蛋白膽固醇(high density lipoprotein-cholesterol,HDL-C)測定試劑盒、低密度脂蛋白膽固醇(low density lipoprotein-cholesterol,LDL-C)測定試劑盒 南京建成生物工程研究所;Mg-Mk磁珠法細菌DNA抽提試劑盒生工生物工程(上海)股份有限公司;Agencourt Ampure XP beat kit核酸純化試劑盒 美國貝克曼庫爾特公司;TruSeq?DNA PCR-Free Sample Preparation Kit建庫試劑盒美國Illumina公司。
1.2 儀器與設備
BioAnalyzer 2000 美國Agilent公司;Nanodrop 2000C分光光度計 美國Thermo Scientific公司;QUANTIFLUOR?熒光計儀 美國Promega公司;iQ5型Real Time聚合酶鏈式反應(polymerase chain reaction,PCR)儀 美國Bio-Rad公司;Miseq測序平臺 美國Illumina公司;YLS-10B小鼠轉輪式疲勞儀 山東醫學科學院。
1.3 方法
1.3.1 力竭運動小鼠模型建立
BALB/C小鼠適應性喂養1 周,按體質量隨機分為3 組,每組8 只,即正常組(Control)、力竭運動組(Motion)、新瓊四糖組(NAT)。自由攝食小鼠標準維持飼料AIN-93M。室內溫度21~24 ℃,相對濕度40%~55%,空氣流通,光照時間12 h。
以BALB/C小鼠為實驗對象,Control組不做力竭運動干預,灌胃200 μL生理鹽水;Motion組進行力竭運動——利用小鼠轉輪式疲勞儀給予2.5 h力竭運動,轉速20 r/min,連續運動2 d,間歇5 d,持續16 d,同時灌胃200 μL生理鹽水;NAT組進行相同的力竭運動計劃,同時灌胃200 μL的150 mg/kg新瓊四糖,研究新瓊四糖對力竭運動小鼠脂質代謝的影響。
1.3.2 血清脂質水平的測定
取10 μL小鼠血清,按照試劑盒說明書對血清TG、TC、LDL-C和HDL-C水平進行測定。
1.3.3 糞便細菌基因組DNA提取
將糞便樣品準確稱質量,按照每0.1 g小鼠糞便加入1 mL 0.01 mol/L磷酸鹽緩沖液(phosphate buffered saline,PBS)的比例添加相對應體積的PBS,使用無菌槍頭反復攪拌搗碎,之后使用漩渦振蕩混合均勻。將均勻的糞便混合樣于室溫條件下1 500 r/min離心5 min后棄去沉淀,所得液體即為菌體懸浮液。將菌體懸浮液在室溫下10 000 r/min離心3 min,棄去上清液,收集沉淀即初步得到菌體。再用1 mL 0.01mol/L PBS洗滌菌體2~3 次,無菌水1 mL洗滌1~2 次,室溫條件下10 000 r/min離心3 min,棄去上清液,獲得最終菌體沉淀。采用試劑盒提取沉淀中的腸道細菌總DNA。
1.3.4 DNA樣品質量檢測
取1.0~1.5 μL DNA樣品于Nanodrop 2000C分光光度計進行DNA質量濃度的測定。統計DNA的質量濃度、OD260nm/OD280nm和OD260nm/OD230nm。
1.3.5 PCR擴增及產物純化
以提取的糞便DNA為模板,采用細菌16S PCR引物341/357F(5’-NNNNCCTACGGGNGGCWGCAG-3’)和805/785R(5’-GACTACHVGGGTATCTAATCC-3’)擴增16S rRNA的V1~V3高變區序列。PCR擴增體系(50 μL)為:Taq DNA聚合酶2.5 U、引物200 nmol/L、dNTP 200 nmol/L、60 mmol/L Tris-SO4、18 mmol/L(NH4)2SO4、2.0 mmol/L MgSO4、1%甘油、100 ng/μL牛血清白蛋白、模板DNA 10 ng,補ddH2O至50 μL。擴增程序為:95 ℃預變性2 min;95 ℃變性30 s、60 ℃復性30 s、72 ℃延伸6 s,20 個循環。所得PCR產物采用Agencourt Ampure XP beat kit核酸純化試劑盒純化回收,具體步驟參考試劑盒說明書。
1.3.6 文庫構建和序列測定
純化后的擴增產物根據質量濃度進行等量混合。使用TruSeq?DNA PCR-Free Sample Preparation Kit建庫試劑盒進行文庫構建,構建好的文庫用BioAnalyzer Highsensitivity DNA chip kit定量,文庫合格后,使用Miseq 測序平臺進行上機測序。
1.3.7 測序數據分析
采用MiSeq控制軟件MCS 2.4.1進行數據的預處理。FastQC 0.11.2軟件進行測序原始數據的質量控制。隨后雙端讀長的序列經PandaSeq 2.8軟件拼接成Contigs。QIIME pipeline 1.9.1軟件用來分析16S rRNA基因序列。使用PyNAST 1.2.2軟件與GreenGene數據庫中的數據信息進行快速多序列比對進行物種注釋分析,并分別在各個分類水平(界、門、綱、目、科、屬、種)統計各樣本的群落組成。采用LEfSe algorithm計算操作分類單元(operational taxonomic units,OTU)的相對豐度。采用PICRUSt 1.0.0軟件進行菌群的功能預測以及KEGG信號通路的注釋[8]。
1.4 數據統計分析
各組小鼠DNA濃度實驗數據以 ±s表示,采用SPSS 11.5統計軟件進行單因素方差統計學分析(One-way ANOVA),以P<0.05表示差異有統計學意義。
2 結果與分析
2.1 新瓊四糖對菌群結構的影響
2.1.1 樣品復雜度分析
2.1.1.1 樣品中微生物的Rank-abundance曲線
Rank-abundance曲線反映單個或整體樣品中每個OTU按豐度(包含的序列數目)由大到小,再以OTUs的排序編號為橫坐標,OTUs中的豐度(也可用該等級OTUs中序列數的相對比例)為縱坐標繪制的曲線圖。Rank-abundance曲線可直觀地呈現樣品中包含的OTUs的豐富度和均勻度。在水平方向,物種的豐度由曲線的寬度來反映,物種的豐富度越高,曲線在橫軸上的范圍越大;曲線的形狀(平滑程度)反映了樣品中物種的均勻度,曲線越平滑,物種分布越均勻。

圖1 微生物的豐度曲線Fig. 1 Rank-abundance distribution curves of microbiota
使用QIIME軟件,根據各樣品的豐度大小排序繪制了Rank-abundance曲線(圖1)。橫坐標為OTUs豐度排序的序號(OTUs rank),縱坐標為對應的OTUs相對豐度,不同的樣品使用不同灰度的曲線表示。從圖1中可看出,大部分樣本曲線水平方向較寬和平緩,說明所有樣品所含物種的豐富程度和均勻程度較合理。OTUs是在相對豐度10-3或以下時達到平臺期。
2.1.1.2 樣品中微生物的稀釋曲線
稀釋曲線用來評價測序量是否足以覆蓋所有微生物物種,并間接反映樣品中物種的豐富程度。當曲線趨于平緩或者達到平臺期時也就可以認為測序深度已經基本覆蓋到樣品中所有物種;反之,則表示樣品中物種多樣性較高,還存在較多未被測序檢測到的物種。
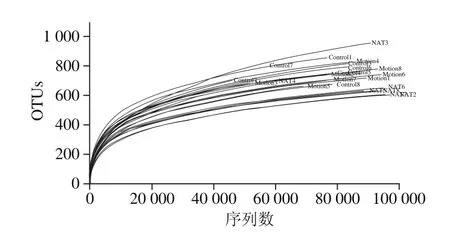
圖2 微生物稀釋曲線Fig. 2 Rarefaction curves of microbiota
如圖2所示,隨測序量的不斷增加,各樣品的稀釋曲線趨于平緩。曲線在序列數目20 000左右時出現拐點,后續隨著測序深度不斷增加(序列數目升高),曲線均呈趨于平緩,當序列數達60 000條時,已經處于平臺期。本研究中平均每個樣本測序量均在60 000 條以上,結合曲線的走勢可以說明各樣品稀釋曲線證實測序量足夠,可以覆蓋所有細菌物種。
2.1.2 多樣品比較分析
Beta多樣性表示不同樣品在微生物群落構成上的比較。將不同樣品中屬于同一物種的Reads數量匯總在同一表格中,生成物種豐度信息表,用于計算unweighted unifra,來表征Beta多樣性。計算unweighted unifra得到的矩陣,進一步用于多樣性分析(principal coordinate analysis,PCoA)。PCoA是一種從復雜的多維變量數據中提取主要變量,并進行可視化的方法。與主成分分析(principal component analysis,PCA)的主要思想類似,PCoA的目的也是找到一個矩陣中的主要的一些坐標系。

圖3 微生物的PCoA分析Fig. 3 PCoA analysis of microbiota
如圖3所示,橫坐標表示一個主成分,縱坐標表示另一個主成分,百分比表示主成分對樣品差異的貢獻值;圖中的每個點表示一個樣品。由圖3可知,PC1為第一主坐標,對總體菌群的代表性的貢獻率為20.38%,雖然組內聚集程度(特別是Motion組)并不理想(可能是個體差異引起),但所有樣品可以大致分開。從整體趨勢看,Control組聚集在第一和第三象限,NAT組集中在第二象限,Motion組集中在第四象限。
2.1.3 菌群結構變化分析
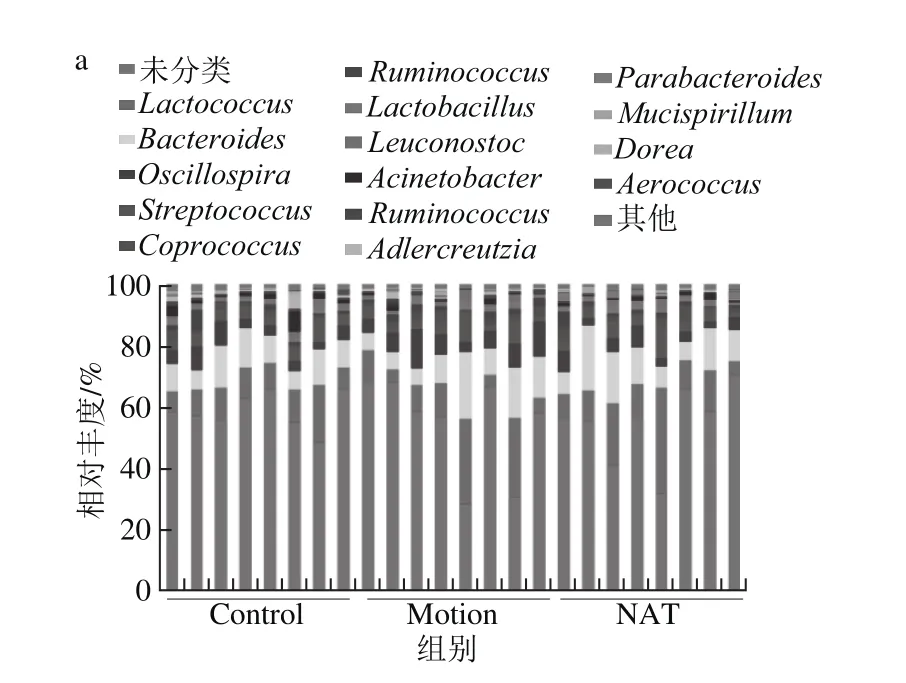
本研究在屬水平上對小鼠腸道菌群結構進行了分析。如圖4a所示,新瓊四糖對力竭運動導致的菌群結構具有一定的調節作用。其中,乳球菌屬(Lactococcus)和擬桿菌屬(Bacteroides)變化最為明顯。由圖4b中可以得知,力竭運動導致乳球菌屬由10.39%增加為27.7%,而新瓊四糖干預后下降到10.20%。乳球菌屬的主要代謝產物為乳酸,說明力竭運動會導致血乳酸含量升高。另外,力竭運動導致擬桿菌屬由12.80%上升到22.11%,而新瓊四糖干預后降低到21.37%。
腸道菌群作為人體的“第二器官”以及“第二基因組”,可以通過調控機體新陳代謝相關基因的表達,進而改變機體能量代謝,改善機體機能[14-15]。由對小鼠體內腸道菌群結構進行研究發現,力竭運動后影響較大的菌群均與脂質代謝有關,由此進一步研究力竭運動是否會導致小鼠機體脂質代謝紊亂,同時研究新瓊四糖是否可以緩解紊亂癥狀。
2.2 新瓊四糖對力竭運動小鼠腸道菌群功能的調節作用
現有的研究表明了腸道菌群與宿主代謝之間復雜的聯系,腸道菌群可以通過調節脂質代謝來發揮對機體的作用,例如高脂飲食誘導的代謝性疾病,可通過低聚果糖等益生元進行腸道菌群調節[16-18]。由前兩部分研究結果發現:1)新瓊四糖能緩解力竭運動導致的脂質代謝紊亂;2)新瓊四糖能夠調節力竭運動導致的菌群失調。因此,推測新瓊四糖可能通過調節腸道菌群緩解脂質代謝紊亂。為了闡明腸道菌群調節脂質代謝的機理,本研究開展了腸道菌群的基因功能注釋,并與KEGG數據庫進行比對。

圖5 新瓊四糖對腸道菌群脂質代謝通路的影響Fig. 5 Effect of NAT on lipid metabolism pathway of microbiota
本研究針對目前已知的15 種脂質代謝途徑進行檢測,在開展了腸道菌群的基因功能注釋,并與KEGG數據庫進行比對后,得出與脂質代謝通路有關的菌的相對豐度,結果如圖5所示。新瓊四糖能顯著提高脂質代謝(P<0.01)、花生四烯酸代謝(P<0.05)、亞油酸代謝(P<0.01),并且顯著抑制酮體合成(P<0.05)。
花生四烯酸是合成前列腺素、血栓烷素和白細胞三烯等二十碳衍生物的直接前體[19],這些生物活性物質可以有效地提高人體心血管系統及免疫系統的功能,對機體具有十分重要的作用。亞油酸是公認的一種必需脂肪酸。經研究發現,亞油酸具有降低血液膽固醇,預防動脈粥樣硬化的功效,因而倍受重視[20]。在脂肪酸分解的過程中,酮體作為一種中間代謝產物,在肝臟中大量產生,是運動時肝臟快速輸出脂肪酸供能的一種形式,在調節體內燃料平衡方面起重要作用。但同時酮體含量升高,常引發代謝性酸中毒[21]。
綜上所述,新瓊四糖可能通過調節花生四烯酸以及亞油酸代謝,降低血液膽固醇,預防動脈粥樣硬化,降低機體心血管疾病的風險;同時,調節酮體水平既能為機體供能又能防止因酮體含量過高引起的代謝性酸中毒。
2.3 新瓊四糖對力竭運動小鼠腸道菌群脂肪酸氧化和脂質合成相關酶的調控


圖6 新瓊四糖對腸道菌群脂質代謝通路的影響Fig. 6 Effect of NAT on lipid metabolism pathway of microbiota
研究證實,腸道微生物調控脂質代謝主要通過對脂質合成、脂肪酸氧化、膽汁酸功能和腸道內分泌功能的調控來實現[22-23];因此,本研究對腸道菌群脂肪酸氧化和脂質合成相關酶進行了檢測。圖6為在開展了腸道菌群的基因功能注釋,并與KEGG數據庫進行比對后,得出分泌與機體脂肪酸氧化和脂質合成酶有關的菌的相對豐度。新瓊四糖能有效調控脂肪酸氧化以及脂質合成相關酶。其中,Motion組相比于Control組,硫辛酸合成酶(K03644)以及磷脂酶A1(K01058)、三酰甘油酯酶(K01046)、月桂酰基轉移酶(K02517)、乙酰輔酶A脫氫酶(K06446)的表達量降低,長鏈脂肪酸脂肪酶(K05939)表達升高,而NAT組相比于Motion組,硫辛酸合成酶(K03644)以及磷脂酶A1(K01058)、三酰甘油酯酶(K01046)、月桂酰基轉移酶(K02517)、乙酰輔酶A脫氫酶(K06446)的表達量升高(P<0.05),長鏈脂肪酸脂肪酶(K05939)表達降低(P<0.01)。
有報道稱,硫辛酸能有效地調節體內糖脂代謝,抑制糖尿病及其并發癥的發生[24]。而磷脂酶A1可以催化降解脂質中的磷脂,產生脂肪酸,因此磷脂酶A1的表達增加,可以加速脂質的分解代謝,減少脂肪堆積[25]。此外脂肪酶即三酰甘油酰基水解酶,它可催化天然底物油脂水解,作用于甘油三酯的酯鍵,使甘油三酯降解為甘油二酯、單甘油酯、甘油和脂肪酸,脂肪酸再經過一系列酶的作用轉移到肝臟中。長鏈脂肪酸脂肪酶可以催化脂肪酸氧化,脂肪酸的氧化是動物體內脂肪酸分解的途徑,也是脂質代謝的重要環節[26]。這表明新瓊四糖灌胃干預可以有效地緩解力竭運動造成的小鼠脂質代謝紊亂的情況,降低脂肪分解速率和脂肪酸氧化程度,抑制脂質代謝。
該結果證明了前面的假設:新瓊四糖可通過改變腸道菌群脂質代謝相關酶的活性,調控菌群脂質代謝功能,進而緩解力竭運動導致的脂質代謝紊亂。
2.4 新瓊四糖對力竭運動小鼠脂代謝紊亂的緩解作用

表1 血清中脂代謝相關指標水平Table 1 Effect of NAT on serum lipoprotein metabolism in mice under exhaustive exercise
在前面研究中,基于16S基因組結果,預測出新瓊四糖這一種益生元可以通過調節腸道菌群結構,改變機體脂質代謝通路,改善機體因力竭運動造成的代謝紊亂。
現有報道指出,血脂水平異常是脂質代謝紊亂的最顯著的指標之一。TC與冠心病、動脈粥樣硬化發病率呈正相關。甘油三酯是人體內含量最多的脂類,大部分組織均可以利用甘油三酯分解產物供給能量,同時肝臟、脂肪等組織還可以進行甘油三酯的合成,在脂肪組織中儲存。LDL可以運載膽固醇進入組織細胞,同時可被氧化成氧化LDL。當LDL過量時,它攜帶的膽固醇便積存在動脈壁上,引起動脈粥樣硬化,增加機體負擔。HDL是一種抗動脈粥樣硬化的血漿脂蛋白,是冠心病的保護因子,俗稱“血管清道夫”[27-30]。但是HDL含量要控制在一定的范圍內,否則就可能暗示著其他疾病的存在。膽汁淤積性肝硬化、慢性肝炎、肝硬化、酒精中毒性肝損傷、脂肪肝等疾病均可導致HDL-C含量升高[31-34]。
因而針對血清中TC、TG、HDL-C、LDL-C含量進行檢測,驗證新瓊四糖可以調節機體脂質代謝。
由表1可以得出,相比于Control組,Motion組血清中TC以及HDL-C含量升高,并且LDL-C含量也呈現升高趨勢。相比于Motion組,NAT組的血清中TC、HDL-C以及LDL-C含量降低。從血清中指標檢測結果可以看出,力竭運動造模后,機體血清中膽固醇含量、HDL-C、LDL-C含量升高,可見力竭運動可以造成機體脂質代謝紊亂。隨后研究發現,經過新瓊四糖灌胃干預,機體膽固醇含量有所下降,表示在灌胃干預后,機體脂代謝紊亂有所改善。
3 討 論
益生元物質的開發利用已成為當前研究熱點,益生元被認為具有提高機體免疫力、降低疾病發生率、緩解機體器官損傷等功效。力竭運動通常伴隨著多種疾病的發生,同時伴有機體代謝紊亂。新瓊四糖作為一種多糖成分,在機體中可以到達結腸與菌群作用,所以本實驗要驗證新瓊四糖這種新型的益生元是否可以通過調節腸道菌群結構來達到緩解機體脂質代謝的效果。
本研究利用宏基因組測序方法詳細解析腸道菌群結構,深入研究菌群的功能以及菌群產生酶,對新瓊四糖這一益生元進行功能預測,發現新瓊四糖對力竭運動所致脂質代謝紊亂具有調節作用,并通過對血清中指標檢測進行驗證。研究結果表明,新瓊四糖可以通過調節腸道菌群結構,其中乳球菌屬(Lactococcus)和擬桿菌屬(Bacteroides)變化最為明顯,調控脂肪代謝相關酶的表達,此外檢測得知血清中TC、LDL-C和HDL-C水平顯著升高(P<0.05),TG水平顯著降低(P<0.05)。本研究證實,新瓊四糖可通過調節腸道菌群結構,保護腸道菌群脂質代謝通路,調控脂肪酸氧化和脂質合成相關酶,進而緩解力竭運動導致的脂質代謝紊亂。
綜上,本研究利用宏基因組測序方法,成功預測新瓊四糖靶向腸道微生態調控機體脂質代謝的功效,為緩解運動性疲勞提供了新思路,也為新瓊四糖作為益生元的實際生產應用提供了理論依據。
[1] 郭曉鳳. 新瓊寡糖的益生元作用研究[D]. 青島: 中國海洋大學,2014: 6-8.
[2] 劉美英, 梅建鳳, 易喻, 等. 瓊膠寡糖生物活性的研究進展[J]. 藥物生物技術, 2008, 15(6): 493-496.
[3] 劉剛. 瓊膠寡糖的制備及生物活性研究[D]. 上海: 上海海洋大學,2010: 12-16.
[4] 賀紀正, 張麗梅, 沈菊培, 等. 宏基因組學(Metagenomics)的研究現狀和發展趨勢[J]. 環境科學學報, 2008, 28(2): 209-218.DOI:10.13671/j .hjkxxb .2008.02.001.
[5] BACKES C, MEESE E, LENHOF H P, et al. A dictionary on microRNAs and their putative target pathways[J]. Nucleic Acids Research, 2010, 38(13): 4476-4486. DOI:10.1093/nar/gkq167.
[6] 韓增葉, 田平芳. KEGG數據庫在生物合成研究中的應用[J].生物技術通報, 2011(1): 76-82. DOI:10.13560/j.cnki.biotech.bull.1985.2011.01.007.
[7] KANEHISA M, GOTO S. KEGG: Kyoto encyclopedia of genes and genomes[J].Nucleic Acids Research, 2000, 28(1): 27-30. DOI:10.1093/nar/28.1.27.
[8] FAUST K, CROES D, HELDEN J V. Metabolic pathfinding using RPAIR annotation[J]. Journal of Molecular Biology, 2009, 388(2):390-414. DOI:10.1016/j.jmb.2009.03.006.
[9] KANEHISA M, GOTO S, SATO Y, et al. KEGG for integration and interpretation of large-scale molecular data sets[J]. Nucleic Acids Research, 2012, 40: 109-114. DOI:10.1093/nar/gkr988.
[10] 熊延連, 熊艷蕾, 李遙金, 等. 大鼠力竭運動誘導的氧化應激損傷對紅細胞變形性的影響[J]. 中國應用生理學雜志, 2014, 30(4):289-293. DOI:10.13459/j.cnki.cjap.2014.04.001.
[11] 王福文, 趙敬國, 王燕, 等. 力竭性運動后大鼠血清CK, CK-MB活性和心肌組織形態學的動態改變[J]. 中國應用生理學雜志, 2011,27(1): 52-55. DOI:10.13459/j.cnki.cjap.2011.01.024.
[12] HUANG C C, LIN T J, CHEN C C, et al. Endurance training accelerates exhaustive exercise-induced mitochondrial DNA deletion and apoptosis of left centricle myocardium in rats[J]European Journal of Applied Physiology, 2009, 107(6): 697-706. DOI:10.1007/s00421-009-1177-4.
[13] LIU N, MAO X Z, DU Z J, et al. Cloning and characterisation of a novel neoagarotetraose-forming-β-agarase, AgWH50A from Agarivorans gilvus WH0801[J]. Carbohydrate Research, 2014, 388:147-151. DOI:10.1016/j.carres.2014.02.019.
[14] QIN J, LI R, RAES J, et al. A human gut microbial gene catalogue established by metagenomic sequencing[J]. Nature, 2010, 464: 59-65.DOI:10.1038/nature08821.
[15] GILL S R, POP M, DEBOY R T, et al. Metagenomic analysis of the human distal gut microbiome[J]. Science, 2006, 312: 1355-1359.DOI:10.1126/science.1124234.
[16] FUSTER V, VOUTE J, HUNN M, et al. Low priority of cardiovascular and chronic diseases on the global health agenda: a cause for concern[J]. Circulation, 2007, 116(17): 1966-1970. DOI:10.1161/CIRCULATIONAHA.107.733444.
[17] 易安妮, 張慧曄, 劉賓, 等. 益生元對抗生素引起的腸道菌群失調的作用[J]. 中國微生態學雜志, 2012, 24(4): 318-320. DOI:10.13381/j.cnki.cjm.2012.04.032.
[18] FUKUSHIMA M, DOI S, OHASHI T, et al. A mixture of organisms affects cholesterol metabolism together with rat cecal flora[J].Agricultural and Biological Chemistry, 1999, 63(7): 1160-1164.DOI:10.1271/bbb.63.1160.
[19] KOVATCHEVA-DATCHARY P, NILSSON A, AKRAMI R, et al.Dietary fiber-induced improvement in glucose metabolism is associated with increased abundance of prevotella[J]. Cell Metabolism,2015, 22(6): 971-982. DOI:10.1016/j.cmet.2015.10.001.
[20] LEY R E, PETERSON D A, GORDON J I. Ecological and evolutionary forces shaping microbial diversity in the human intestine[J]. Cell, 2006, 124(4): 837-848. DOI:10.1016/j.cell.2006.02.017.
[21] LEI H, SUN Y, LUO Z, et al. Fatigue-induced orosomucoid 1 acts on C-C chemokine receptor type 5 to enhance muscle endurance[J].Scientif i c Reports, 2016, 6: 128-129. DOI:10.1038/srep18839
[22] 陳昊杰. 膽汁酸對草魚生長、脂質代謝及腸道微生物區系的影響[D].楊凌: 西北農林科技大學, 2016: 23-30.
[23] 郭秀蘭. 豬腸道硬壁菌門和擬桿菌門數量的檢測及其相對豐度與脂肪沉積的相關性研究[D]. 雅安: 四川農業大學, 2009: 68-75.
[24] 邴國強, 熊為民, 孫茹. 間竭性過量運動大鼠血液生化指標的變化及其影響[J]. 吉林大學學報, 2007, 33(5): 875-878. DOI:10.13481/j.1671-587x.2007.05.061.
[25] BERMON S, PETRIZ B, KAJ?NIEN? A, et al. The microbiota: an exercise immunology perspective[J]. Exercise Immunology Review,2015, 21: 70-79.
[26] 侯方麗, 張瑞芬, 張名位, 等. 黑米花色苷調節脂質代謝作用及其分子機制研究進展[J]. 熱帶作物學報, 2016, 37(3): 640-646.DOI:10.3969/j.issn.1000-2561.2016.03.033.
[27] 蔡潭溪, 劉平生, 楊福全, 等. 脂質組學研究進展[J]. 生物化學與生物物理進展, 2010, 2: 121-128. DOI:10.3724/SP.J.1206.2009.00479.
[28] 陳宇歡, 李靜, 范亞葦, 等. 脂質組學及其在營養與健康研究中的應用研究進展[J]. 食品科學, 2014, 35(15): 272-276. DOI:10.7506/spkx1002-6630-201415055.
[29] 張名位. 黑米抗氧化與降血脂的活性成分及其作用機理[D]. 廣州:華南師范大學, 2003: 56-67.
[30] YAO S L, XU Y, ZHANG Y Y, et al. Black rice and anthocyanins induce inhibition of cholesterol absorption in vitro[J]. Food &Function, 2013, 4(11): 291-299. DOI:10.1039/c3fo60196j.
[31] NAPOLI C, CRUDELE V, SORICELLI A, et al. Primary prevention of atherosclerosis: a clinical challenge for the reversal of epigenetic mechanisms?[J]. Circulation, 2012, 125(19): 2363-2373.DOI:10.1161/CIRCULATIONAHA.111.085787.
[32] 陳國良, 劉立偉, 謝爽, 等. 高密度脂蛋白膽固醇代謝及其對冠心病影響的研究進展[J]. 心血管病學進展, 2010, 31(3): 360-363.DOI:10.3969/j.issn.1004-3934.2010.03.010.
[33] 蔡教英, 歐陽克蕙, 上官新晨, 等. 脂質代謝組學的研究進展[J]. 動物營養學報, 2011, 23(11): 1870-1876. DOI:10.3969/j.issn.1006-267x.2011.11.004.
[34] 喻松仁. 冠心病痰瘀衍變與脂質代謝的關聯性研究[D]. 長沙: 湖南中醫藥大學, 2014: 5-12.
Neoagarotetraose Protects Mice against Exhaustive Exercise-Induced Dyslipidemia by Modulating Gut Microbial Composition and Function
LI Jing, ZHANG Na, SONG Jia, MAO Xiangzhao, XUE Changhu, TANG Qingjuan*
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
Purpose: To investigate the possible mechanism of neoagarotetraose (NAT) in regulating lipid metabolism.Methods: Male BALB/C mice were randomly divided into three groups: control group, exhaustive exercise group and NAT intervention group. A wheel-track treadmill was used in this study to propose an exhaustive exercise protocol. The animals in both the exhaustive exercise and NAT groups were subjected to exhaustive exercise, while those in the control group maintained normal physical activity. After sixteen consecutive days of treatment, serum lipid parameters were measured and fecal samples were collected to investigate gut microbiota changes by metagenome sequencing. Our results showed that the concentrations of total cholesterol (TC), low-density lipoprotein cholesterol (LDL-C) and high-density lipoprotein cholesterol (HDL-C) in serum increased sharply (P < 0.05) after exhaustive exercise, while serum triglycerides(TG) concentration decreased signif i cantly (P < 0.05) indicating that exhaustive exercise could be an important cause of lipid metabolism disorder. Our data also showed that NAT treatment resulted in a profound change in the gut microbiome structure, which subsequently led to widespread shifts in its function. Meanwhile, our fi ndings suggested that NAT may protects mice against dyslipidemia induced by exhaustive exercise through modulating the gut microbial composition,improving the lipid metabolism signal pathway of the microbiota, and regulating enzymes activities involved in fatty acid oxidation and lipid synthesis.
neoagarotetraose; exhaustive exercise; dyslipidemia; gut microbiota; metagenome
10.7506/spkx1002-6630-201801025
TS201.4
A
1002-6630(2018)01-0165-07
李晶, 張娜, 宋佳, 等. 新瓊四糖通過改善腸道微環境對力竭運動小鼠脂質代謝的影響[J]. 食品科學, 2018, 39(1):165-171.
10.7506/spkx1002-6630-201801025. http://www.spkx.net.cn
LI Jing, ZHANG Na, SONG Jia, et al. Neoagarotetraose protects mice against exhaustive exercise-induced dyslipidemia by modulating gut microbial composition and function[J]. Food Science, 2018, 39(1): 165-171. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201801025. http://www.spkx.net.cn
2016-10-08
國家自然科學基金面上項目(31271923);國家自然科學基金聯合基金項目(U1406402)
李晶(1992—),女,碩士研究生,研究方向為食品營養學。E-mail:798183191@qq.com
*通信作者簡介:唐慶娟(1971—),女,教授,博士,研究方向為食品營養學。E-mail:tangqingjuan@ouc.edu.cn

