冠心病合并慢性牙周炎患者外周血調節性T細胞檢測的臨床意義
王 倩, 丁 暢, 王 治, 吳 娟
(1. 江蘇省南京市胸科醫院 心內科, 江蘇 南京, 210029; 2. 江蘇省南京市口腔醫院 牙周科, 江蘇 南京, 210008)
冠心病合并慢性牙周炎患者外周血調節性T細胞檢測的臨床意義
王 倩1, 丁 暢1, 王 治1, 吳 娟2
(1. 江蘇省南京市胸科醫院 心內科, 江蘇 南京, 210029; 2. 江蘇省南京市口腔醫院 牙周科, 江蘇 南京, 210008)
冠心病; 牙周炎; 調節性T細胞; 動脈粥樣硬化
炎癥反應不僅在冠狀動脈粥樣硬化性心臟病(AS)斑塊的形成和發展中起著重要作用,還決定著它的穩定性[1]。牙周炎是牙周支持組織的慢性炎癥,能夠通過被感染的牙周組織釋放炎癥介質,誘導內皮細胞功能障礙,導致AS[2]。T淋巴細胞介導的細胞免疫參與了AS的炎癥反應過程,在促進斑塊進展和保持斑塊穩定中都起到一定的作用[3-4]。調節性T細胞(Treg)的數量減少或者功能下降、甚至其分化及分布的異常都會導致自身免疫失調,這可能是T淋巴細胞參與AS進展的重要作用機制[5]。本研究檢測患者的CD4+CD25+FoxP3+Treg含量以及細胞因子TGF-β1的濃度,分析冠心病合并慢性牙周炎患者的調節性T細胞數量及功能的變化,報告如下。
1 資料與方法
1.1 一般資料
選取2015年3月—2017年9月南京市胸科醫院心血管內科首診疑似冠心病住院患者122例,年齡40~65歲,平均(56.74±6.82)歲,男62例,女60例。根據冠狀動脈造影結果和牙周炎診斷標準將患者分為4組。對照組(C組)32例,男15例,女17例,年齡(56.48±5.93)歲,冠脈造影正常且牙周組織健康或僅有牙齦炎; 冠心病組(CHD組)28例,男15例,女13例,年齡(58.16±7.19)歲,有冠心病但牙周組織健康或僅有牙齦炎; 冠心病合并牙周炎組(CHD-P組)32例,男17例,女15例,年齡(57.40±7.47)歲; 牙周炎組(P組)30例,男15例,女15例,年齡(55.01±6.60)歲,冠脈造影正常有慢性牙周炎。
排除標準: 合并感染性疾病; 應用炎癥抑制藥物; 嚴重肝腎功能不全者; 周圍血管栓塞性疾病者; 惡性腫瘤患者; 糖尿病和風濕性疾病; 嚴重高脂血癥(總膽固醇>6.5 mmol/L、甘油三酯>3.0 mmol/L、低密度脂蛋白>4.0 mmol/L)和高血壓病3級以上的患者。研究經倫理委員會批準,并獲取研究對象的知情同意。
1.2 研究方法
1.2.1 冠心病的診斷: 行冠狀動脈造影并依據哈里森內科學標準診斷,冠狀動脈狹窄<50% 者為正常。冠狀動脈狹窄程度采用Gensini(GS)評分法進行評分; 對主要冠狀動脈左主干、左前降支、左回旋支、右冠狀動脈中任何一支狹窄進行積分: ≤25%為1.0分,26%~49%為1.5分,50%為2.0分,51%~74%為3.0分,75%為4.0分,76%~89%為6.0分,90%為8.0分,91%~98%為12.0分,99%為16.0分,100%為32.0分。
1.2.2 牙周炎的診斷: 由南京市口腔醫院同一位牙周科醫生依據患者牙齦炎癥、牙周袋形成、牙槽骨吸收和牙齒松動等方面進行診斷。牙周組織健康或僅有牙齦炎者列為無牙周炎。
1.2.3 標本采集: 抽取受試者入院后第2天空腹靜脈血12 mL, 其中6 mL全血樣本送本院檢驗中心進行常規血脂、CRP檢測; 2 mL全血樣本采用EDTA抗凝行流式細胞術檢測; 4 mL全血樣本用肝素抗凝管采集送本院中心試驗室行ELISA檢測。
1.2.4 CD4+CD25+Foxp3+Treg/CD4+T的檢測: 抽取靜脈血1 mL, 用PBS 1︰1稀釋,加入等量的人淋巴細胞分離液中, 2 200 r/min離心20 min, 取單個核細胞層,加入PBS洗滌, 1 500 r/min離心10 min去上清液; 取A(同型對照管)、B(檢測管)兩管,每管加入約5.0×105個細胞,以CD4/CD25混合抗體孵育30 min, 洗滌后加入1 mL固定/破膜工作液孵育60 min, A管加入IgG抗體,B管加入Foxp3抗體,孵育30 min, 洗滌后加入適量流式緩沖液重懸細胞,流式細胞儀檢測。試劑購自美國BD公司。
1.2.5 TGF-β1濃度的檢測: 靜脈血4 mL以4 ℃低溫離心機3 000 轉/min離心20 min, 收集血清并分裝至多個1.5 mL的EP管中,封膜,編號, -80 ℃超低溫冰箱保存待用。取上清液(血漿)用ELISA法測定TGF-β1濃度。TGF-β1ELISA試劑盒購自北京達科為生物技術有限公司。
1.3 統計學處理
用SPSS 18.0 軟件進行分析,計數資料采用卡方檢驗; 計量資料方差齊性檢測后,正態分布數據以均數±標準差表示,多組均數間采用單因素方差分析,組間兩兩比較采用SNK方差分析; 相關檢驗性采用Spearman。P<0.05為差異有統計學意義。
2 結 果
C組、CHD組、CHD-P組和P組在年齡、性別、吸煙率、血壓、總膽固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、CRP等方面比較,差異無統計學意義(P>0.05)。見表1。CHD組的GS評分為(13.91±6.37),較C組(2.97±1.90)和P組(2.90±1.91)顯著升高 (P<0.01)。CHD-P組的GS評分為(22.98±13.36),較C組和P組顯著升高(P<0.01)。CHD-P組較CHD組顯著升高(P<0.01)。C組和P組無顯著差異(P=0.973)。CD4+CD25+Foxp3+Treg/CD4+T在CHD-P組中為(1.97±0.38)%,較C組(2.58±0.74)%、CHD組(2.34±0.51)%和P組(2.34±0.34)%顯著降低(P<0.01); CHD組和P組較C組下降,但差異無統計學意義(P>0.05); CHD組與P組無顯著差異(P=0.983)。CHD-P組TGF-β1水平為(13.41±2.96) μg/L, 較C組(23.32±5.60) μg/L、CHD組 (18.98±3.95) μg/L和P組(18.41±3.54) μg/L顯著降低(P<0.01)。CHD組和P組較C組均降低,且差異均有統計學意義(P<0.01); CHD組較P組無顯著差異(P=0.606)。Spearman相關性分析發現,血漿TGF-β1濃度與CD4+CD25+Foxp3+Treg/CD4+T呈中等相關(r=0.455,P<0.01)。
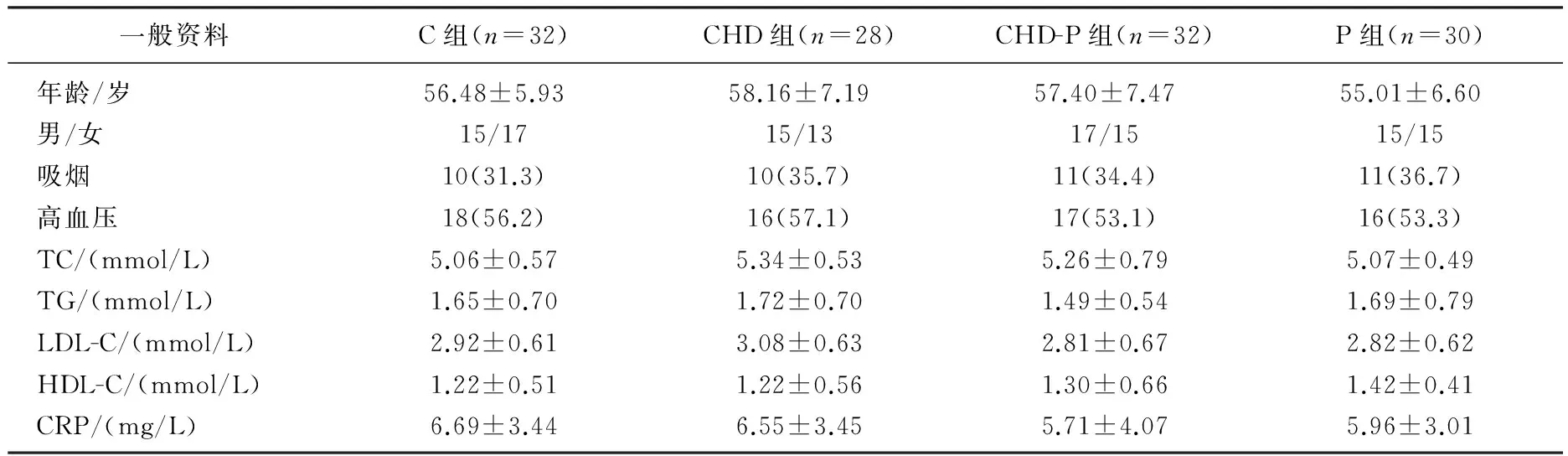
表1 4組一般資料比較
3 討 論
研究[6]認為冠心病的主要病因是AS,但是在AS的發展過程中,細胞基質的反應、各種細胞因子以及生長因子的產生與作用,都與炎癥反應過程很類似。AS是一種炎癥性疾病,炎性細胞浸潤是AS的重要過程。多種免疫細胞如巨噬細胞、DC細胞、淋巴細胞參與AS斑塊的形成,其中T細胞在斑塊形成各個時期均發揮著重要的作用,而且斑塊部位浸潤的T細胞中最主要的是CD4+T細胞[7]。
近年來,大量的流行病學調查[8]顯示牙周炎患者發生AS的風險增高,病因學調查[9]提示牙周炎患者罹患心血管疾病的風險比無牙周炎患者高,重度牙周炎與血管內膜增厚相關。牙周炎還可以導致血小板活化因子和脂蛋白相關性磷脂酶A2等炎癥因子釋放,它們也是已知的冠心病的危險因子,可以促進血小板聚集,加劇冠狀動脈粥樣硬化斑塊內的炎癥反應,使斑塊的不穩定性加劇[10]。本研究中CHD-P組較CHD組GS評分明顯升高,提示CHD-P組較CHD組患者的冠狀動脈的狹窄程度更高,進而預測慢性牙周炎可能與冠狀動脈粥樣硬化的進展相關。
牙周炎引起的感染誘導出T淋巴細胞免疫應答反應,不同亞群的T淋巴細胞在AS形成過程中的作用不同。Treg細胞是負向調節免疫T細胞,通過分泌抑炎因子IL-10和TGF-β1對炎癥反應負調控,抑制AS的形成。有研究[11]發現,冠心病患者外周血中Treg細胞數目和功能均下調,且分泌的細胞因子IL-10和TGF-β1水平也隨之下降。Hagiwara等[12]研究表明,牙齦卟啉單胞菌疫苗舌下使用可緩解牙齦卟啉單胞菌感染引起的AS斑塊形成,且上調淋巴結Treg細胞數量。還有研究提示牙齦卟啉單胞菌可分泌外膜蛋白、牙齦素,當毒力因子進入循環系統能誘導內皮細胞的促AS應答反應[13]。由此可見,Treg在T淋巴細胞參與的AS過程中可能起關鍵作用。
CD4+CD25+Foxp3+Treg是最為重要的Treg細胞。Foxp3在CD4+T細胞的穩定表達是Treg分化過程完成的標志,Foxp3是控制Treg發育及發揮其生物功能的重要參與者[14]。Roland等[15]利用白喉毒素注射獲得選擇性缺失Foxp3的小鼠,將小鼠骨髓移植至Ldlr-/-小鼠,結果顯示Foxp3缺失后AS斑塊比對照組明顯增大,血漿膽固醇也明顯增高,證明Foxp3+Treg可通過調節脂蛋白代謝抑制AS。本研究中CHD-P組較CHD組、P組、C組的CD4+CD25+FoxP3+Treg/CD4+T均明顯下降,提示冠心病合并慢性牙周炎患者的Treg數量明顯下降,推測牙周炎加重了冠心病患者的慢性炎癥反應、促進了冠心病患者AS斑塊的進展。本研究中CHD組、P組和C組的CD4+CD25+FoxP3+Treg/CD4+T組間無顯著差異。作者推測雖然CHD組和P組患者存在慢性炎癥反應,但是該反應相對比較輕微是不同于急性炎癥反應的,因此與C組患者間無明顯差異,也有可能是本研究的樣本量偏小所致。
TGF-β是許多具有共同生物學特性的信號分子組成的大家族,它參與了Treg細胞分化的許多環節。TGF-β1是TGF-β1家族中的一員,它參與了冠狀動脈粥樣硬化的形成、冠狀動脈的狹窄、心肌梗死后重塑、細胞凋亡等過程,反映了Treg的功能。有研究[16]表明斑塊不穩定的冠心病患者血清TGF-β1水平較正常人明顯降低; 心肌梗死者的血漿活性TGF-β1水平更低。由此可見,血漿TGF-β1濃度水平的降低更易于斑塊的破裂和血栓的形成。TGF-β1在AS的形成過程中是炎癥免疫調節和斑塊穩定因子[17]。本研究中CHD-P組、CHD組、P組的TGF-β1水平均比C組降低, CHD-P組的TGF-β1水平較CHD組進一步下降。另外,本研究提示患者的血漿TGF-β1水平與Treg含量呈中等相關。作者認為,牙周炎與冠心病都存在慢性炎癥反應,慢性牙周炎導致了冠心病患者TGF-β1水平的進一步下降,繼而引起 Treg的含量和功能的降低,破壞了AS斑塊的穩定性。
[1] 丁士芳, 張運, 張梅, 等. 斑塊穩定性與炎癥反應在急性冠狀動脈綜合征中作用的研究[J]. 中華心血管病雜志, 2006, 34: 512-514.
[2] Nakajima T, Yamazaki K. Periodontal disease and risk of atherosclerotic coronary heart disease[J]. Odontology, 2009, 97(2): 84-91.
[3] Hansson G K, Jonasson L. The discovery of cellular immunity in the atherosclerotic plaque[J]. Arterioscler Thromb Vasc Biol, 2009, 29(11): 1714-1717.
[4] Libby P, Okamoto Y, Rocha V Z, et al. Inflammation in atherosclerosis: transition from theory to practice[J]. Circ J, 2010, 74(2): 213-220.
[5] Rodrigues P H, Reyes L, Chadda A S, et al. Porphyromonas gingivalis strain specific interactions with human coronary artery endothelial cells: a comparative study[J]. PLoS One, 2012, 7(12): e52606.
[6] Beck J D, Offenbacher S. The association between periodontal diseases and cardiovascular diseases: a state-of-the-science review[J]. Ann Periodontal, 2001, 6(1): 9-15.
[7] BETTELLI E, CARRIER Y, GAO W, et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells [J]. Nature, 2006, 441(7090): 235-238.
[8] Hansen GM, Egeberg A, Holmstrup P, et al. Relation of Periodontitis to Risk of Cardiovascular and All-Cause Mortality (from a Danish Nationwide Cohort Study)[J]. The American journal of cardiology, 2016, 118(4): 489-493.
[9] KHADER Y S, ALBASHAIREH Z S, ALOMARI M A. Periodontal diseases and the risk of coronary heart and cerebrovascular diseases: a meta-analysis[J]. Journal of periodontology, 2004, 75(8): 1046-1053.
[10] Garza C A, Montori V M, McConnell J P, et al. Association between lipoprotein-associated phosphorlipase A2 and cardiovascular disease: asystematic review[J]. Mayo Clin Proceedings, 2007, 82: 159-165.
[11] Potekhina A V, Pylaeva E, Provatorov S, et al. Treg/Th17 balance in stable CAD patients with different stages of coronary atherosclerosis [J]. Atherosclerosis, 2015, 238(1): 17-21.
[12] Hagiwara M, Kurita-Ochiai T, Kobayashi R, Hashizume-Takizawa T, Yamazaki K, Yamamoto M. Sublingual Vaccine with Groel Attenuates Atherosclerosis[J]. Journal of Dental Research, 2014, 93(4): 382-387.
[13] ZHANG B, SIRSJO A, KHALAF H, et al. Transcriptional profiling of human smooth muscle cells infected with gingipain and fimbriae mutants of Porphyromonas gingivalis [J]. Scientific reports, 2016, 6: 21911.
[14] ZHENG Y, RUDENSKY A Y. Foxp3 in control of the regulatory T cell lineage [J]. Nature immunology, 2007, 8(5): 457-462.
[15] Roland K, Gerdes N, Badeau R M, et al. Depletion of FOXP3+ regulatory T cells promotes hypercholesterolemia and atherosclerosis[J]. J Clin Invest, 2013, 123(3): 1323-1334.
[16] Djurovic S, Thelle D S, Ringstad J, et al. Altered serum concentration of TGF-betaland LP (a)lipoprotein and their correlation in patients with first acute myocardial infarction[J]. Nutr MetabCardiovaac Dis, 1996, 9(5): 250-254.
[17] Cipollone F, Fazia M, Mincione G, et al. Increased expression of transforming growth factor-beta1 as astabilizing factor in human atherosclerotic plaques[J]. Stroke, 2004, 35(10): 2253-2257.
R 541.4
A
1672-2353(2017)24-142-03
10.7619/jcmp.201724059
2017-10-10
國家自然科學基金項目(81570365); 南京市醫學科技發展項目(YKK15165)
丁暢

