基于“深度復習”的高三化學復習應把握好“六化”
霍本斌
摘 要:深度復習是一種源于深度學習的高階思維發展的理解性復習方式,也是在高三復習中落實化學科學核心素養培養的重要方式。與化學學科核心素養對應的深度復習策略為概念理解精準化、認知梳理結構化、問題解決模型化、專題復習生本化、實驗復習探究化、素養培養遞進化的“六化”策略,可有效解決學生的學困點。
關鍵詞:深度復習;高三復習;化學教學;學困點
深度復習是建構在深度學習基礎之上的一種走進學生情感世界和思維深處,超越表層的符號教學,由符號教學走向邏輯教學和意義教學相統一的復習方式。這種復習方式能夠幫助學生深入理解化學學科知識和建構化學知識體系,培養學生解決問題的關鍵能力。如何在高三化學復習中開展深度復習,筆者認為:不僅要把握好目標的適切度、知識的關聯度、問題的開放度、思維的量度和認識的高度[1],而且還要體現“六化”,即概念理解精準化、認知梳理結構化、問題解決模型化、專題復習生本化、實驗復習探究化、素養培養遞進化。
一、概念理解精準化
化學概念是將化學現象、化學事實經過比較、綜合、分析、歸納、類比等方法抽象出來的理性知識,反映化學現象及化學事實的本質屬性[2]。只有對化學概念進行精準化的理解和把握,學生才能從本質上理解化學概念,形成正確的認知。如何做到概念的精準化,可從下面三個角度入手進行理解。第一、注意概念的“本質和內涵”;第二、注意概念的“外延和拓展”;第三是注意概念的“外顯和表征”。如在進行電解質和非電解質的概念復習時,為了幫助學生理解這一概念,必須讓學生明確以下問題:(1)兩者研究的范疇是化合物,則單質和混合物不屬于電解質和非電解質的范疇。(2)判斷的依據是在水溶液或熔化狀態下是否導電。符合這兩個條件之一的就是電解質;均不符合的是非電解質。(3)電解質導電是它本身電離產生的離子定向移動而導電。(4)化合物是否為電解質,與化合物的溶解性無關,與化合物的類型無關。(5)電解質和電解質溶液不同,前者是純凈物,后者是混合物。又如在學習化學平衡移動原理這一概念時,必須讓學生明確以下要點:(1)影響平衡移動的因素是溫度、濃度或壓強,催化劑不影響平衡;(2)改變影響平衡的某一個條件,平衡移動的結果是減弱改變的趨勢而非抵消;(3)該原理涉適用于各種平衡體系,如電離平衡、水解平衡、絡合平衡以及沉淀溶解平衡等。
二、認知梳理結構化
著名認知心理學家奧蘇貝爾指出:認知結構是指學生頭腦中的知識結構,是由學生外來知識內容轉化而來,它是學生后續學習的基礎和前提。他認為教學的主要任務在于幫助學習者建立對教材的清晰、牢固的認知結構[3]。根據現代圖示理論,在高三化學復習中使用流程圖、概念圖、網絡圖等視覺化的梳理方式,可以促進學生對知識的理解和建構,實現知識的系統化。例如在復習元素及其化合物知識時,既可以按照以元素為主線進行知識梳理(如圖1所示),也可以按照以物質為主線對具體物質的相關知識進行梳理(見圖2)。究竟采用何種形式對知識進行認知梳理,應視具體情況而定。
在采用圖1方式進行認知梳理時,需要注意三種比較典型轉化關系,即
(1)連續轉化關系,如:
Na→Na2O→Na2O2→ NaOH
C或CH4→CO→CO2→H2CO3
N2或NH3→NO→NO2→HNO3
S或H2S→SO2→SO3→H2SO4
(2)三角轉化關系,如:
事實上,無論是對元素化合物知識進行梳理,還是在對化學反應原理知識進行梳理,都應體現認知的結構化。結構化的知識有助于學生系統地認識物質的性質和元素的性質,運用化學原理解決具體的問題。
三、問題解決模型化
學生不能夠將所學知識進行靈活運用,其中最重要的原因在于缺乏模型認知能力,不能夠在學習化學的過程中建構合理的思維模型并運用模型去解決具體的化學問題。化學思維模型作為一種反映物質組成、結構、性質及其相互轉化關系的結構圖式,它通常分為物質模型(如晶體模型、分子模型、原子模型、比例模型、球棍模型、化工設備模型等物理模型)和抽象模型(或思考模型、想象模型、理想模型)[4],也可以劃分為化學微觀模型、化學計量模型、化學理論模型、化學認知模型。在高三化學復習過程中,教師應針對學生在復習過程中遇到的不同學困點,引導學生建構不同的思維模型,以培養學生的模型認知能力和運用模型解決實際問題的能力。
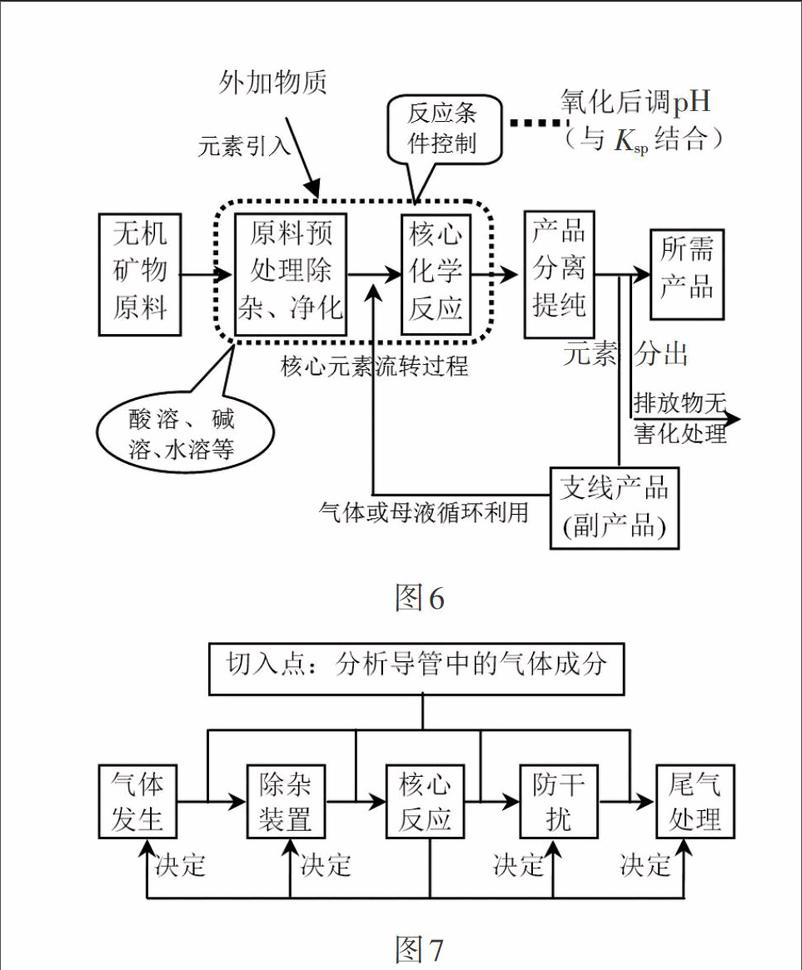
如在復習元素及其化合物知識時,為了解決涉及過量問題的離子反應的書寫這一學困點,可引導學生建構基于酸堿變化的認知模型(見圖3、圖4),然后利用“相隔要反應,生成中間物”、“反應誰過量,產物靠近誰”、“相鄰不反應,兩者可共存”的反應規律可以迅速書寫與量有關的CO2與NaOH、CO32-與H+、Al3+與OH-、AlO2-與H+等的離子反應。 又如針對學生對無機工藝流程題的分析無從著手這一學困點,教師可以從歷年對工藝流程的考點出發,引導學生從物質類別和元素價態的視角“抓兩頭、析過程”,建構無機工藝流程分析的思維模型(如圖6)。讓學生明確如何看箭頭方向分析反應物和產物,如何根據核心元素價態變化確定加入的物質是酸性物質還是堿性物質,是還原劑還是氧化劑等。對于與氣體相關的綜合實驗分析,則可以從常見氣體(如H2、NH3、C2H4、C2H2等)的制備和性質實驗出發,去建構氣體綜合實驗的分析思維模型(如圖7),然后再運用該模型去分析歷年高考的綜合性實驗試題,即可讓學生掌握氣體綜合實驗的分析方法和相關策略。
再如在解決電化學知識中的離子交換膜的功能、電化學原理分析、電極反應等學困點時,教師可引導學生從單池單液原電池到雙池雙液鹽橋電池,再到雙池雙液離子交換膜電池
的思維進階方式突破對離子交換膜的功能的認識;針對電化學原理分析策略,可引導學生建構“三定”(即定物、定極、定流向)的思維模型;針對電極反應式的書寫,可建構“定物、設1(即將電極反應中含核心變價元素的反應物的系數設為1)、想環境、再守恒”的思維模型等。
在復習過程中,通過建構思維模型,將陳述性知識轉化為程序性知識和策略性知識,有利于培養學生的模型認知能力和運用模型解決問題的能力,從根本上最大限度地解決學生的學困點。
四、專題復習生本化
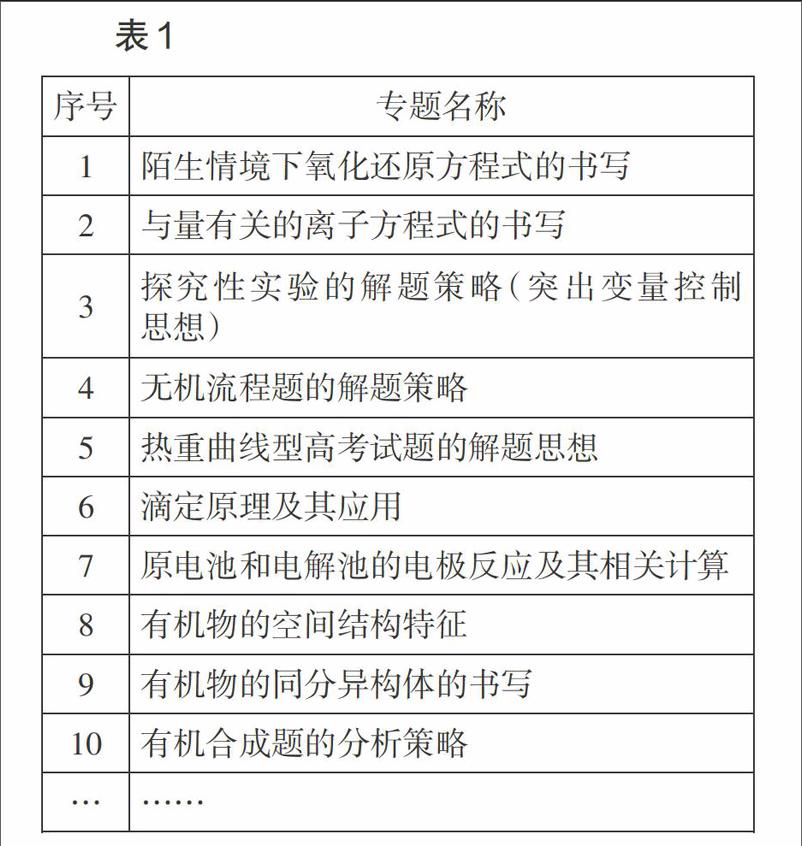
生本化要求做到讓“天書”落地,并走進學生心靈。因此,在高考復習時,教師應從學生的學情、考情、教情出發,尊重學生的認知特點和認知規律,針對學生學習過程中遇到的學困點或存在的病灶,選擇切口小、視角新、針對性強的專題進行有效復習,切實解決學生復習過程中遇到的真問題、實問題、小問題,避免復習過程中出現的低效、甚至無效。如在高考二輪復習時,可針對學生中普遍存在的學困點,針對性地開展表1所示的小專題復習,幫助合理建構知識系統,促進學生在陌生情境中發現問題、分析問題和解決問題能力的提升。
在復習的過程中,教師還應抓住化學的基本問題(包括近兩年高考試題中呈現出的真問題),通過整合化學雙基(即基礎知識和基本技能)和學科方法(如模型建構、實驗探究、變化與守恒法等)、學科思想(如控制變量法、對比分析法、空白實驗法、分解-合成法等)開展復習。
五、實驗復習探究化
現行高中化學教材實驗以證實性實驗和結構性實驗為主,較少涉及指導性實驗,沒有開放性實驗;而高考實驗則以指導性實驗為主,重視分析證據并得出結論和科學解釋,沒有考查實驗問題的提出、待檢驗的假設等[5]。由此可知,在高考復習中僅關注教材本身的實驗或教輔中的實驗習題是遠遠不夠的,還應當進行指導性或開放性實驗的探究性實驗復習。
如何在復習中培養學生的探究能力和證據推理能力?在高三復習過程中可以從以下幾個方面著手:(1)優化教材實驗,將教材實驗設計為實驗組對比實驗,使實驗具有更強的探究性,消除學生對某些化學知識的認識誤區。如將乙酸乙酯的制備實驗改成實驗組實驗可以幫助學生通過實驗認識實驗中加熱的作用、濃硫酸在制備乙酸乙酯中所起的作用和使用飽和Na2CO3溶液的作用等。(2)將那些常規實驗無法捕捉的微觀現象、無法解釋抽象理論的化學實驗改進成數字化探究實驗。如利用傳感器研究溶液混合熱效應的影響因素,研究濃度、溫度、壓強等對反應速率或化學平衡的影響,研究外界條件對某一化學反應的影響等。讓學生通過分析數據曲線認識化學反應原理背后所呈現的規律等。(3)以實驗操作中出現的異常現象為突破口開展實驗探究,認識異常現象背后的本質原因。如復習Fe2+與Fe3+的相互轉化時,可針對“在FeSO4溶液中加入KSCN溶液,再加氯水,溶液先變紅后褪色;若加入溴水則不出現紅色”這一異常現象展開探究,讓學生認識到加入Br2水未出現紅色的原因是Fe2+與SCN-部分結合,使Fe2+濃度降低,由于Br2的氧化性低于Cl2,Br2不能將低濃度的Fe2+氧化。又如在用碘水檢驗淀粉是否水解的實驗復習中,可針對“向淀粉溶液中滴加幾滴碘水和一定量的稀硫酸后,加熱,藍色褪去;冷卻過程中溶液恢復藍色;一段時間后藍色又褪去”這一與教材描述不一致的異常現象展開實驗探究,有利于學生通過探究認識產生異常現象的本質原因等。(4)以教材實驗產物放置過程中顏色出現的特殊變化為基礎,展開物質特殊成分的組成探究。如在復習Fe(OH)2的制備實驗時,可針對“灰綠色的成分是什么”展開探究,最終在實驗探究的過程中得出產生灰綠色的原因是Fe(OH)2吸附Fe2+的緣故,并獲取制得白色的Fe(OH)2沉淀的基本方法是將FeSO4溶液加入到過量的NaOH溶液中,FeSO4濃度盡可小而NaOH濃度盡可能大,隔絕空氣等。
在復習過程中,教師要善于抓住能夠引起學生認知沖突的實驗事實展開探究式實驗復習,不僅可以讓學生明辨是非,解決認知中的學困點,還可以培養學生的證據推理能力和實驗探究能力。切不可以口頭實驗、紙筆實驗等方式使實驗復習邊緣化,否則得不償失。
六、素養培養遞進化
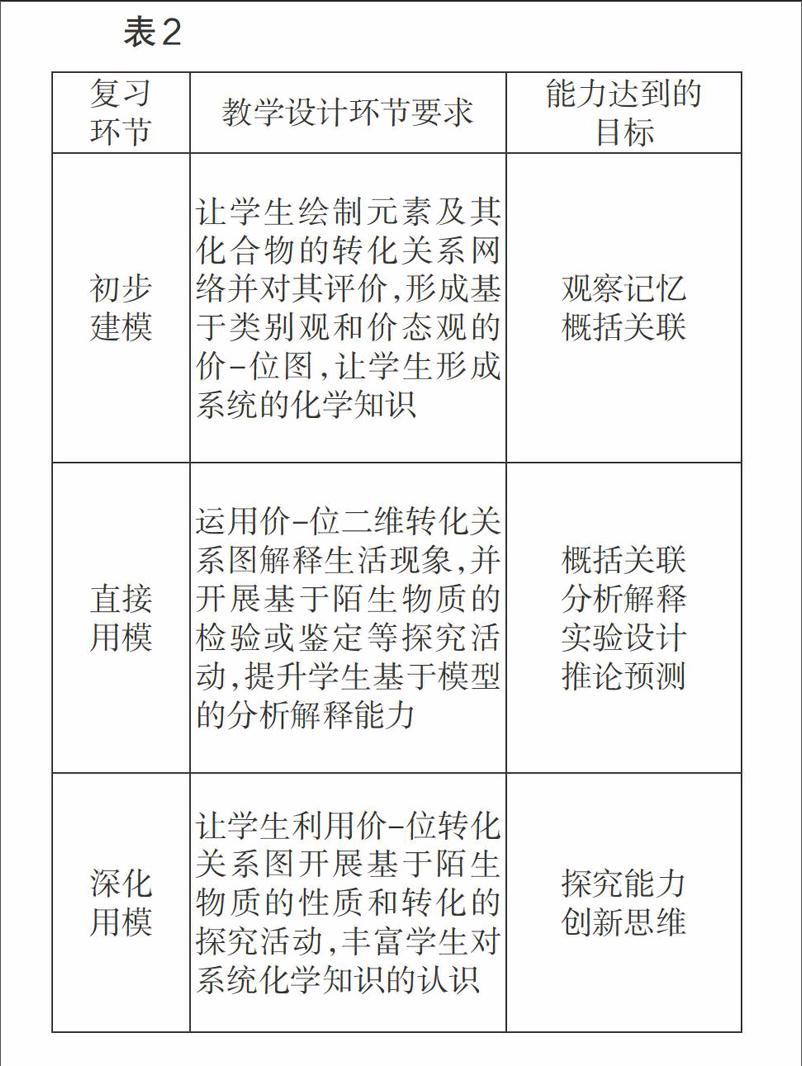
教師在進行復習時,應按照學習進階理論和《考試說明》中對學生能力的要求開展化學復習,切不可忽視學生已有的認知經驗,任意拔高知識難度和學習起點,否則對學生化學科學核心素養的培養不利。如為了實現素養培養的遞進化,在復習氧化還原反應時可按得氧失氧、化合價變化、電子轉移的先后順序進行學習進階;在復習有機物的同分異構體時,可按照單官能團的同分異構體、雙官能團的同分異構體、帶苯環的同分異構體、有限制條件的同分異構體的先后順序進行學習進階;針對變價元素及其化合物,則可以按照“初步建模——直接用模——深化用模——創新用模”四個環節開展復習(如表2),等等。endprint

