杜鵑紅山茶葉片葉綠素熒光對干旱脅迫及復水處理的響應
吳劉萍,許衍才,廖飛雄,王代容
(1.廣東海洋大學農學院,廣東 湛江 524088;2. 陽江市市區公園管理中心,廣東 陽江 529500;3.華南農業大學林學與風景園林學院,廣東 廣州 510642;4.廣東省農業科學院環境園藝研究所/廣東省園林花卉種質創新綜合利用重點實驗室/農業部華南都市農業重點實驗室,廣東 廣州 510640)
杜鵑紅山茶(Camellia changiiYe)為山茶科山茶屬光果紅山茶亞組植物,僅分布于廣東省陽春市河尾山鵝凰嶂自然保護區內,自然種群數僅800多株,為中國特有種、稀有種,被《中國物種紅色名錄》列為極危種(CR)和國家一級保護植物[1]。自此種植物被發現以來,學者們對其分類地位[2]、保護生物學[3]、染色體組型及主要性狀的遺傳變異[4-6],傳粉生物學及相關生殖的花粉生物等[7-10]開展了大量研究。由于杜鵑紅山茶四季開花,且在高氣溫6~9月的夏季為盛花期,具有很高的觀賞價值,其繁殖利用受到重視,嫁接技術已獲突破[11-12],嫁接苗成為杜鵑紅山茶產業化發展的主要商品類型,已生產應用于園林景觀和盆栽[13]。然而,作為一種分布區域窄、種群數量極少的保護植物,促進其人工栽培及商品化開發應用,有賴于掌握其生態習性和環境適應性。近年來相繼開展了對杜鵑紅山茶嫁接苗的光利用能力、干旱適應能力等相關研究,如光合日變化特性[14-15]、光響應曲線和光合參數[16]、干旱脅迫的生理響應等[17],但對干旱脅迫及復水處理下光合作用的抑制機理尚未見報道。
植物葉片葉綠體是光合作用的場所,葉綠素的系列變化反映植物的生長狀態、光合能力和對環境脅迫的響應,葉綠素熒光參數動力學是研究植物及其對環境脅迫響應的強有力工具[18-21],由于其測定可以無損、實時、準確獲取植物生命活動的信息,現已廣泛應用于植物光合作用和逆境生理的研究[22-23],同時參考光合作用過程中發生的一系列生理生化指標特別是抗氧化酶活性變化情況[24-25],可系統和客觀準確地了解植物光合作用的抑制機理。本研究通過測定干旱脅迫及復水情況下杜鵑紅山茶葉片葉綠素熒光參數及抗氧化酶活性的系列變化,探討杜鵑紅山茶對干旱脅迫的響應及復水后的恢復能力,以深入了解杜鵑紅山茶的水分適應機制,為杜鵑紅山茶的人工栽培和生理生態研究提供參考依據。
1 材料與方法
1.1 試驗材料
試驗于2016年9~10月在廣東海洋大學實驗基地大棚中進行,試驗期間最高溫度35℃,相對濕度75%~85%,光照度>15 000 lx。試驗材料為以高州油茶(C. gauchowensisChang)為砧木的3年生杜鵑紅山茶嫁接苗,選取地徑3 cm、株高、生長勢較整齊一致的盆栽苗進行試驗,盆栽基質為紅壤和河沙配制的栽培土。
1.2 試驗方法
盆栽苗上盆預培養3個月,常規養護管理,然后停止澆水進行干旱脅迫處理。試驗設干旱脅迫0、5、10、15、20、25 d及復水5 d共7個處理,每個處理3次重復,每個重復6盆,每盆定植苗木1株。干旱脅迫25 d后恢復澆水,每天澆透1次。植株隨機排列于棚內,各處理每株取當年生成熟葉片進行測定,每株隨機取6片,3次測量取平均值。
1.3 測定指標及方法
干旱脅迫處理 0、5、10、15、20、25 d及復水后5 d,分別取樣測定盆中土壤含水量、葉片葉綠素熒光參數。并于干旱脅迫前(0 d)、脅迫25 d、復水5 d分別測定葉片電解質滲出率、抗氧化酶活性。
葉綠素熒光參數測定采用PAM-2100 便攜式調制熒光儀(德國Walz公司),參照鄒崎[26]的方法進行,光強 500~1 200 μmol/m2·s。測定前將葉片暗適應20 min,分別測定葉片的初始熒光(Fo)、葉片葉綠素最大熒光(Fm)、原初光能轉化效率Fv/Fm、可變熒光(Fv= Fm-Fo)、實際光化學效率(ΦQPSII)、電子傳遞速率(ETR)、熒光光化學猝滅(qP=(Fm'- Fo')/FV和熒光非光化學猝滅(qN=1-FV'/FV)。
葉片相對含水量按照飽和含水量法測定,細胞膜透性用相對電導率法[26]測定,超氧化物歧化酶(SOD)活性采用氯化硝基四氮唑藍(NBT)光化還原法測定[26],過氧化物酶(POD)活性采用愈創木酚顯色法測定[25],過氧化氫酶(CAT)活性測定采用紫外分光光度法[27]。
試驗數據采用Excel軟件和SPSS軟件進行統計分析。
2 結果與分析
2.1 干旱脅迫下土壤含水量和植株生理生化響應
在停止澆水開始干旱脅迫處理后,盆栽中土壤含水量明顯下降,并隨處理的時間延長,土壤含水量持續下降。由圖1可知,停止澆水后25 d,盆中土壤含水量由初始的32.93%降至6.68%,紅山茶植株處于高度干旱脅迫狀態;恢復澆水后5 d,土壤含水量迅速回升到脅迫前的狀態。
由于盆中土壤水分的降低,紅山茶植株產生了相應的生理響應,葉片的相對含水量也隨之變化,測定結果(表1)表明,干旱脅迫25 d,葉片相對含水量比處理前下降了25.22%,復水后回復到脅迫前的水平;葉片電導率升高了98.85%,復水后有一定下降,但未恢復到處理前水平;抗氧化酶SOD、CAT、POD活性變化對干旱脅迫處理產生了極顯著的響應,其中SOD和CAT活性大幅提高、分別比脅迫前提高了近3倍和4倍多,而POD活性明顯下降、比脅迫前下降了79.50%,復水后酶活性均有一定程度的恢復,即SOD和CAT活性大幅下降,POD活性一定程度回升,但均未達到處理前水平。
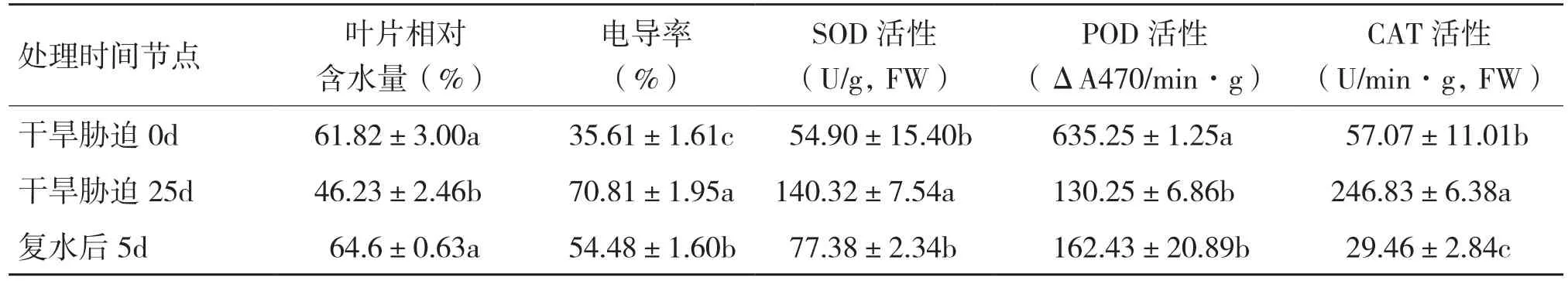
表1 干旱脅迫及復水處理杜鵑紅山茶葉片含水量、電導率及抗氧化酶活性變化
2.2 干旱脅迫及復水處理杜鵑紅山茶葉片葉綠素熒光參數響應
干旱脅迫后,杜鵑紅山茶葉片葉綠素熒光參數對脅迫處理出現了靈敏的響應和變化,整體響應表現為顯著差異。多重比較分析(表2)表明,干旱脅迫10 d后(中度脅迫)除光化學熒光猝滅qP外各參數均發生顯著變化;干旱脅迫15 d后(重度脅迫)所有參數均較處理前發生顯著變化,期間各參數均出現較大幅度變化;復水后,除電子傳遞速率(ERT)外各參數均有所恢復,趨近處理前水平,但均未能完全恢復正常。

表2 干旱脅迫及復水處理杜鵑紅山茶葉片葉綠素熒光參數的變化
2.2.1 PSⅡ初始熒光Fo和最大光化學效率Fv/Fm的變化 從圖2可以看出,在干旱脅迫初期,杜鵑紅山茶葉片初始熒光Fo先是上升,再有下降起伏,隨著干旱脅迫的持續,Fo持續上升,呈極顯著變化,至25 d達到高點,復水后Fo則迅速下降。表明杜鵑紅山茶葉片PSII反應中心對干旱脅迫有靈敏的響應,當脅迫到一定時間后中心會受到損傷,導致Fo上升,并隨脅迫時間延長損傷程度越嚴重,復水后PSII可得到一定的修復。

圖2 干旱脅迫及復水下杜鵑紅山茶葉片Fo變化
Fv /Fm是PSⅡ最大光化學效率,反映PSⅡ原初光能轉化效率。在正常生長情況下,每一物種的Fv/Fm比較穩定。但在脅迫情況下,光化學效率會受到影響。從圖3可以看出,在干旱脅迫處理后10 d,杜鵑紅山茶葉片Fv/Fm的值顯著下降,降幅為9.76%,干旱脅迫15 d后顯著升高,干旱脅迫20 d后再次下降,干旱脅迫25 d后PSⅡ最大光能轉化效率(Fv/Fm)比脅迫前降低了5.76%,復水5 d后Fv/Fm恢復性提高。

圖3 干旱脅迫及復水下杜鵑紅山茶葉片Fv/Fm變化
2.2.2 實際光化學量子產量(Yield)與光合電子傳遞速率( ETR)的變化 由圖4可知,隨著干旱脅迫處理時間的持續,實際光化學量子產量持續不斷下降,其中在脅迫5 d和20 d后都有一個明顯的下降過程,脅迫25 d后下降了19%。復水后,光化學量子產量快速恢復上升。
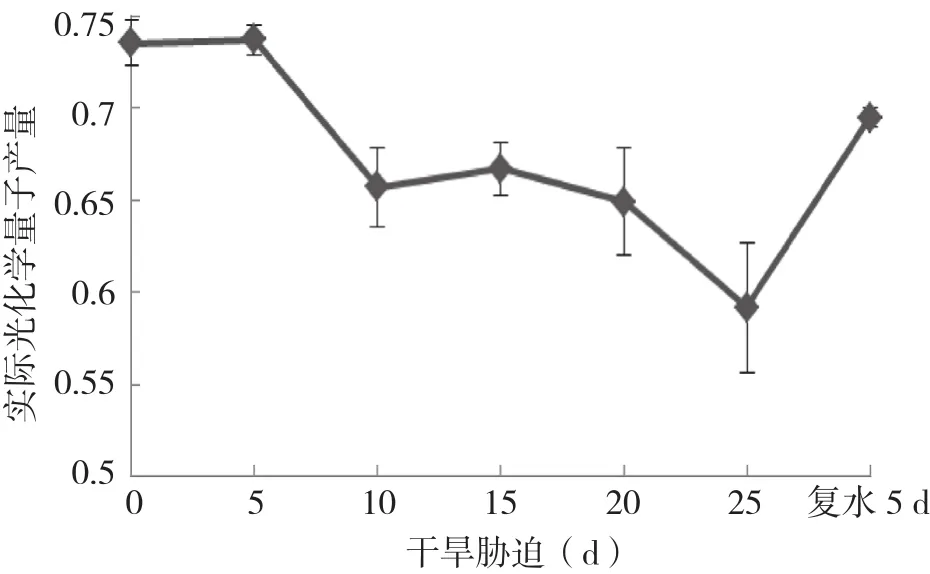
圖4 干旱脅迫及復水下杜鵑紅山茶葉片Yield變化
從PSⅡ反應中心電子傳遞情況光合電子傳遞速率( ETR) 來看(圖5),干旱脅迫處理5 d后ETR下降,之后急速上升,脅迫10~20 d呈相對穩定狀態,而20 d后又出現明顯的下降,復水后再次急速上升,表明ETR會隨環境發生劇烈變化而做出相應的響應。
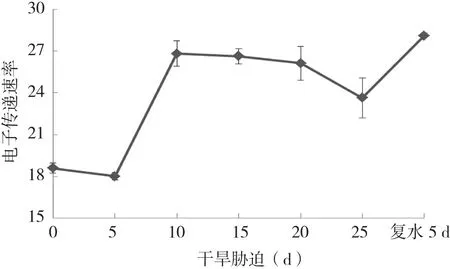
圖5 干旱脅迫及復水下杜鵑紅山茶葉片ETR變化
2.2.3 光化學淬滅系數(qP)和非光化學淬滅系數( qN )的變化 反映PSⅡ原初電子受體QA的氧化還原狀態的光化學淬滅系數qP,隨著干旱脅迫處理時間的延長,qP在干旱脅迫初始5 d略有升高后持續不斷下降,降幅呈增大趨勢,但在脅迫處理20 d后出現明顯的增加現象,復水5 d 后略恢復性下降(圖6)。
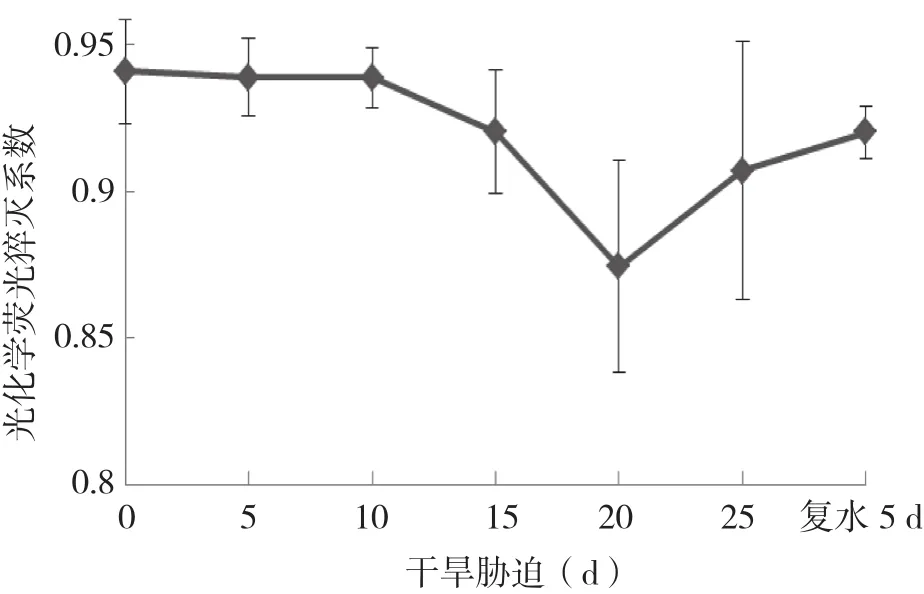
圖6 干旱脅迫及復水下杜鵑紅山茶葉片qP的變化
相反,非光化學淬滅系數( qN )在干旱脅迫處理5 d小幅度下降后,隨脅迫時間的增長,持續不斷上升,至脅迫25 d時達到最高值,復水處理5 d后,qN則出現大幅度恢復性下降(圖7)。

圖7 干旱脅迫及復水下杜鵑紅山茶葉片qN的變化
3 結論與討論
本試驗從盆栽土壤含水量和葉片生理生化指標的變化響應來看,干旱脅迫處理15 d后,杜鵑紅山茶植株已進入嚴重脅迫狀態;20 d后,土壤含水量接近7%,成為干旱脅迫的臨界點;25 d后,嚴重脅迫達較長時間,電導率大幅提高,表明已對植物葉片細胞膜產生了嚴重的損傷,而抗氧化酶SOD和CAT活性指標的大幅提高、POD活性明顯下降,抗氧化酶系統是適應干旱的生理響應;復水后各項指標雖難以完全恢復,但均得到一定程度的恢復,對干旱脅迫過程的適應性和在復水恢復過程中的恢復能力均表明杜鵑紅山茶對干旱環境具較強的適應性,這與杜鵑紅山茶葉片較為耐旱的解剖結構研究結果相一致[28]。
Fo是PSⅡ反應中心全部開放即原初電子受體QA全部氧化時的熒光水平,在干旱脅迫5 d后,初始熒光Fo降低,可能由PSⅡ天線色素的熱耗散所導;而嚴重脅迫期Fo的持續增加可能由PSⅡ反應中心的破壞或可逆失活引起,這與前人相關研究結果相一致[18]。任何影響PSII效能的環境脅迫均會使Fv/Fm 降低[26],干旱脅迫下,Fv/Fm和Yield在最初階段明顯下降,說明干旱脅迫下杜鵑紅山茶葉片PSⅡ受到傷害,降低了PSⅡ原初光能轉化效率,使PSⅡ潛在活性受損,光合作用原初反應過程受到抑制。之后都有所上升,可能是PSⅡ有所恢復并適應干旱的反應,隨著干旱時間的持續,PSⅡ繼續受到損害,Fv/Fm和Yield再次下降,復水處理后,PSⅡ得到一定修復。干旱處理最初階段,ETR急速下降,之后上升到一定程度接近平穩,這可能是其遇到干旱后PSII的原初光能捕獲能力與光合電子傳輸能力下降;隨著干旱時間延長,ETR升高為了適應干旱環境的表現。qP隨干旱脅迫程度增強而降低,在干旱處理的后期有所升高,可能是一定程度的干旱處理有利于提高PSⅡ反應中心開放部分的比例,將更多的光能用于推動光合電子傳遞,光能用于光化學傳遞的份額增加。在干旱初期短暫qN值下降后持續上升,表明葉片電子由PSⅡ的氧化側向PSⅡ反應中心的傳遞受阻,用于進行光合作用的電子減少,以熱或其他形式耗散的光能增加,同時卡爾文循環的活性受抑制程度增大,能量利用率降低。
本研究結果表明,杜鵑紅山茶通過PSⅡ系統和抗氧化酶系統來應對外界的干旱脅迫;一定程度的干旱處理有利于提高PSⅡ反應中心開放部分的比例,但隨著干旱時間的持續,干旱脅迫使杜鵑紅山茶的PSⅡ受到傷害,光合電子傳輸能力下降。在干旱脅迫及復水過程中,杜鵑紅山茶的水分適應機制可應用到其引種和花卉生產中:
(1)干旱脅迫初期,葉綠素各熒光參數產生明顯的變化,表明脅迫對杜鵑紅山茶葉片PSⅡ產生了影響,PSⅡ潛在活性受損,原初光能捕獲能力與光合電子傳輸能力下降,光合作用原初反應過程受抑制;而之后各個熒光參數變化的幅度減緩或恢復,暗示在PSⅡ系統對干旱脅迫變化可以形成一個相對的適應期,有一定的保護機制,一定程度的干旱處理有利于提高PSⅡ反應中心開放部分的比例。期間,杜鵑紅山茶干旱處理后10 d是Fo、Fv/Fm、Yield等主要參數變化拐點,可能是栽培管理中水分處理的較好時間點,這與紅山茶類植物“干透澆透”的栽培水分管理基本原則相一致。
(2)干旱脅迫處理15 d后,杜鵑紅山茶植株已進入嚴重脅迫狀態,在較長時間的干旱脅迫下,其葉片PSⅡ受到損害加重,會產生較大的損傷,如Fv/Fm和Yield的大幅下降。從各個參數變化的情況看,脅迫處理20 d對杜鵑紅山茶來說是重要的時間點,開始產生較為嚴重的干旱損傷。因此生產過程中應盡量避免這種極端的干旱脅迫。
(3)嚴重持續的干旱脅迫在復水處理后,杜鵑紅山茶葉片的葉綠素各熒光參數如Fo、Fv/Fm、Yield等均出現恢復性變化,光合系統功能得到迅速恢復,表明杜鵑紅山茶PSⅡ系統和抗氧化酶系統具較強的干旱脅迫修復能力,對干旱環境具有較好的適應能力。杜鵑紅山茶嫁接苗具有較強的耐旱能力,支持了前述的相關研究[14-15,17]。高溫、較高的空氣濕度是對嶺南地區城市夏季環境條件的模擬,而持續干旱脅迫是城市綠化中較常見的問題,干旱脅迫等實驗條件模擬說明杜鵑紅山茶可通過嫁接苗產業化發展并在城市環境中推廣應用。
[1] 汪松,解炎. 中國物種紅色名錄[M]. 北京:高等教育出版社,2004.
[2] 張宏達,任善湘. 中國植物志第四十九卷第三分冊[M]. 北京:科學出版社,1998.
[3] 羅曉瑩. 杜鵑紅山茶保護生物學研究[D]. 廣州:華南農業大學,2006.
[4] 王仲郎,王霜,梁靜,等. 珍稀植物杜鵑紅山茶的核型及育種學意義//中國首屆茶花育種學術研討會論文集[C]. 2007:27-31.
[5] 羅曉瑩,莊雪影,楊躍生. 杜鵑紅山茶遺傳多樣性的ISSR分析[J]. 熱帶亞熱帶植物學報,2007,15(2):93-100.
[6] 劉玉玲. 杜鵑紅山茶主要性狀遺傳變異研究[D]. 廣州:華南農業大學,2009.
[7] 李天菲,林田,徐碧玉,等. 杜鵑紅山茶花粉萌發力及貯藏耐性的研究[J]. 生物技術通報,2008(S):239-243.
[8] 羅曉瑩,莫羅堅,莊雪影. 杜鵑紅山茶大小孢子發生及雌雄配子體發育研究[J]. 華南農業大學學報,2010,31(4):68-75.
[9] 羅曉瑩,唐光大,莫羅堅,等. 杜鵑紅山茶的傳粉生物學[J]. 生態學雜志,2011,30(3):552- 557.
[10] 王有兵,徐斌,張方秋,等. 杜鵑紅山茶的2n 花粉自然發生及其誘導初步研究[J]. 廣東林業科技,2011,27(6):9-15.
[11] 黎運樞,崔統華,鄭文經,等. 杜鵑紅山茶嫁接繁殖試驗[J]. 廣東林業科技,2004,20(3):37-38,49.
[12] 吳曉靜,鄧石婷,譚楊帆. 杜鵑紅山茶嫁接砧木選擇比較試驗[J]. 安徽農學通報,2008,14(14):120-121.
[13] 趙平麗,董斌. 杜鵑紅山茶特征特性及繁育技術研究進展[J]. 現代農業科技,2011(15):214-217.
[14] 劉紅曉,袁蓮蓮,劉楠,等. 杜鵑紅山茶的扦插苗、嫁接苗和砧木的光合作用特征[J]. 生態環境學報,2013,22(6):996-1000.
[15] 劉玉玲,劉信凱,諶光暉,等. 杜鵑紅山茶與3個山茶栽培品種光合日變化特性研究[J]. 廣東林業科技,2011,27(1):17-22.
[16] 張方秋,楊會肖,徐斌,等. 杜鵑紅山茶的光響應特性及其最適模型篩選[J]. 生態環境學報,2015,24(10):1599-1603.
[17] 吳劉萍,王廷芹,楊瑞. 珍稀瀕危植物杜鵑紅山茶嫁接苗對水分脅迫的生理響應[J]. 福建林業科技,2012,39(3):51-56.
[18] Bjorkman O,Demmig B. Photon yield of O2 evolution and chlorophyll fluorescence characteristics at 77K among vascular plants of diverse origins[J]. Planta,1987,170:489-504.
[19] Schreiber U,Bilger W,Klughammer C,et al.Applications of Chlorophyll Fluorescence in Photosynthesis Research,Stress physiology,Hydrobiology and Remote Sensing[M].Dordrecht:Kluer Academic Publishers,1988:15-55.
[20] 張守仁. 葉綠素熒光動力學參數的意義及討論[J]. 植物學通報,1999,16(4):444-448.
[21] 李曉,馮偉,曾曉春. 葉綠素熒光分析技術及應用進展[J]. 西北植物學報,2006,26(9):2186-2196.
[22] 趙琴,潘靜,曹兵,等. 氣溫升高與干旱脅迫對寧夏枸杞光合作用的影響[J]. 生態學報,2015,35(18):6016-6022.
[23] 劉全勇,盧錕,李澤,等. 水分脅迫對刨花潤楠幼苗生長及光合特性的影響[J]. 中南林業科技大學學報,2016,36(9):29-35,43.
[24] 張丹,任潔,王慧梅. 干旱脅迫及復水對紅松針葉和樹皮綠色組織光合特性及抗氧化系統的影響[J]. 生態學雜志,2016,35(10):2606-2614.
[25] 張仁和,鄭友軍,馬國勝,等.干旱脅迫對玉米苗期葉片光合作用和保護酶的影響[J]. 生態學報,2011,31(5):1303-1311.
[26] 鄒琦. 植物生理學實驗指導[M]. 北京:中國農業出版社,2000:11-12,72-75,159-174.
[27] Türkan I,Bor M,Zdemir F,et al. Differential responses of lipid peroxidation and antioxidants in the leaves of drought tolerantP. acutifoliusG ray and drought sensitiveP. vulgarisL. subjected to polyethylene glycol mediated water stress[J].Plant Science,2005,168:223-231.
[28] 李琳琳,李凱凱,朱純,等. 張氏紅山茶葉片適應于環境的解剖特征[J]. 中山大學學報(自然科學版),2010,49(5):91-97.

