立方液晶納米粒在MDCK-MDR1細胞模型中的攝取及攝取機制研究*
譚 寧,杜守穎,薛宇濤,譚 麗,陸 洋,李鵬躍
立方液晶納米粒,又稱納米立方體或脂質立方液晶納米粒是兩親性脂質和表面活性劑在水中自發形成的雙連續的立方液晶納米分散體系,即脂質和表面活性劑結合水形成立方液晶相,再以類似固體納米粒的形式分散在過量的水中形成分散體系[1],是一種新型的納米制劑。水溶性藥物可以包封在類脂立方液晶的水道中,脂溶性的藥物包封在脂質雙分子層中,兩親性分子貫穿其中[2]。目前有研究證明立方晶在靜脈、口服、口腔黏膜、陰道黏膜、經皮給藥方面有明顯效果[3],一些中藥中成分如丹酚酸B、姜黃素、苦參堿也可包載入液晶納米粒中[4-6],應用前景廣泛。本實驗室前期已優化了立方液晶納米粒的處方和制備工藝,通過體外鼻腔灌流、細胞單層膜轉運實驗證明其有明顯增加藥物吸收和藥物轉運效果。
MDCK-MDR1細胞是研究藥物跨細胞膜轉運機制、預測藥物在體內的吸收、以及藥物間的相互作用、評價藥物安全性的一個較為理想的體外模型,可用于模擬血腦屏障模型[7-9]。納米粒子入胞有不同途徑,包括網格蛋白介導內吞、細胞膜穴樣凹陷介導內吞、大胞飲和非網格蛋白-非細胞膜穴樣凹陷介導內吞,其中前3種內吞途徑是納米粒子入胞的主要內吞途徑[10]。與脂溶性藥物相比,水溶性藥物不易進入細胞。為考察液晶納米粒是否可增加水溶性物質透過MDCK-MDR1細胞的能力,以及確定液晶納米粒進入細胞的通路。本實驗采用鈣黃綠素作為水溶性標準熒光物質,考察液晶納米粒的攝取及攝取機制。
1 儀器與材料
1.1 細胞株 MDCK-MDR1細胞,由浙江大學曾蘇教授惠贈。
1.2 藥物與試劑 鈣黃綠素(Calcein,Aladdin)、單油酸甘油酯(浙江嘉興瑪雅試劑)、泊洛沙姆407(北京鳳禮精求商貿有限公司)、甘油(北京化工廠,分析純)、維生素 E 醋酸酯(Adamas-beta,99%);非律平(Filipin,Harvy Bio)、細胞松弛素 D(Phytoalexins D,Aladdin)、氯丙嗪(CPZ,Sigma)、2-去氧-D-葡萄糖(2-D G,Alfa Aesar);胎牛血清(F BS,Gib-co)、DMEM培養基(Macgene)、0.25%胰蛋白酶(Macgene)、磷酸緩沖鹽溶液(PBS,Amresco)、Hank’s平衡鹽溶液(HBSS,Invitrogen)。
1.3 主要儀器 RE52CS旋轉蒸發儀(上海亞榮生化儀器廠);電子分析天平(Sartorius BT 125D型,北京賽多利斯科學儀器有限公司);二氧化碳培養箱(seriesⅡ型,Thermo);流式細胞儀(FACSCantoⅡ型,BD);倒置顯微鏡(CKX-41 型,Olympus)。
2 方法
2.1 鈣黃綠素液晶納米粒(Cal-LCNPs)的制備 選用薄膜分散法制備液晶納米粒。將處方量鈣黃綠素溶解在甘油-水中,作為水相;處方量的甘油單油酸酯(GMO)等油相,采用薄膜分散法均勻涂布在圓底燒瓶玻璃壁內表面。將水相倒入圓底燒瓶中,加玻璃珠后,旋轉水合得到250μg/mL鈣黃綠素液晶納米粒溶液。得到的葛根素液晶納米粒包封率用紫外-分光光度計測定包封率可達94.28%。
2.2 細胞培養 MDCK-MDR1細胞常規復蘇后,培養于含10%FBS和1%雙抗的DMEM培養液中,置于 CO2培養箱(37℃),5%CO2,相對濕度 95%條件下培養。隔日更換培養基,當細胞達80%以上匯合時,以0.25%胰酶消化,按1∶3傳代。取對數生長期細胞進行實驗。
2.3 MTT細胞毒性實驗
2.3.1 溶液的配制 用空白HBSS溶解鈣黃綠素制備成 1、5、10、20、25、40、50 μg/mL 溶液為 Cal組;HBSS 將 Cal-LCNPs分別稀釋 5、10、20、25、50、100 倍為Cal-LCNPs組。
2.3.2 MTT法 MTT法原理是利用活細胞線粒體中的琥珀酸脫氫酶能使外源性黃色可溶性MTT[3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽]還原為不溶于水的藍紫色結晶甲瓚并沉積在細胞中,而死細胞無此功能。DMSO能溶解細胞中的甲瓚結晶,用酶標儀在490 nm波長處測定其吸光度值(OD值)[11]。常規條件下分別培養MDCK-MDR1細胞至70%~80%匯合時,消化細胞,以DMEM培養基(含10%FBS)終止消化,用移液器輕輕吹打后,離心棄去上清液,再加入新鮮的DMEM培養基,制得單個細胞懸液,將細胞密度調整為5×104個/mL,將細胞接種于96孔細胞培養板中,每孔100μL。培養24 h后,按照上述分組方式給藥。培養箱培養24 h后每孔加入MTT溶液20μL,37℃孵育4 h,棄去孔內培養上清液,每孔加入150μLDMSO,振蕩10min,使甲臜充分溶解。在酶聯免疫檢測儀上測定各孔OD值,記錄結果。選取細胞存活率≥95%的藥物濃度用于轉運實驗[9]。
2.4 Cal-LCNPs的MDCK-MDR1細胞攝取實驗 將生長至80%~90%匯合的細胞,以0.25%胰酶消化后DMEM培養基稀釋成密度4×105個/mL接種于12孔板。置于37℃,5%CO2條件下常規。生長24 h后細胞棄去培養基,用PBS洗3次后,37℃的HBSS孵育15 min,然后每組分別加入0.5 mL的Cal-LCNPs HBSS稀釋溶液和10μg/mL Cal HBSS溶液,放入37℃,5%CO2培養箱培養。分別于 0.5、1、1.5、2 h 吸棄未吸收的藥液,用冷的PBS洗3次后,每孔加0.25 mL胰酶培養箱中消化;待細胞消化完全后,轉移至2 mL離心管中,2 000 r/min離心5 min;棄去上清液,細胞用0.5 mLHBSS稀釋,吹打。處理好的樣品立即用流式細胞儀檢測細胞內鈣黃綠素的熒光強度,繪制曲線,比較兩組吸收情況。鈣黃綠素的最大激發和發射波長分別為497 nm和518 nm。
2.5 Cal-LCNPs的MDCK-MDR1細胞攝取機制實驗 采用通路抑制劑法研究MDCK-MDR1對立方液晶納米粒的攝取機制。將生長至80%~90%匯合的細胞,以0.25%胰酶消化后DMEM培養基稀釋成密度4×105個/mL接種于12孔板。置于37℃,5%CO2條件下常規24 h培養后棄去培養基換成含通路抑制劑的HBSS,培養0.5 h,各組溶液濃度為10μg/mL非律平、2μmol/L細胞松弛素D、10μg/mL氯丙嗪、50 mmol/L 2-D-去氧葡萄糖,空白對照組加入空白HBSS。0.5 h后加入含Cal-LCNPs的培養基培養2 h。采取2.4項下相同方法消化、離心、稀釋、吹打。處理好的樣品立即用流式細胞儀檢測細胞內鈣黃綠素的熒光強度。研究數據經SAS8.2軟件處理。所有數據以均數±標準差(x±s)表示,組間比較采用單因素方差分析,以P<0.05為差異有統計學意義。
3 結果
3.1 細胞毒性實驗 如圖1所示,在實驗選取的鈣黃綠素濃度范圍1~50μg/mL,Cal-LCNPs稀釋25倍(Cal濃度約10μg/mL)以上對MDCK-MDR1細胞無毒性。所以,選取10μg/mLCal溶液及Cal-LCNPs稀釋25倍進行細胞攝取及機制研究實驗。
3.2 MDCK-MDR1 對 Cal,Cal-LCNPs的攝取結果 由圖2中攝取曲線可見,在相同濃度下,MDCKMDR1 2 h內細胞對Cal-LCNPs胞內攝取量明顯多于對Cal的攝取。以時間為自變量,胞內熒光強度為因變量,將2個攝取曲線進行方程擬合發現,Cal攝取符合零級方程(Y=31t+73.833,r=0.966 4),Cal-LCNPs攝取符合一級方程[Ln(Y)=0.289 3t+4.348 1,r=0.925 1]。實驗結果顯示立方液晶納米粒不僅可以增加MDCK-MDR1對Cal的攝取也可改變細胞的攝取行為。
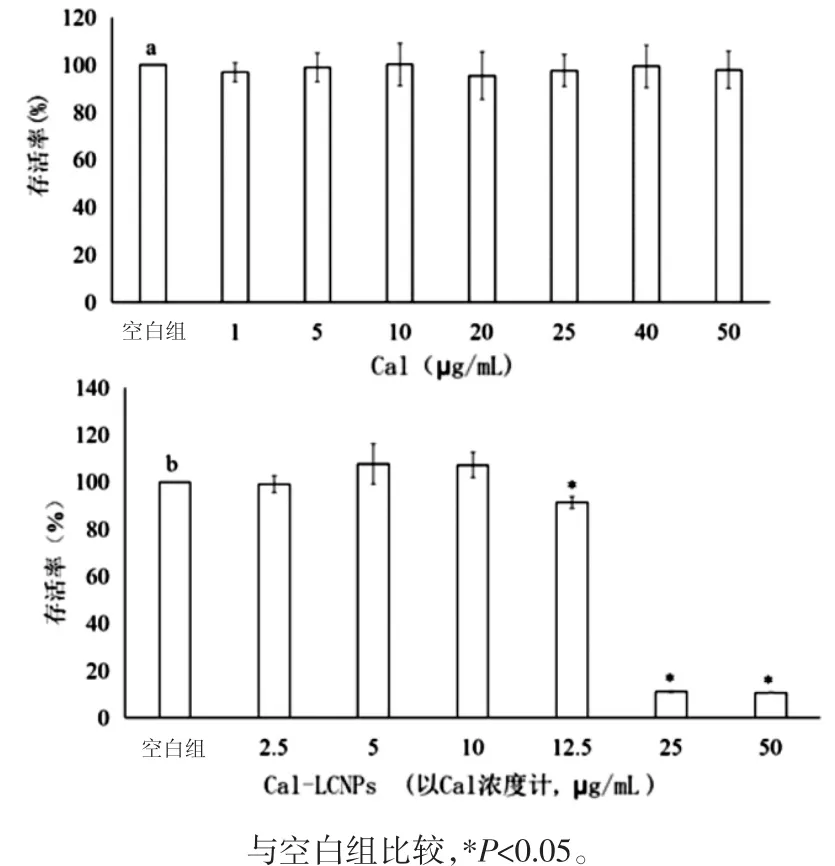
圖1 MDCK-MDR1細胞MTT實驗結果(n=5)Fig.1 MTT test resultsof MDCK-MDR1 cells(n=5)

圖2 MDCK-MDR1細胞對Cal、Cal-LCNPs攝取曲線(n=3)Fig.2 Uptakecurvesof Cal and Cal-LCNPsin MDCK-MDR1 cells(n=3)
3.3 MDCK-MDR1對Cal-LCNPs的攝取機制考察 在含通路抑制劑的組別中,經過氯丙嗪(CPZ)、2-去氧葡萄糖(2-DG)孵育過的細胞內含熒光比空白組少,差異具有統計學意義(P<0.05)。證明細胞攝取機制與氯丙嗪和2-D-去養葡萄糖抑制通路有關。見圖3。
3 討論
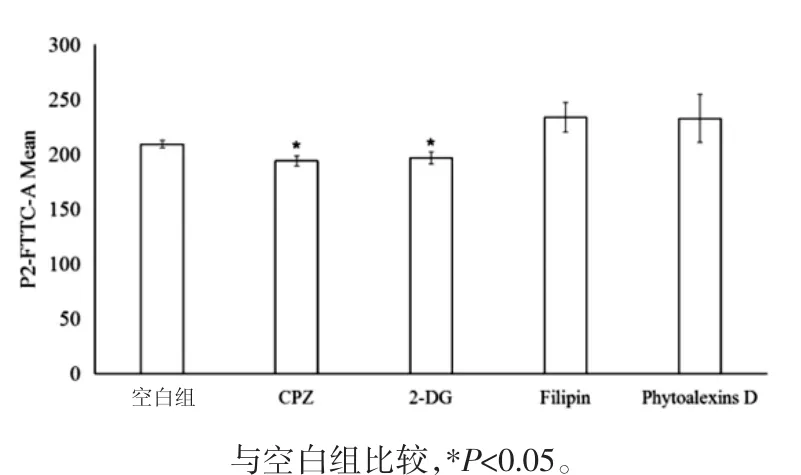
圖3 MDCK-MDR1細胞對含不同通路抑制劑的Cal-LCNPs溶液攝取(n=3)Fig.3 Uptake of Cal-LCNPs in MDCK-MDR1 cells treated with different inhibitors(n=3)
MDCK-MDR1細胞系是由MDCK細胞經人源MDR1轉染得到,是一種極性過表達P-gp的細胞系,和血腦屏障的外排作用非常類似,因而可利用MDCK-MDR1細胞作為血腦屏障藥物透過的快速篩選模型。一些由載體介導的藥物可以利用MDCK-MDR1細胞系,將其與被動擴散的物質區分開來。在細胞單層膜實驗研究中,發現立方液晶納米粒可明顯提高水溶性藥物葛根素的細胞吸收率。研究中細胞攝取實驗又得到液晶納米粒可通過胞內途徑增加吸收,并改變了入胞方式的結論。這提示小分子水溶性藥物可以通過立方液晶納米粒包裹改變入胞途徑,提高入胞能力。該結論為研究載有水溶性藥物立方液晶納米粒的細胞遞送過程提供參考和依據。微粒的內吞為能量依賴過程[12]。2-DG是細胞無法利用的碳源,50 mmol/L時可阻斷糖酵解。本實驗中,當2-DG與細胞孵育后與空白組相比,攝取能力減弱(P<0.05),證明細胞攝取液晶納米粒是內吞的能量依賴過程。
在細胞攝取納米制劑的4種通路類型中,細胞膜穴樣凹陷介導內吞將載體遞送至pH條件和生物條件緩和的小窩體內然后被轉運到內質網、高爾基體和胞漿中[13]。非律平是常用的小窩蛋白抑制劑,可抑制小窩蛋白形成從而抑制該途徑。大胞飲指在某些因素刺激下,細胞膜皺褶形成大且不規則的原始內吞小泡,它們被稱為大胞飲體。通常大胞飲作用能顯著地被細胞松弛素和秋水仙堿抑制,被抑制的微管和微絲在這個過程中扮演重要角色[14]。其中細胞膜穴樣凹陷介導內吞可避免溶酶體內聚集[15-16]。但本實驗研究證明當10μg/mL非律平、2μmol/L細胞松弛素D的參與抑制了2種途徑后,細胞內攝取的熒光強度和空白對照組相比并未明顯降低,這證明液晶納米粒并非通過細胞膜穴樣凹陷介導或者大包飲途徑進入細胞。網格蛋白介導的內吞是各類納米顆粒內吞的主要途徑,在細胞膜表面存在附有網格蛋白包被的小窩和小泡,與相應配體(被內吞的分子)結合形成復合物后集中到細胞內面有網格蛋白的質膜區,形成小窩,凹陷,最終與質膜脫離進入細胞漿,形成內體。早期內體成熟成為晚期內體,最后和其余內吞或溶酶體融合[17]。氯丙嗪可與核內體作用,使其脫落,從而阻斷該途徑。結果顯示液晶納米粒是以此途徑進入細胞。提示液晶納米粒載藥進入細胞后可能會與溶酶體結合,這為之后液晶納米粒制劑設計及給藥途徑選擇提供依據。
立方液晶納米粒與傳統脂質體相比具有穩定性好、包封率高、雙分子層面積大、可無限稀釋等優勢[18]。有報道稱[19],它既能夠包結水溶性藥物如四環素、馬來酸噻嗎洛爾、頭孢唑啉等,也能包結油溶性藥物如阿司匹林和維生素E等。其他的一些藥物如溴丙胺太林、甲硝唑、馬來酸氯苯那敏和鹽酸普萘洛爾以及蛋白質類藥物血紅蛋白和胰島素也能包結在立方液晶中。本實驗研究結果提示立方液晶納米粒因其可改變水溶性藥物進入細胞的方式、影響細胞吸收,在中藥水溶性成分遞藥系統中具有良好應用前景。
[1]Spicer PT.Progress in liquid crystalline dispersions:cubosomes[J].Current Opinion in Colloid and Interface Science,2005,10(5):274-279.
[2]Worle G,Drechsler M,Koch MHJ,et al.Influence of composition and prepararion parameters on the properties of aqueous monoolein dispersions[J].International Journal of Pharmaceutics,2007,329(1):150-157.
[3] 陳 琰,陳建明,陳 酩,等.立方晶及其在藥劑學中的研究進展[J].第二軍醫大學學報,2009,30(7):834-839.
[4] 郭秀君,劉志東,黃 瑜,等.丹酚酸B立方液晶納米粒的制備及大鼠在體腸吸收[J].天津中醫藥大學學報,2014,33(3):177-180.
[5] 蘇 旬,賀秀麗,劉秀菊,等.姜黃素脂質立方液晶納米粒的制備及理化性質研究[J].中藥材,2012,35(2):296-299.
[6] 田 圓,吳偉剛,王家平,等.苦參堿立方液晶納米粒的制備及質量控制的研究[J].今日藥學,2015,35(2):83-85.
[7] 陳振振,杜守穎,陸 洋,等.艾片與麝香酮芳香開竅作用機制研究[J].中藥材,2014,37(3):460-464.
[8] 劉 強,高小玲,柴逸峰,等.四氫帕馬丁在MDCK-MDR1細胞系中的跨膜轉運機制[J].藥學服務與研究,2012,12(1):34-37.
[9] 張承悅,趙 攀,施 喆,等.芳香開竅化合物對MDCK-MDR1單層細胞透過性的影響[J].中國藥學(英文版),2011,20(6):584-589.
[10]厲 群,吳賽偉,梁文權,等.鈣黃綠素脂質體的細胞轉運及其機制研究[J].中國藥學雜志,2014,49(15):1321-1326.
[11]蔡文濤.MTT法和CCK-8法檢測中藥抗病毒活性成分細胞毒性的比較[J].湖北大學學報(自然科學版),2017,19(3):305-310.
[12]Managit C,Kawakami S,Yamashita F,et al.Uptakechracteristics of galactosylated emulsion by HepG2 hepatoma cells[J].International Journal of Pharmaceutics,2005,301(1-2):255-261.
[13]Doherty GJ,Mcmahon HT.Mechanisms of endocytosis[J].Annul Review of Biochemistry,2009,78(78):857-902.
[14]秦綠葉,劉 爽,汪沉然,等.巨胞飲的機制及功能的研究進展[J].生理科學展,2006,37(1):41-44.
[15]Cohen AW,Hnasko R,Schubert W,et al.Role ofcaveolae and caveolinsinhealth and disease[J].Physiological Reviews,2004,84(4):1341-1379.
[16]Conner SD,Schmid SI.Regulated portals of entry into the cell[J].Nature,2003,422,(6927):37-44.
[17]Rappoport JZ.Focusing on clathrin-mediated endocytosis[J].Biochemical Journal,2008,412(3):415-423.
[18]Barauskas J,Johnsson M,Joabsson F,etal.Cubic phasenanoparticles(Cubosome):priciplesfor controllingsize,structure,and stability[J].Langnuir,2005,21(6):2569-2577.
[19]王志寧,鄭利強.類脂立方液晶作為藥物載體的研究[J].化學進展,2005,17(3):417-422.

