何種乳酸指標更能有效預測高乳酸血癥感染性休克患者14 d病死率
李 雯 任 珊,2 姜 利 朱 波 姜 琦 席修明*
(1.首都醫科大學附屬復興醫院危重癥醫學科,北京 100069;2.河北省人民醫院重癥醫學科,石家莊 050051)
在感染性休克患者中,氧耗大于氧供,引起組織缺氧,進而促進了組織無氧代謝過程的進行。血乳酸濃度隨著細胞無氧代謝的增加而升高,是感染性休克患者組織灌注不足的重要標志物。研究[1]表明,在感染性休克患者中,乳酸濃度的增加與不良預后相關,如果早期進行干預,可改善患者預后。
臨床上常用的乳酸預測指標有初始乳酸值、乳酸清除率及乳酸曲線下面積(area under curve, AUC)等。3種乳酸指標評估感染性休克患者預后各有利弊。研究[2]結果表明,高乳酸血癥的持續時間及嚴重程度與感染性休克患者的病死率相關。初始乳酸濃度僅代表了患者病情的初始狀態,并不能動態反映病情變化,相反,乳酸清除率無法反映高乳酸血癥的嚴重程度。
近年來新興了一個叫作乳酸曲線下面積的概念,其定義為連續乳酸水平曲線下面積的總和,這可以反映高乳酸血癥的嚴重程度和持續時間。筆者記錄了連續5個時間點的乳酸值,計算乳酸變量和患者病死率的關系。有研究[3]表明在兒童感染性休克中,乳酸曲線下面積能獨立預測患兒28d病死率,是評估預后的有效指標,但在成年感染性休克患者中研究結果不甚明了。
1 對象與方法
1.1 研究對象
本研究為單中心回顧性觀察研究,納入自2013年1月至2016年1月入住首都醫科大學附屬復興醫院重癥監護室(intensive care unit, ICU),年齡大于18周歲,診斷為感染性休克的患者,入組時間大于24 h,并在入組的第一個24 h內擁有連續5個以上乳酸值。感染性休克診斷按照2012版美國胸科醫師學會/危重病醫學共識會議的定義[4],排除病程5年內的惡性腫瘤、心肺復蘇術后、透析、肝衰竭、服用某些藥物如二甲雙胍、利奈唑胺等的患者,剔除病程中簽署了撤停協議及乳酸濃度<2.0 mmol/L的患者。
1.2 數據收集
共有103例成年感染性休克的患者列入本項研究,平均年齡(81.5±10.3)歲,82例(79.6%)患者為男性。按照14 d轉歸將患者分為死亡組(81例)和存活組(22例)。在電子病歷資料報表中記錄患者如下信息:性別、年齡、ICU住院時間、乳酸值、急性生理與慢性健康(Acute Physiology and Chronic Health Evaluation Ⅱ, APACHE Ⅱ)評分、器官功能不全數目及原發感染灶等資料。
記錄每名患者入選時0、6、12、18、24 h共計5個時刻的血乳酸值,計算6 h乳酸清除率及乳酸曲線下面積。
1.3 統計學方法
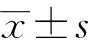
2 結果
2.1 研究人群的特點
在發病第14天時共81例患者死亡,病死率為78.6%(81/103)。本研究中,導致感染性休克的3大原發感染灶分別為呼吸道93.2%(96/103)、泌尿系統32.0%(33/103)和血流27.2%(26/103)。存活組與死亡組相比,原發感染灶差異無統計學意義。剔除過程中顯示,乳酸值小于2.0 mmol/L的患者總數共35例,其中死亡組共22例,14 d病死率為62.9%。與存活組相比,死亡組患者入住ICU時間更短[(8.7±5.4)dvs(23.6±7.9)d],更容易出現心血管系統(16.5%vs9.1%)、呼吸系統(77.8%vs68.2%)、肝臟(22.2%vs4.5%)和腎臟(62.9%vs31.8%)的功能障礙。詳見表1。


CharacteristicSurvival(n=22)Nonsurvival(n=81)PMale15(68.2)48(59.3)0.446Age/a81.0±10.082.0±11.00.973ICUstays/d23.6±7.98.7±5.40.001APACHEⅡ23.2±5.823.8±6.50.709Expectedmortality48.6±21.148.0±22.90.909Primarylesionlocation Lowerrespiratorytract20(90.9)76(93.8)0.996 Urinarysystem 8(36.4)25(30.8)0.624 Bloodstream 3(13.6)23(28.4)0.158 Abdominal 3(13.6)11(13.6)1.000 Catherization 1(4.5) 8(9.9)0.432 Skin 2(9.1) 2(2.5)0.199Organdysfunction Cardiovascular 2(9.1)17(16.5)0.334 Respiratory15(68.2)63(77.8)0.352 Renal 7(31.8)51(62.9)0.009 Heptic 1(4.5)18(22.2)0.113 Hematologic 4(18.2) 9(11.1)0.601
ICU:intensive care unit;APACHEⅡ:Acute Physiology and Chronic Health Evaluation Ⅱ.
2.2 死亡組與存活組在不同時間點乳酸值的比較
采用兩因素重復測量方差分析方法,判斷死亡組與存活組兩組患者不同時間點乳酸值的變化。通過對學生化殘差(studentized residuals)的分析,經Shapiro-wilk檢驗和Kolmogorov-Smirnov檢驗,各組數據服從正態分布(P>0.05),可以看到,死亡組與存活組相比較,隨著時間的推移,死亡組的乳酸值濃度呈上升趨勢,而存活組的乳酸濃度呈下降趨勢(圖1),兩條線不平行,提示兩組患者內因素存在交互作用;通過學生化殘差是否超過±3倍的標準差判斷,各組數據無異常值。死亡終點和時間點的交互作用對乳酸濃度的影響有統計學意義[F(2.344,49.220)=14.033,P<0.001],因此,對每個時間點進行兩兩比較,除初始時間點外,其余4個時間點,兩組乳酸值均存在差異,且死亡組高于存活組,詳見表2。
2.3 不同乳酸指標預測病死率的ROC曲線下面積比較
乳酸曲線下面積及24 h乳酸值可以有效預測14 d病死率,兩兩比較顯示,24 h乳酸值的AUC值、陽性預測值及靈敏度等都明顯高于初始乳酸值、乳酸清除率及乳酸曲線下面積,該指標對病死率的預測價值最高(圖2,表3)。

圖1 不同時間點死亡組與存活組乳酸值趨勢Fig.1 Trend of lactate value in twogroups at different time points

圖2 各個乳酸預測指標預測患者病死率ROC曲線下面積對比表Fig.2 ROC curves of the different lactate levelsas a predictor of mortality
ROC:receiver operating characteristic.


CharacteristicSurvivalNonsurvivalDifferenceP95%CIInitiallactate2.93±1.23.79±2.260.8550.111-2.13-1.9226h-lactate2.68±1.764.63±2.851.9590.0120.473-3.44512h-lactate2.33±0.866.50±4.334.1730.0002.201-6.14418h-lactate2.12±0.887.84±4.605.7230.0003.566-7.87924h-lactate1.99±0.928.87±4.966.8770.0004.575-9.179
PPV:positive predictive value;NPV:negative predictive value;AUC:area under curve.
3 討論
本文通過回顧性研究,納入103例年齡大于18周歲的感染性休克患者,以14 d為研究終點分為死亡組與存活組,兩組比較顯示,在研究人群的基線水平中,除了ICU住院時間及18、24 h乳酸值及乳酸曲線下面積外,其余各項指標之間差異無統計學意義。針對兩組患者疾病嚴重程度的問題,入組患者剔除肝衰竭及接受連續腎臟替代治療(continuous renal replacement therapy, CRRT)的患者,同時納入了APACHEⅡ評分進行評估,兩組患者間差異無統計學意義(P=0.709),表明患者病情起點差異無統計學意義。患者的治療為同一醫療團隊,液體復蘇及抗感染抗生素選擇方面也無明顯的治療原則的偏倚。乳酸曲線下面積及24 h乳酸值都能有效預測患者14 d病死率,且24 h乳酸值預測價值明顯高于其余乳酸預測指標。與存活組相比,死亡組中乳酸曲線下面積及24 h乳酸濃度更高。
高乳酸血癥嚴重影響內環境的穩定,研究[5-8]表明,乳酸值越高,說明患者機體缺血缺氧越明顯,器官功能障礙的發生率及病死率也越高。在嚴重感染和感染性休克時血乳酸濃度的增加反映了由于氧供減少或組織低灌注而引起的氧化磷酸化損害的增加[9]。Rimachi等[10]報道有65%的感染性休克患者存在高乳酸血癥,其中只有75%的患者表現出乳酸/丙酮酸比率上升,說明在休克早期,部分膿毒癥相關的高乳酸血癥(sepsis-associated hyperlactatemia,SAHL)可能并非僅僅是由缺氧引起的,而是繼發于應激導致的無氧酵解增加,更重要的是,有證據[11]表明高乳酸血癥可以通過增加乳酸的氧化來提高生物能量的利用效率。在這種條件下,乳酸增長也可理解為:隨著疾病的惡化,機體產生的一種適應性的良性的應對策略。
2012年拯救膿毒癥運動指南中建議:膿毒癥及感染性休克患者的初始乳酸值大于正常值上限的兩倍時應該給予及時的復蘇[4]。在Hernandez等[12]的302例感染性休克患者隊列研究中也顯示,乳酸性酸中毒與乳酸正常的患者相比,病死率差異具有統計學意義。然而,越來越多的研究[13]表明,低濃度的血乳酸濃度也與死亡風險增加相關,Singer等[14]報告中提出乳酸值小于2.0 mmol/L的靈敏度較差,正常乳酸值仍不能排除膿毒癥的診斷。本研究也顯示乳酸值小于2 mmol/L的患者總數共35例,其中死亡組共22例,14 d病死率為62.9%。與高乳酸血癥相關的感染性休克相比,病死率差異并無統計學意義(P=0.064)。
初始乳酸值只代表患者最初的狀態,單純監測某一時刻的血乳酸濃度只能說明此刻組織氧供和氧耗的情況,故初始乳酸濃度與病死率無顯著相關性,與乳酸清除率及乳酸曲線下面積相比,單獨的初始乳酸濃度并不能有效預測轉歸[15]。本研究結果同樣顯示初始乳酸值的預后評估價值并無統計學意義,且初始乳酸值小于2.0 mmol/L的患者比例可達11.3%。與初始乳酸濃度相比,18 h和24 h的乳酸濃度更能有效預測患者病死率,與Filho等[16]的研究結果相似。
在評估復蘇有效性方面,連續測量的乳酸值,與單個時間點的乳酸濃度相比可提供更重要的信息,24 h內乳酸降至正常的患者病死率較低。連續動態乳酸監測則可反映復蘇即時效果,而乳酸清除率即為動態監測的典型指標,其能夠反映血乳酸濃度的動態變化趨勢和復蘇效果,但也有其局限性,比如不能反映高乳酸血癥的嚴重程度,故不能有效的評估感染性休克患者的預后。本次研究中,與存活組相比,死亡組乳酸清除率更低,但差異無統計學意義。
感染性休克早期發生的器官損傷和器官功能障礙的數量取決于器官暴露于缺氧的程度和時間長短[17-18]。乳酸曲線下面積的計算方式能夠彌補其他乳酸指標的諸多缺陷,它不僅能夠反映感染性休克早期的乳酸持續時間、乳酸升高的嚴重程度,更為重要的是,它能夠反映乳酸的蓄積程度。在本研究中,乳酸曲線下面積對成年膿毒癥休克患者的病死率具有較好的預測價值。乳酸曲線下面積有助于早期識別具有高病死率的感染性休克患者。這與Kim等[3]及張井曉等[19]的研究結論相同。
另一種乳酸預測指標為早期乳酸正常化,本研究得出24 h乳酸值可有效預測高乳酸血癥感染性休克患者14 d病死率,與Suistomma等[20]的研究結果相似,血乳酸濃度在24 h內恢復至正常水平的膿毒癥患者幾乎100%存活,而在6 h內血乳酸濃度持續升高的膿毒癥患者往往有較高的病死率。若患者6 h以后血乳酸>4 mmol/L,說明經過液體復蘇后其乳酸清除率不佳,更能有效地評估患者預后,反映出延遲開始的液體復蘇會增加病死率。
綜上,臨床常用的多種乳酸預測指標在評估患者預后方面各有利弊。初始乳酸值可以提示患者病情的嚴重程度,但不能反映病情動態變化;乳酸清除率可反映機體的狀態、疾病的發展,但不能反映病情的嚴重程度;乳酸曲線下面積可以同時反映高乳酸血癥的持久性及嚴重性但不能反映患者病情變化;血乳酸濃度在24 h內恢復至正常水平反映了膿毒癥患者可降低其發生持續器官功能障礙的風險。24 h乳酸對老年感染性休克患者預后的預測價值優于其他乳酸指標,具有較好的臨床應用前景。動態監測乳酸變化,使用24 h乳酸值評估患者病死風險,有利于指導早期液體復蘇和其他治療,從而改善老年感染性休克患者的預后。
同時,對于乳酸曲線下面積的計算方法方面,兩時間點連線只能用直線代替,無精確的曲線走向,計算結果也只是粗略積分,因此,筆者只能更加細化監測時間點,增加監測密度。本研究中,入組患者需24 h內有連續5個時刻的乳酸值,剔除了53例乳酸缺失患者,一定程度上影響了分析。今后仍需要大規模、多中心、前瞻性的研究來進一步探討24 h乳酸是否是高乳酸血癥感染性休克患者14 d病死率的最佳預測指標。
[1] Marshall J C,Vincent J L,Fink M P,et al. Measures,markers, and mediators: toward a staging system for clinical sepsis. A report of the fifth toronto sepsis roundtable, toronto, ontario, canada, October 25-26, 2000[J]. Crit Care Med, 2003, 31(5): 1560-1567.
[2] Scott H F, Brou L, Deakyne S J, et al. Association between early lactate levels and 30-day mortality in clinically suspected sepsis in children[J]. JAMA Pediatr, 2017, 171(3):249-255.
[3] Kim Y A, Ha E J, Jhang W K,et al. Early blood lactate area as a prognostic marker in pediatric septic shock[J].Intensive Care Med,2013,39(10):1818-1823.
[4] Dellinger R P, Levy M M, Rhodes A, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock, 2012[J]. Intensive Care Med,2013, 39(2):165-228.
[5] Nguyen H B, Rivers E P, Knoblich B P,et al. Early lactate clearance is associated with improved outcome in severe sepsis and septic shock[J]. Crit Care Med,2004,32(8):1637-1642.
[6] Jansen T C, van Bommel J, Woodward R, et al. Association between blood lactate levels, sequential organ failure assessment subscores, and 28-day mortality during early and late intensive care unit stay: a retrospective observational study[J]. Crit Care Med,2009,37(8):2369-2374.
[7] Bakker J, Gris P, Coffernils M, et al. Serial blood lactate levels can predict the development of multiple organ failure following septic shock[J]. Am J Surg, 1996, 171(2):221-226.
[8] BernardinG,Pradier C,Tiger F,et al. Blood pressure and arterial lactate level are early indicators of short term survival in human septic shock[J]. Intensive Care Med, 1996,22(1):17-25.
[9] Jansen T C, van Bommel J, Mulder P G, et al. The prognostic value of blood lactate levels relative to that of vital signs in the pre-hospital setting: a pilot study[J]. Crit Care,2008, 12(6):R160.
[10] Rimachi R, Bruzzi de Carvahlo F, Orellano-Jimenez C, et al. Lactate/pyruvate ratio as a marker of tissue hypoxia in circulatory and septic shock[J]. Anaesth Intensive Care, 2012,40(3):427-432.
[11] Garcia-Alvarez M, Marik P, Bellomo R. Sepsis-associated hyperlactatmia[J]. Crit Care,2014,18(5):503.
[12] Hernandez G, Castro R, Romero C, et al. Persistent sepsis-induced hypotension without hyperlactatemia: is it really septic shock[J]. J Crit Care,2011, 26(4):435.e9-14.
[13] Wacharasint P, Nakada T A, Boyd J H, et al. Normal-range blood lactate concentration in septic shock is prognostic and predictive[J]. Shock,2012, 38(1):4-10.
[14] Singer A J, Taylor M, Domingo A, et al.Diagnostic characteristics of a clinical screening tool in combination with measuring bedside lactate level in emergency department patients with suspected sepsis[J]. Acad Emerg Med,2014, 21(8): 853-857.
[15] 崔麗丹,蘇軍.動態監測血乳酸在膿毒性休克患兒預后評估中的臨床價值[J].中國現代藥物應用,2012, 6(4):49-50.
[16] Filho R R, Rocha L L, Corrêa T D, et al. Blood lactate levels cutoff and mortality prediction in sepsis-time for a reappraisal? a retrospective cohort study[J]. Shock, 2016,46(5):480-485.
[17] 連曉芳,閻書彩.氧代謝指標在感染性休克中的應用進展[J].臨床誤診誤治,2015,28(9):110-113.
[18] 夏為,卞曉華,董士民.膿毒癥患者的臨床特征及死亡相關因素分析[J].解放軍醫藥雜志,2016,28(5):91-96.
[19] 張井曉,尹梅,陳曉梅,等.乳酸曲線下面積對老年膿毒性休克患者預后評估的價值[J].中華醫學雜志,2016,96(33):2640-2643.
[20] Suistomma M,Ruokonen E,Kari A,et al. Time-pattern of lactate and lactate to pyruvate ratio in the first 24 hours of intensive care emergency admissions[J].Shock,2000,14(1):8-12.

