APTO-253對紫杉醇或順鉑處理的卵巢癌SKOV3及OVCAR3細胞凋亡及細胞周期的影響
王寶金,申愛榮,付喜玲,李 霞,王新月,任琛琛
鄭州大學第三附屬醫院婦科 鄭州 450052
目前腫瘤切除術及術后輔以鉑類藥物(順鉑)聯合紫杉醇為主的基礎化療是標準的卵巢癌治療方法。但是因卵巢癌起病隱匿,大多數患者確診時已是晚期;并且該病極易發生浸潤、轉移,手術難以根除,術后易復發。APTO-253在美國已經被批準應用于一些實體腫瘤的Ⅰ期臨床試驗。既往的研究[1]證實APTO-253在人類結腸癌、白血病、腎癌和前列腺癌等癌細胞系中具有抗腫瘤細胞增殖活性的作用,能夠阻滯細胞周期、促進細胞凋亡。為了了解小分子誘導劑APTO-253在卵巢癌細胞中對化療藥物療效的影響,作者觀察了APTO-253對紫杉醇或順鉑處理的SKOV3及OVCAR3細胞凋亡及細胞周期的影響,現將結果報道如下。
1 材料與方法
1.1細胞、試劑及儀器卵巢癌細胞株:自美國菌種中心購買的SKOV3和OVCAR3細胞株。主要試劑:紫杉醇、順鉑購于美國Sigma公司;胎牛血清購于美國HyClone公司;Caspase-3/7試劑盒購于美國Promega公司;P21、cMyc、CDK6、剪切后的聚腺苷二磷酸-核糖聚合酶(Cleaved-PARP)、剪切后的半胱氨酸天冬氨酸蛋白酶-3(Cleaved-Caspase-3)一抗抗體均購于美國Cell Signaling公司,二抗抗體均購于美國Santa Cruz公司。Western blot蛋白印跡轉膜儀購于美國伯樂公司,蛋白印跡電泳儀購于美國英杰公司;熒光免疫顯微鏡購于日本尼康公司。
1.2細胞培養取出細胞凍存管,分別將完全溶解的SKOV3和OVCAR3細胞(各1 mL)加入3 mL含有體積分數10%已滅活胎牛血清和100 U/mL青霉素及100 mg/L鏈霉素的DMEM培養液中培養。
1.3SKOV3和OVCAR3細胞凋亡及Cleaved-PARP、Cleaved-Caspase-3蛋白表達水平的檢測取對數生長期的SKOV3和OVCAR3細胞種植于96孔板中,8 000個/孔,設3個復孔,體積分數10% DMEM完全培養液培養過夜,細胞饑餓后,分別加入5 μmol/L APTO-253、4 mg/L順鉑或40 nmol/L紫杉醇、5 μmol/L APTO-253聯合4 mg/L順鉑或40 nmol/L紫杉醇的無血清DMEM培養液,采用Caspase-3/7活性方法檢測細胞凋亡情況,結果以熒光強度表示。6孔板培養SKOV3和OVCAR3細胞,分組及處理方法同上,提取總蛋白,測定蛋白濃度并配平及變性,進行電泳、電轉膜、封閉液封閉、一抗(Cleaved-PARP和Cleaved-Caspase-3)及二抗(兔抗人)孵育、顯色曝光,分析SKOV3和OVCAR3細胞Cleaved-PARP及Cleaved-Caspase-3蛋白表達水平。
1.4APTO-253處理后SKOV3和OVCAR3細胞周期及細胞周期相關蛋白(P21、cMyc、CDK6)表達水平的檢測用6孔板培養SKOV3和OVCAR3細胞,饑餓24 h,用含5 μmol/L APTO-253的無血清DMEM培養細胞24 h,取2×106個細胞懸浮于5 mL PBS中,離心后重懸細胞。轉移細胞懸液至含體積分數70%乙醇的離心管中離心后,于5 mL PBS中懸浮沉淀細胞,等待60 s,離心5 min。在1 mL PI染色溶液中懸浮沉淀細胞,在室溫下孵育30 min,流式細胞儀檢測細胞周期。在SKOV3和OVCAR3細胞中分別于含5 μmol/L APTO-253的無血清DMEM培養液處理細胞的不同時間點(0、1、3、6、12、24 h)收集、裂解細胞,測定蛋白濃度并配平及變性,進行電泳、電轉膜、封閉液封閉、一抗(P21、cMyc、CDK6)和二抗(兔抗人及鼠抗人)孵育、顯色曝光,分析細胞周期相關蛋白P21、cMyc、CDK6的表達水平。實驗重復3次。
1.5統計學處理實驗數據采用SPSS 21.0進行分析。不同處理組間SKOV3、OVCAR3細胞凋亡情況的比較采用析因設計的方差分析;空白對照組和APTO-253組間細胞周期的比較采用兩獨立樣本的t檢驗。檢驗水準α=0.05。
2 結果
2.1APTO-253聯合化療藥物紫杉醇或順鉑處理后SKOV3和OVCAR3細胞凋亡及Cleaved-PARP、Cleaved-Caspase-3蛋白表達的檢測SKOV3和OVCAR3細胞凋亡檢測結果見表1、2,Cleaved-PARP和Cleaved-Caspase-3蛋白表達情況見圖1。

表1 APTO-253和紫杉醇單獨及聯合處理后SKOV3、OVCAR3細胞凋亡情況的比較(n=3)
SKOV3細胞:FAPTO-253=237.671,F紫杉醇=479.768,F交互=237.671,P均<0.001;OVCAR3細胞:FAPTO-253=84.439,F紫杉醇=910.963,F交互=20.944,P均<0.001
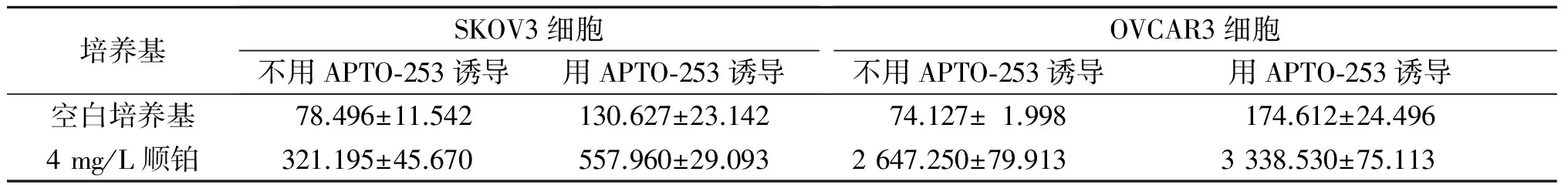
表2 APTO-253和順鉑單獨及聯合處理后SKOV3、OVCAR3細胞凋亡情況的比較(n=3)
SKOV3細胞:FAPTO-253=124.026,F順鉑=667.161,F交互=50.658,P均<0.001;OVCAR3細胞:FAPTO-253=256.013,F順鉑=14 819.557,F交互=138.311,P均<0.001
2.2APTO-253誘導后SKOV3和OVCAR3細胞周期、細胞周期相關蛋白(P21、cMyc、CDK6)表達的檢測APTO-253處理后SKOV3和OVCAR3細胞周期的變化見表3、4。可知,APTO-253可導致G1期阻滯,S期和G2/M期細胞減少。不同時間點細胞周期相關蛋白(P21、cMyc、CDK6)表達水平的檢測結果見圖2。可知,隨著作用時間的延長,細胞周期相關蛋白CDK6和cMyc表達水平下降,而P21蛋白表達水平升高。
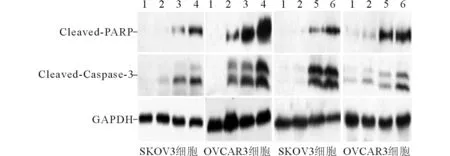
1:空白組;2:5 μmol/L APTO-253組;3:40 nmol/L紫杉醇組;4:5 μmol/L APTO-253聯合40 nmol/L紫杉醇組;5:4 mg/L順鉑組;6:5 μmol/L APTO-253聯合4 mg/L順鉑組圖1 APTO-253、紫杉醇(或順鉑)及 兩者聯合處理后SKOV3和OVCAR3細胞 Cleaved-PARP、Cleaved-Caspase-3表達的檢測
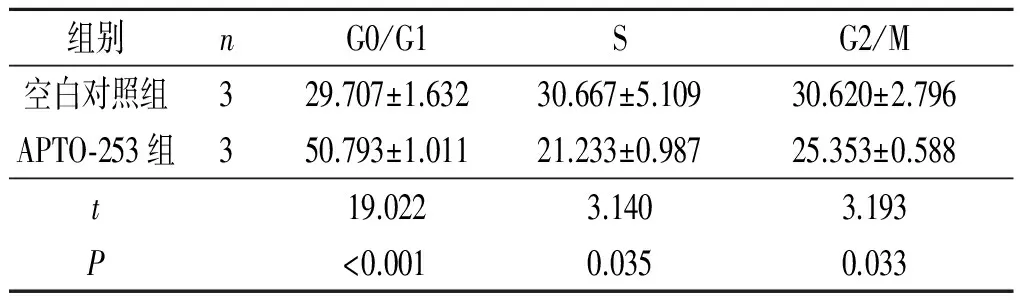
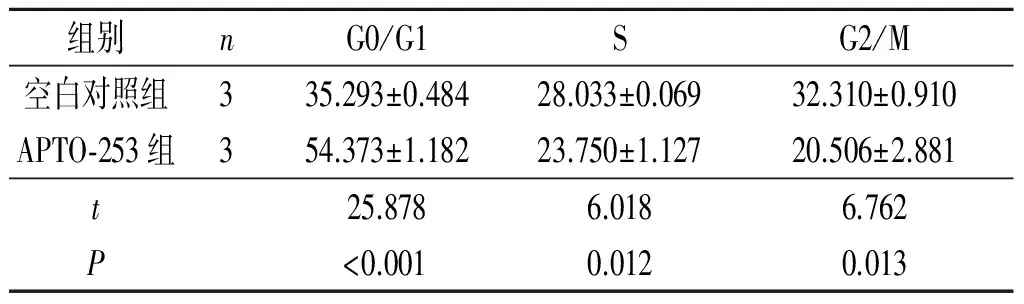
表4 APTO-253誘導后OVCAR3細胞周期的改變 %
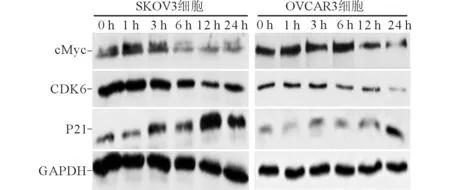
圖2 APTO-253誘導后不同時間點 SKOV3和OVCAR3細胞周期相關蛋白表達的檢測
3 討論
卵巢癌易早期侵襲轉移,易復發,且對化療藥物耐藥,病死率位于女性生殖系統腫瘤首位。目前卵巢癌的發生發展機制尚不明確,因此如何增強卵巢癌細胞對化療藥物的敏感性,提高治療效果及患者的生存率和生活質量,逐漸成為人們研究的熱點。APTO-253是一種小分子化合物,在美國已經被批準應用于一些實體腫瘤的Ⅰ期臨床試驗[1]。
Cleaved-Caspase-3是活化的Caspase-3被剪切后產生的活性片段,其表達情況可真實反映機體Caspase-3的活性狀態及細胞凋亡情況。有學者[2]報道,在直腸癌中高水平Cleaved-Caspase-3的患者預后較好,Cleaved-Caspase-3低水平與直腸癌的復發有關。Donato等[3]研究結果顯示,宮頸癌組織中Cleaved-Caspase-3陽性表達率下降;進一步的研究[4]發現Cleaved-Caspase-3表達水平與宮頸癌組織分化程度有關,即其表達隨著組織分化程度的增加而明顯降低。Cleaved-PARP執行細胞凋亡的功能[5],是細胞凋亡的生物學標志。王瑩等[6]探討了硼替佐米誘導VSMC凋亡的機制,結果發現在不同濃度藥物干預下Pro-Caspase-3表達降低而Cleaved-PARP表達升高。本研究中采用Caspase-3/7活性方法檢測細胞凋亡情況,采用Western blot方法檢測Cleaved-PARP、Cleaved-Caspase-3的表達水平,結果顯示在SKOV3和OVCAR3細胞中,與空白對照組相比,經APTO-253誘導后細胞凋亡增加,Cleaved-Caspase-3、Cleaved-PARP的表達明顯增高,說明APTO-253可促進細胞凋亡;經APTO-253聯合化療藥物處理后細胞凋亡顯著增加,Cleaved-Caspase-3、Cleaved-PARP的表達明顯增高,表明APTO-253可協同增強化療藥物誘導的細胞凋亡,提高卵巢癌細胞對化療藥物的敏感性。
細胞周期的異常調控使細胞的生長發生紊亂,是導致腫瘤發生的原因之一[7]。本研究結果顯示,經APTO-253誘導的SKOV3和OVCAR3細胞中G1期細胞受到阻滯,S期和G2/M期細胞顯著減少。CDK6被認為是一種癌基因[8],參與誘導腫瘤細胞的增殖[9-10]。有學者[11]報道CDK6在上皮性卵巢癌組織中表達升高。作者發現在卵巢癌細胞中APTO-253可下調CDK6的表達,從而抑制細胞增殖,且具有時間依賴性。cMyc是常見的控制細胞增殖和分化的原癌基因,研究[12]發現在漿液性卵巢腺癌及FIGO Ⅲ期以上卵巢癌組織中cMyc過度表達,提示cMyc可能與卵巢癌的發生及發展密切相關。本研究結果顯示在卵巢癌細胞中經APTO-253誘導后cMyc的表達明顯下調,表明APTO-253可以抑制細胞增殖、促進細胞凋亡。p21是一種抑癌基因,在卵巢上皮性癌組織中的表達降低,與組織學分級、轉移情況、腫瘤大小相關[13-14],且與FIGO分期密切相關[15]。本研究結果顯示,在卵巢癌細胞中經APTO-253誘導后P21表達水平升高。總之,APTO-253可以阻滯卵巢癌細胞周期,抑制細胞生長,并具有時間依賴性。
綜上所述,在SKOV3和OVCAR3卵巢癌細胞中APTO-253能夠導致細胞周期阻滯,促進細胞凋亡,提高癌細胞對化療藥物的敏感性,聯合順鉑及紫杉醇使用有協同作用,能增強化療藥物的療效。作者推測,APTO-253聯合化療藥物可能是治療卵巢癌的新策略,將促進卵巢癌治療臨床試驗的轉變。
[1] CERCEK A,WHELER J,MURRAY PE,et al.Phase 1 study of APTO-253 HCl, an inducer of KLF4, in patients with advanced or metastatic solid tumors[J].Invest New Drugs,2015,33(5):1086
[2] NOBLE P,VYAS M,AL-ATTAR A,et al.High levels of cleaved caspase-3 in colorectal tumour stroma predict good survival[J].Br J Cancer,2013,108(10):2097
[3] DONATO AL,HUANG Q,LIU X,et al.Caspase 3 promotes surviving melanoma tumor cell growth after cytotoxic therapy[J].J Invest Dermatol,2014,134(6):1686
[4] MAO P,SMITH L,XIE W,et al.Dying endothelial cells stimulate proliferation of malignant glioma cells via a caspase 3-mediated pathway[J].Oncol Lett,2013,5(5):1615
[5] SHALINI S,DORSTYN L,DAWAR S,et al.Old, new and emerging functions of caspases[J].Cell Death Differ,2015,22(4):526
[6] 王瑩,魏會麗,孫瑞紅.硼替佐米對人臍動脈血管平滑肌細胞凋亡及Caspase-3表達的影響[J].實用醫學雜志,2016,32(19):3155
[7] KOLLMANN K,HELLER G,SCHNECKENLEITHNER C,et al.A kinase-independent function of CDK6 links the cell cycle to tumor angiogenesis[J].Cancer Cell,2013,24(2):167
[8] KOHRT D,CRARY J,ZIMMER M,et al.CDK6 binds and promotes the degradation of the EYA2 protein[J].Cell Cycle,2014,13(1):62
[9] KAWASAKI Y,KOMIYA M,MATSUMURA K,et al.MYU, a target lncRNA for Wnt/c-Myc signaling, mediates induction of CDK6 to promote cell cycle progression[J].Cell Rep,2016,16(10):2554
[10]ZHU K,LIU L,ZHANG J,et al.MiR-29b suppresses the proliferation and migration of osteosarcoma cells by targeting CDK6[J].Protein Cell,2016,7(6):434
[11]凌晨,劉蜀,王勇,等.CDK6在早期卵巢癌中表達及其臨床意義[J].南方醫科大學學報,2016,36(9):1271
[12]NESBIT CE,TERSAK JM,PROCHOWNIK EV.MYC oncogenes and human neoplastic disease[J].Oncogene,1999,18(19):3004
[13]秦瑞,劉俊寶,曹璐,等.卵巢上皮性癌組織中P21蛋白的表達及其臨床意義[J].吉林大學學報(醫學版),2012,38(1):98
[14]劉偉,劉海燕,許喆菲,等.p21WAF1基因與卵巢癌臨床病理特征的相關性研究[J].陜西醫學雜志,2012,41(1):102
[15]張軍,汪瑞雪,樊曉妹,等.卵巢漿液性腺癌中SP1、KLF4和p21表達及其預后意義[J].臨床與實驗病理學雜志,2017,33(1):22