氧化苦參堿對神經病理性疼痛大鼠實時步態行為學的影響*
王鑫蕊 楊 麗,2△ 徐榕雪
(1.遼寧中醫藥大學省部共建中醫臟象理論及應用教育部重點實驗室,遼寧 沈陽 110847;2.大連理工大學化工與環境生命學部制藥科學與技術學院,遼寧 大連 116024;3.遼寧省本溪市金山醫院藥學部,遼寧 本溪 117000)
神經病理性疼痛是指因末梢神經至中樞神經系統的損害或疾病導致的痛覺過敏、痛覺異常,如坐骨神經痛、糖尿病性神經病變等引起的疼痛。這種疼痛在損傷痊愈后的數月至數年仍可持續存在[1-4]。近年來的研究表明,疼痛信號先激活外周感受器,引起動作電位進入DRG感覺神經元,從而引起膜去極化,激活電壓依賴性鈣通道(VGCCs)[5]。 VGCCs 分為低電壓依賴性鈣通道和高電壓依賴性鈣通道(HVDCCs)[6]。 其中 HVDCCs分為 L-型、N-型、P/Q-型及 R-型。
近年來有研究發現,氧化苦參堿可以顯著提高經過部分坐骨神經結扎且鞘內注射L-型鈣通道阻斷劑硝苯地平的小鼠模型的機械縮足反應閾值ED50[7],且Nowycky等[8]研究發現在小雞的背根神經節感覺神經元中,3種鈣通道共存,L-型鈣通道能持久強力的去極化。因此本研究選擇L-型鈣通道阻斷劑硝苯地平,利用Cat Walk步態分析操作系統考察氧化苦參堿及L-型鈣通道阻滯藥對神經病理性疼痛大鼠模型步態行為的影響。Cat Walk步態分析操作系統是定量分析嚙齒類動物模型腳步和步態的完整系統,該系統可用于評估神經性疼痛、脊髓損傷及恢復情況等,可直接檢測到坐骨神經功能指數以及步態、足印等指標,借助計算機分析,闡明神經病理性疼痛大鼠行進行為的改變及硝苯地平對氧化苦參堿改善神經病理性疼痛大鼠的影響。同時,本研究將為拓展神經病理性疼痛大鼠的行為評價指標提供可靠依據。現報告如下。
1 材料與方法
1.1 實驗動物 50只SD大鼠,體質量為(200±20)g,雌性。由遼寧長生生物技術有限公司提供,動物合格證號:SCXK(遼)2015-0001。所有動物實驗均按照遼寧中醫藥大學實驗動物管理條例施行。
1.2 試藥與儀器 氧化苦參堿(純度為99.01%,批號:150416,成都普菲德生物技術有限公司),稱取0.105 g氧化苦參堿溶于10 mL的0.9%氯化鈉注射液中,配成質量濃度為10.5 mg/mL的氧化苦參堿;硝苯地平(SLBD7789V,Sigma公司),稱取 0.008 g硝苯地平溶于10 mL的乙醇中,配成質量濃度為0.8 mg/mL的硝苯地平。水合氯醛(批號:20110401,國藥集團化學試劑有限公司);0.9%氯化鈉注射液(批號:12082104,沈陽志鷹制藥廠);乙醇(批號:20141224,天津市富宇精細化工有限公司)。CatWalk XT 10.6動物步態采集分析系統(Noldus公司,荷蘭)。
1.3 分組與造模 將50只大鼠按隨機數字表法分為假手術組、模型組、氧化苦參堿組、硝苯地平組和聯合
給藥組各10只,分籠飼養。參照Kim等[9]造模方法,建立脊神經結扎(SNL)模型。大鼠稱體質量后,經10%水合氯醛(3.5 mL/kg)腹腔麻醉,置于俯臥位,腰部備皮,鈍性分離左側椎旁肌肉,暴露L5和L6神經,用6號絲線緊緊結扎神經后止血、縫合,并肌肉注射青霉素預防感染。 參照姜靜、吳世星等[7,10]前期研究中實驗動物給藥劑量換算關系,氧化苦參堿按照150 mg/kg體質量的給藥劑量、硝苯地平按照11.5 mg/kg體質量的給藥劑量對部分坐骨神經結扎小鼠的神經病理性疼痛模型具有較強的抑制疼痛效果,因此本實驗中各給藥組大鼠按照1 mL/100 g體質量分別注射相應藥物。氧化苦參堿組腹腔注射質量濃度為10.5 mg/mL的氧化苦參堿,硝苯地平組腹腔注射質量濃度為0.8 mg/mL的硝苯地平,假手術組和模型組分別腹腔注射等劑量的生理鹽水作為對照。聯合給藥組腹腔注射氧化苦參堿、硝苯地平,質量濃度同前。
1.4 步態檢測方法 訓練方法:參照關亞蘭等[11]方法,對大鼠進行為期3 d,每日3次的訓練。將飼養的大鼠置于空鼠盒內并置于步態儀末端的鼠盒托架中,以建立熟悉的環境。大鼠置于儀器步行臺跑道起始端,并從大鼠后方給予一定吹風刺激直至大鼠跑至末端暗盒中,并于其中適應30 s,如果該大鼠適應暗盒環境且未從暗盒的出口跳入下方的飼養鼠盒內,可人為將動物置于鼠盒中,認為完成了一次訓練。按照此法對所有大鼠進行訓練,直至所有的大鼠在無刺激的條件下能夠不停頓地走過完整跑道。檢測方法:訓練后利用CatWalk XT步態分析系統分別采集各組大鼠步態行為數據,各動物分別進行3次實時自然步態行為錄像,合格的錄像須含有7~8個連續步數。氧化苦參堿組、硝苯地平組和聯合給藥組于訓練后第7天給藥,45 min后進行數據采集,采集指標如下:正常步序比、擺動時間、坐骨神經功能指數、足印長度、足印寬度、最大接觸時間的最大強度、站立時間,利用CatWalk XT Version 10.6分析軟件進行數據分析,取各指標均值。
1.5 統計學處理 應用SPSS17.0統計軟件。計量資料以(±s)表示,組間比較采用方差分析。P<0.05為差異有統計學意義。
2 結 果
2.1 大鼠身體協調性相關指標與坐骨神經功能指數比較 見表1,表2。身體協調性相關指標正常步序比、擺動時間中,假手術組與模型組相比,無顯著變化;與模型組相比,氧化苦參堿組、硝苯地平組、聯合給藥組均未見明顯差異(P>0.05)。與假手術組比較,模型組大鼠的坐骨神經功能指數顯著下調(P<0.01);氧化苦參堿、硝苯地平、氧化苦參堿與硝苯地平聯合給藥分別使SNL大鼠的坐骨神經功能指數顯著改善(P<0.01),且各組與模型組相比,差異均有統計學意義(P<0.01)。提示氧化苦參堿及硝苯地平對SNL神經功能病理性疼痛大鼠的坐骨神經功能指數有改善作用。
表1 各組大鼠正常步序比與坐骨神經功能指數比較(±s)

表1 各組大鼠正常步序比與坐骨神經功能指數比較(±s)
與假手術組比較,*P<0.05,**P<0.01;與模型組比較,△P<0.05,△△P<0.01。下同。
組 別 n 正常步序比 坐骨神經功能指數假手術組 10 92.78±12.96 -19.63±5.13模型組 10 87.39±13.06 -69.09±15.19**氧化苦參堿組 10 88.89±19.25 -35.50±4.35△△硝苯地平組 10 76.07±10.88 -45.46±7.24△△聯合給藥組 10 85.93±15.56 -35.29±5.83△△
表2 各組大鼠擺動時間比較(s,±s)

表2 各組大鼠擺動時間比較(s,±s)
組 別 n假手術組 10模型組 10氧化苦參堿組 10左后擺動時間 右后擺動時間 左前擺動時間 右前擺動時間0.19±0.12 0.18±0.04 0.17±0.04 0.16±0.05 0.16±0.05 0.16±0.06 0.17±0.11 0.15±0.07 0.15±0.04 0.17±0.09 0.18±0.03 0.17±0.03硝苯地平組 10 0.16±0.04 0.16±0.05 0.17±0.05 0.17±0.07聯合給藥組 10 0.17±0.05 0.16±0.05 0.17±0.04 0.15±0.03
2.2 大鼠足印壓力的變化 見圖1~圖5。假手術組大鼠正常狀態下四足分別接觸跑道時,每足的足印大小及壓力分布均勻(圖1)。而SNL的神經病理性疼痛大鼠在行進過程中,結扎側左后足(LH)足印明顯變小,而結扎對側的右前足(RF)足印變亮(圖2),而未結扎側右后足(RH)及結扎側左前足(LF)的足印壓力未見到明顯變化,說明脊神經結扎使得SNL大鼠的結扎側后足即LH足印壓力變小,結扎對側前足即RF足印壓力增大,因此推斷該SNL大鼠因單側脊神經結扎而重心向對側前移;給予氧化苦參堿、硝苯地平及聯合給藥后的SNL大鼠與模型組相比,行進時的LH足印增大,RF足印變小變暗(圖3~圖5),說明氧化苦參堿及硝苯地平使得SNL疼痛引起的足印及壓力變化情況得到改善。實驗結果提示氧化苦參堿及硝苯地平能夠糾正SNL疼痛造成結扎側LH足的壓力變化及整體重心偏移。

圖1 假手術組大鼠正常狀態下四足的足印

圖2 模型組大鼠行進時足印

圖3 聯合給藥組大鼠行進時足印

圖4 硝苯地平組大鼠行進時足印
2.3 大鼠四足足印參數的改變 如表3~表6。與假手術組比較,模型組的LH足印長度、足印寬度、最大接觸時間的最大強度、站立時間4項指標均顯著下調,RF足印寬度顯著上調(P<0.05);氧化苦參堿與硝苯地平聯合給藥使SNL大鼠足印長度指標在LH足顯著上調,RF足顯著下調(P<0.05);氧化苦參堿、硝苯地平、氧化苦參堿與硝苯地平聯合給藥使SNL大鼠LH足的足印寬度、最大接觸時間的最大強度、站立時間 3項指標顯著上調(P<0.05);同時可見氧化苦參堿與硝苯地平對SNL神經病理性疼痛大鼠LH足及RF足的足印長度呈現出部分加和作用(P<0.05)。

圖5 氧化苦參堿組大鼠行進時足印
表3 各組大鼠足印長度比較(cm,±s)

表3 各組大鼠足印長度比較(cm,±s)
組 別 n假手術組 10模型組 10氧化苦參堿組 10 LH足印長度 RH足印長度 LF足印長度 RF足印長度2.12±0.17 2.13±0.21 1.40±0.28 1.28±0.30 1.64±0.16** 2.01±0.16 1.39±0.19 1.46±0.22 1.84±0.30 2.02±0.47 1.36±0.16 1.31±0.15硝苯地平組 10 1.69±0.18 1.83±0.18 1.44±0.33 1.35±0.17聯合給藥組 10 1.91±0.28△ 2.02±0.10 1.41±0.25 1.27±0.20△
表4 各組大鼠足印寬度比較(cm,±s)

表4 各組大鼠足印寬度比較(cm,±s)
組 別 n假手術組 10模型組 10氧化苦參堿組 10 LH足印寬度 RH足印寬度 LF足印寬度 RF足印寬度1.61±0.20 1.49±0.27 1.13±0.24 1.04±0.20 1.22±0.18** 1.38±0.28 1.13±0.18 1.20±0.22△1.45±0.13△ 1.43±0.20 1.14±0.13 1.05±0.12硝苯地平組 10 1.43±0.10△ 1.39±0.09 1.07±0.15 1.09±0.22聯合給藥組 10 1.48±0.26△△ 1.30±0.14 1.14±0.10 1.03±0.16
表5 各組大鼠最大接觸時間的最大強度比較(±s)

表5 各組大鼠最大接觸時間的最大強度比較(±s)
RF最大接觸時間的最大強度103.95±13.73 96.34±18.15 95.44±9.60 90.16±16.97 68.26±18.40** 92.29±20.21 94.50±14.95 93.38±17.03 90.40±15.61△ 87.55±14.43 93.60±14.10 91.57±7.20硝苯地平組 10 92.33±11.72△ 82.43±9.58 86.20±12.56 90.69±7.50聯合給藥組 10 94.83±14.19△△ 85.30±11.33 96.87±11.20 91.83±11.29組 別 n LH最大接觸時間的最大強度RH最大接觸時間的最大強度LF最大接觸時間的最大強度假手術組 10模型組 10氧化苦參堿組 10
表6 各組大鼠站立時間比較(s,±s)
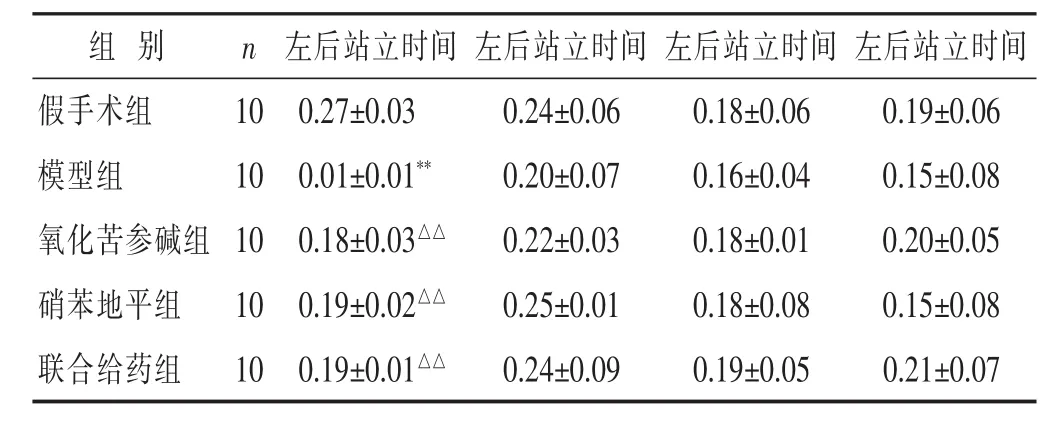
表6 各組大鼠站立時間比較(s,±s)
組 別 n假手術組 10模型組 10氧化苦參堿組 10左后站立時間 左后站立時間 左后站立時間 左后站立時間0.27±0.03 0.24±0.06 0.18±0.06 0.19±0.06 0.01±0.01** 0.20±0.07 0.16±0.04 0.15±0.08 0.18±0.03△△ 0.22±0.03 0.18±0.01 0.20±0.05硝苯地平組 10 0.19±0.02△△ 0.25±0.01 0.18±0.08 0.15±0.08聯合給藥組 10 0.19±0.01△△ 0.24±0.09 0.19±0.05 0.21±0.07
3 討 論
CatWalk全自動步態分析儀是一個包含軟件及硬件的完整系統,它使用腳印光亮折射技術,利用高速攝像機從步行臺下方捕獲每一個腳步的細節,且能探測到四足的壓力差異,從而檢測動物重心的分配情況。并且能對運動失調、疼痛、神經損傷等研究領域進行步態行為評估[12-14]。步態分析中與神經病理性疼痛相關的指標主要有:坐骨神經功能指數、最大接觸時間的最大強度、足印長度等,同時,有文獻報道正常步序比、站立時間、擺動時間等參數可能與大鼠坐骨神經慢性壓迫模型相關[15]。
本實驗利用脊神經結扎的大鼠神經病理性疼痛模型(SNL模型),結合CatWalk全自動步態分析儀,采集大鼠足印并進行軟件自動定量分析,評價藥物對SNL神經病理性疼痛大鼠步態的影響,比嚙齒類動物疼痛行為學研究中的面部表情疼痛量表及連續后足使用評分等方法[16-18]更客觀更精確,是對嚙齒類動物疼痛評估方法[18]的補充。
本實驗利用CatWalk全自動步態分析儀采集大鼠的自然步態及足印,并自動定量分析大鼠的多項步態及足印參數指標,考察SNL神經病理性疼痛大鼠在自然行走中的步態參數變化。實驗中的大鼠源于同一批次,且各組大鼠均經過隨機挑選產生。經實驗結果顯示,假手術組大鼠的LH足與RH足相比,LF足與RF足相比,各參數均無顯著性差異,因此我們認為其步態基數處于同一水平。模型組與假手術組比較,坐骨神經功能指數顯著降低,與文獻報道的SFI值越負,坐骨神經損傷越嚴重[19]相一致,說明 L5、L6脊神經結扎的SNL神經病理性疼痛模型成功建立,已使SNL大鼠的坐骨神經功能發生障礙,并影響到大鼠正常的步態行為。
HVDCCs鈣通道阻斷劑能選擇性阻滯細胞膜鈣離子通道,延遲失活態鈣通道的恢復,減少鈣離子內流,降低細胞內游離鈣,阻礙敏感細胞的鈣依賴性活動而產生相應藥理作用[20]。其中L-型鈣通道阻斷劑Nimodipine可對抗糖尿病大鼠痛覺過敏反應[21-22],N-型鈣通道阻斷劑Ziconotide[23]已在美國上市用于神經病理性疼痛治療,并有神經病理性疼痛一線治療藥物的鈣通道調節劑加巴噴丁通過結合HVDCCs的輔助亞基而發揮鎮痛作用。
近年來,本課題組通過系列研究證明[24-25]氧化苦參堿對神經病理性疼痛具有抑制作用并且發現該鎮痛作用機制與HVDCCs有關。本實驗中氧化苦參堿及L-型鈣通道阻斷劑硝苯地平均使SNL大鼠的SFI顯著升高,表明氧化苦參堿及L-型鈣通道阻斷劑硝苯地平對神經病理性疼痛模型大鼠步態有明顯改善作用。氧化苦參堿與硝苯地平聯合給藥能使SNL大鼠LH的足印長度顯著增長,而氧化苦參堿、硝苯地平單獨給藥則未能呈現顯著變化;氧化苦參堿與硝苯地平聯合給藥使SNL大鼠LH的足印的足印寬度、最大接觸時間的最大強度等指標的改善情況比氧化苦參堿、硝苯地平單獨給藥更顯著,提示硝苯地平可能對氧化苦參堿的鎮痛作用具有增補作用。
此外,模型組與假手術組比較,LH側的站立時間減少,正常步序比不變,這與文獻報道的炎性和慢性壓迫損傷(CCI)大鼠疼痛模型的實驗結果相一致[15,26-27]。
本研究利用CatWalk步態分析儀,初步考察了氧化苦參堿及L-型鈣通道阻斷劑硝苯地平對神經病理性疼痛模型大鼠步態行為的改善作用,肯定了氧化苦參堿及硝苯地平對神經病理性疼痛的鎮痛作用,拓展了神經病理性疼痛大鼠的行為評價方法和指標,同時也為深入研究氧化苦參堿鎮痛作用的鈣通道相關機制提供了可靠依據。
[1] 王超,劉春芳,林娜.中藥干預神經病理性疼痛作用機制研究進展[J].中國實驗方劑學雜志,2015,22(21):34-39.
[2] 王世端.實用臨床疼痛診療學[M].青島:中國海洋大學出版社,2009:39.
[3] 劉俐,吳琳娜.疼痛護理手冊[M].成都:四川大學出版社,2013:7.
[4] Seltzer Z,Dubner R,Shir Y.A novel behavioral model of neuropathic pain disorders produced in rats by partial sciatic nerve injury[J].Pain,1990,43(2):205-218.
[5] Park J,Luo ZD.Calcium channel functions in pain processing[J].Channels,2010,4(6):510-517.
[6] 呂楠,肖波.T型鈣離子通道在癲癇發生中的作用研究進展[J].中國神經精神疾病雜志,2013,39(7):447-448.
[7] 吳世星.氧化苦參堿抑制神經病理性疼痛作用與HVGCCs介導的信號通路相關性研究[D].沈陽:遼寧中醫藥大學,2016.
[8] Nowycky MC,Fox AP,Tsien RW.Three types of neuronal calcium channel with different calcium agonist sensitivity[J].Nature,1985,316(6027):440-443.
[9] Kim SH,Chung JM.An experimental model for peripheral neuropathy produced by segmental spinal nerve ligation in the rat[J].Pain,1992,50(3):355-363.
[10]姜靜,馮建偉,陳靖,等.氧化苦參堿的鎮痛作用[J].中藥藥理與臨床,2012,28(6):50-52.
[11]關亞蘭,董世芬,張勝威,等.實驗性血管性癡呆大鼠模型的實時步態行為分析[J].中國比較醫學雜志,2015,25(1):59-65.
[12] Kyriakou EI,van der Kieft JG,de Heer RC, et al.Automated quantitative analysis to assess motor function in different rat models of impaired coordination and ataxia[J].Journal of NeuroscienceMethods,2016,268:171-181.
[13]Deumens R,Jaken RJP,Marcus MAE,et al.The CatWalk gait analysis in assessment of both dynamic and static gait changes after adult rat sciatic nerve resection[J].Journal of NeuroscienceMethods,2007,164(1):120-130.
[14]Ferdinandusse S,Zomer AWM,Komen JC,et al.Ataxia with loss of purkinje cells in a mouse model for refsum disease[J].Proceedings of the National Academy of Scienc es,2008,105(46):17712-17717.
[15]Gabriel AF,Marcus MAE,Walenkamp GHIM,et al.The Cat-Walk method:assessment of mechanical allodynia in experimental chronic pain[J].Behavioural brain research,2009,198(2):477-480.
[16] Langford DJ,Bailey AL,Chanda ML,et al.Coding of facial expressions of pain in the laboratory mouse[J].NatureMethods,2010,7(6):447.
[17]劉志云,沈玲,邱海波,等.面部表情疼痛量表和行為學評估慢性胰腺炎大鼠的疼痛[J].臨床麻醉學雜志,2016,32(4):380-382.
[18]彭皓,黃東.嚙齒類動物疼痛評估方法的研究進展[J].中國疼痛醫學雜志,2014,20(7):505-508.
[19]Varej觔o ASP,Meek MF,Ferreira AJA,et al.Functional evaluation of peripheral nerve regeneration in the rat:walking track analysis[J].Journal of NeuroscienceMethods,2001,108(1):1-9.
[20]李淑媛,王公望.現代治療學[M].北京:華夏出版社,2000:137.
[21]Gupta M,Singh J,Sood S,et al.Mechanism of antinociceptive effect of nimodipine in experimental diabetic neuropathic pain[J].Methodsand Findings in Experimental and Clinical Pharmacology,2003,25(1):49-52.
[22]李廷荃,劉薇,陳瑞華.老藥新用[M].太原:山西科學技術出版社,2012:197-198.
[23]Voirin J,Darie I,Fischer D,et al.Ziconotide intrathecal delivery as treatment for secondary therapeutic failure of motor cortex stimulation after 6 years[J].Neurochirurgie,2016,62(5):284-288.
[24]吳世星,楊麗,呂曉強,等.氧化苦參堿鎮痛作用與鈣離子通道相關性的研究[J].中國中西醫結合雜志,2015,35(4):461-465.
[25]徐榕雪,楊麗,鄧揚鷗,等.氧化苦參堿對高電壓依賴性鈣通道輔助亞基的影響[J].中藥藥理與臨床,2016,32(3):49-53.
[26]Gabriel AF,Marcus MAE,Honig WMM,et al.The CatWalk method:a detailed analysis of behavioral changes after acute inflammatory pain in the rat[J].Journal of NeuroscienceMethods,2007,163(1):9-16.
[27]Bozkurt A,Scheffel J,Brook GA,et al.Aspects of static and dynamic motor function in peripheral nerve regeneration:SSI and CatWalk gait analysis[J].Behavioural brain research,2011,219(1):55-62.

