二甲雙胍通過調節FGF21/adiponectin軸改善NAFLD大鼠脂代謝紊亂
申 甜,雷 濤,陳 琳,徐碧林,夏 娟,汪紅平
0 引言
非酒精性脂肪性肝病(NAFLD)是以肝臟內三酰甘油(TG)過度聚集為特征的肝臟疾病,在西方國家糖尿病患者群中發病率達21%~78%[1],胰島素抵抗(IR)是NAFLD和2型糖尿病(T2DM)發生及疾病發展變化的中心環節。脂聯素(Adiponectin)與瘦素、腫瘤壞死因子等脂肪因子不同,具有抗炎、抗糖尿病、抗動脈粥樣硬化的作用,參與糖脂代謝及炎癥反應等多個生理過程,與 NAFLD 密切相關[2]。近年來新發現的成纖維生長因子21(Fibroblast growth factor 21,FGF21)可部分依賴PPARγ活性,刺激脂肪細胞中adiponectin的轉錄及分泌。且Lin等[3]證實,外源性重組FGF21因子需要依賴脂聯素而發揮降糖降脂作用。FGF21/adiponectin軸通過調節多器官而維持機體的糖脂及能量代謝平衡,因此將成為治療NAFLD的新靶點。多項臨床研究證實,二甲雙胍可上調NAFLD患者血清脂聯素水平而改善IR,本研究采用高脂飲食建立大鼠NAFLD模型[4-5],探討二甲雙胍是否通過調節內源性FGF21/adiponectin軸變化而逆轉NAFLD的進程。
1 資料與方法
1.1 材料與試劑 健康雄性清潔級SD大鼠40只,4周齡,體重(170±20) g,購于上海斯萊克實驗動物有限責任公司,動物許可證號:SCXK(滬)2012-0002,由上海市普陀區中心醫院動物飼養中心分籠喂養。正常普通飼料(蛋白質21%、脂肪6%、碳水化合物55%),高脂飼料(83%基礎飼料,10%豬油,5%蔗糖,1.5%膽固醇,0.5%膽鹽)由上海斯萊克實驗動物有限公司定制生產。鹽酸二甲雙胍片(500 mg/片,上海施貴寶制藥公司,批號:1112103)。胰島素(FINS)、脂聯素、FFA及三酰甘油試劑盒均購自上海鈺森生物科技有限公司;逆轉錄試劑PrimeScript TM RT 購自THERMO公司,熒光定量PCR試劑盒 SYBR premix EX TaqTMⅡ購于日本TaKaRa Bio株式會社。
1.2 方法 ①NAFLD模型制備及分組:為適應環境,40只大鼠予以普通飼料適應性喂養1 周后,根據隨機數字表法分為正常對照組(NC組,15只,普通飼料)和高脂飲食組(HF組,25只,高脂飼料)喂養8周,兩組隨機抽取5只(NC1組、HF1組),經稱重、檢測血糖血脂等生化學指標及行肝組織病理檢測,以體重、肝臟濕重明顯增加,血空腹胰島素(FINS)、穩態胰島素評價指數(HOMA-IR)明顯升高,血脂指標(TC、TG)及肝功能指標(ALT、AST)明顯升高,肝臟病理組織學示肝小葉結構模糊,出現細胞腫脹,胞核消失或被脂肪空泡,證實HF組NAFLD造模成功。剩余20只HF大鼠再隨機分為2組:模型組(HF組,等體積生理鹽水)、二甲雙胍干預組[HF+M組,加二甲雙胍500 mg/(kg·d)],每組10只,連續灌胃8周。藥物干預期間,對照組大鼠繼續給予常規飼料喂養,模型組及二甲雙胍組大鼠繼續予以高脂飼料喂養。實驗結束時,各實驗組大鼠禁食不禁水12 h,行乙醚腹腔麻醉大鼠,稱重,腹主動脈采血,分離血清并轉移至新的EP管,放置-80 ℃低溫冰箱保存;同時迅速分離取出肝臟組織并稱重,甲醛溶液固定,制備石蠟切片,行HE染色觀察肝臟病理組織學變化;其余肝臟及部分附睪脂肪組織放置于-80 ℃凍存備測Real-time PCR。
②血清指標生化檢測:采用日本OLYMPUS公司AU2700型全自動生化檢測儀檢測丙氨酸氨基轉移酶(ALT)、天冬氨酸氨基轉移酶(AST)、總膽固醇(TC)、TG、空腹血糖(FBG)、血清空腹胰島素(FINS)、肝臟TG含量、FGF21、脂聯素,均按照ELISA 試劑盒操作說明進行檢測,計算胰島素抵抗指數IRI=(FINS×FBG)/22.5。
③肝臟病理組織學觀察:取相同部位肝右葉,大小約2 cm×2 cm×0.3 cm;迅速取出肝臟并稱重,甲醛溶液固定,制備石蠟切片,行HE染色觀察肝細胞脂肪變性程度、炎性活動度及肝纖維化的程度,進行肝組織病理學觀察。
④氯仿∶甲醇(2∶1)肝臟勻漿液的制備及TG含量測定:稱取適量肝臟組織,放入玻璃勻漿管中,加入3倍體積的甲醇,1 500 r/min電動勻漿5 min,倒入離心管中,再加入6倍體積的氯仿,漩渦混合器混勻,制備10%的組織勻漿,根據TG測定試劑盒對TG含量進行測定。
⑤RT-PCR法檢測肝臟脂聯素adiponectin、FGF21、AMPK mRNA表達。脂肪組織adiponectin mRNA表達:取凍存脂肪及肝臟組織,采用TRIzol抽提大鼠肝臟總RNA,按Superscript Ⅲ逆轉錄酶試劑盒說明逆轉錄得到cDNA。各基因引物序列:adiponectin:5′-GTCTCCGTGCTTCCGATGAA-3′,5′-GGTCAAACTGGACTTGGGGT-3′;FGF21:5′-GTGCGAGGCATACCCCATC-3′,5′-CCGTCCTCCCTGATCTCCA-3′;AMPK:5′-GAGCCCTGAACTTGCTTTTACA-3′,5′-TGTCCGTTCTATGCGCTGG-3′;GAPDH:5′-CTCATGACCACAGTCCATGC-3′,5′-CACATTGGGGGTAGGAACAC-3′。擴增條件:95 ℃預變性30 s,95℃ 5 s,60 ℃ 34 s,40個循環。擴增完成后,應用反應產物的溶解曲線檢測其均一性,每個反應重復3次,ABI7300 SDS Software自動分析熒光信號并將其轉換Ct值。以GAPDH作為內參基因對所有樣品進行規一化處理,ΔCt為目的基因Ct值與內參Ct值的差值,最終以2-ΔΔCt作為目的基因相對表達量。
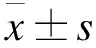
2 結果
2.1 NAFLD模型建立 喂養8周,NC1組、HF1組大鼠生化學指標比較,見表1。
2.2 喂養8周末肝臟組織學比較 肉眼觀察:NC組喂養8周肝臟形態正常,HF組肝臟外形稍飽滿圓鈍,色紅,質地較脆;光鏡觀察:NC組肝小葉結構完整,輪廓清晰,肝細胞以中央靜脈為中心呈放射狀排列,肝小葉肝細胞分界清晰,胞核圓,位于細胞中央,胞質豐富,未見肝細胞脂肪變性或壞死及炎性細胞浸潤;HF組肝小葉結構模糊,肝索放射狀排列不明顯,大部分細胞腫脹,胞核消失或被脂肪空泡。見圖1。

圖1 肝臟組織學比較(HE,200×)
2.3 二甲雙胍干預8周后各組生化指標、FFA測定及胰島素抵抗指數比較 見表2。
2.4 肝組織病理HE染色 NC1組肝細胞形態、小葉結構及匯管區均未見異常,幾乎未見肝細胞脂肪變性。HF1組大鼠肝小葉脂質沉積明顯,肝細胞脂質變性大部分為小脂滴,伴有氣球樣變,肝竇間隙變窄,HF+M組大鼠肝小葉結構仍有紊亂,細胞脂滴變小,氣球樣變減少,無明顯壞死,肝竇間隙無明顯變窄。見圖2。
2.5 各組肝臟adiponectin、FGF21、AMPK mRNA表達及脂肪組織adiponectin mRNA表達 與對照組比較,模型組肝臟AMPK、adiponectin mRNA表達均下降;二甲雙胍干預后,肝臟FGF21、AMPK mRNA表達明顯增加(P<0.01),而adiponectin mRNA表達無明顯變化;與模型組比較,二甲雙胍可明顯干預脂肪組織adiponectin mRNA表達。見圖3、圖4。

表1 NC1組、HF1組大鼠生化學指標比較
注:與NC組比較,*P<0.05

表2 三組大鼠生化學及胰島素抵抗指標比較
注:與NC組比較,*P<0.05;與HF組比較,#P<0.05

圖2 肝組織病理HE染色結果(HE,100×)

圖3 肝組織adiponectin、FGF21、AMPK mRNA表達

圖4 脂肪組織adiponectin mRNA表達
3 討論
大量研究表明,NAFLD與T2DM、肥胖等代謝綜合征密切關聯,并可預測T2DM和心血管疾病事件(CVD)的發生[6-8]。目前有關NAFLD發病機制公認的是“二次打擊”學說[9],即胰島素抵抗造成的脂質代謝紊亂對肝臟造成第一次打擊,而氧化應激反應的激活對肝臟造成第二次打擊。
脂肪組織除作為體內最大的能量提供者之外,還是人體內重要的內分泌器官,可分泌多種細胞因子,包括游離脂肪酸(FFA)、腫瘤壞死因子-α(TNF-α)、單核細胞趨化蛋白(MCP-1)、IL-6、脂聯素、瘦素、抵抗素等,而營養過剩會造成這些促炎及抗炎因子的失平衡而加重胰島素抵抗介導的脂質過量聚集。脂聯素是1995年Sherer等[10]首次報道的一種由脂肪組織分泌的血漿激素蛋白,與肥胖、糖尿病、胰島素抵抗有關,是體內唯一與體脂含量呈負相關的脂肪因子。脂聯素轉基因小鼠的血漿TG和FFA較對照組均下降,肝臟脂肪沉積減輕[11]。FGF21是最先由 Nishimura等[12]于2000年從小鼠胚胎組織中分離出的FGF 基因家族中的一位新成員,主要由肝臟分泌入血,對維持脂代謝的穩態發揮重要作用。研究顯示,血清 FGF21 表達水平與NAFLD肝臟脂肪變性嚴重程度顯著相關,成為目前國內外研究的熱點[13]。2005年Kharitonenkov等[14]首次報道FGF-21具有調節血糖、改善胰島素敏感性及抑制肝糖輸出的作用,且與循環脂聯素水平增加以及體脂含量減少有關。
本實驗結束時,模型組大鼠體重及血清TC、TG、ALT、AST、FBG、FINS,以及肝臟TG含量、HOMA-IR高于正常對照組,但血清adiponectin水平下降,FGF21水平升高;二甲雙胍干預后,HF組大鼠血清TC、TG、FFA、FBG、ALT、AST降低,肝臟TG含量及HOMA-IR降低,血清adiponectin、FGF21水平升高。鑒于adiponectin、FGF21對調節糖脂代謝及能量平衡的正性作用,推斷二者可能參與二甲雙胍對糖脂代謝及胰島素抵抗的調控作用。此外,肝臟病理學提示,二甲雙胍可以有效減輕肝臟脂質沉積,逆轉NAFLD的脂肪變性。
二甲雙胍是經典的降糖藥物,可以改善肝臟胰島素抵抗,并改善外周器官對胰島素的敏感性,促進脂肪酸的氧化,同時還達到抑制脂肪生成的目的。在NAFLD的診療指南[15]中,也推薦二甲雙胍用于人類NAFLD的治療。2005年的一項隨機開放研究中,與維生素E或飲食控制比較,二甲雙胍可更好地改善NAFLD患者的轉氨酶水平和肝臟組織病變[16]。Shargorodsky等[17]發現,使用二甲雙胍可通過調節脂聯素和TNF-α基因表達而改善脂肪代謝,部分逆轉NAFLD患者肝細胞脂肪變性和炎性反應。
本研究PCR結果提示,模型組大鼠肝臟組織AMPK、adiponectin mRNA表達量較對照組明顯下降,而FGF21 mRNA 略有增加的趨勢;說明在糖脂代謝紊亂的內環境下可刺激肝臟分泌FGF21,而AMPK和adiponectin mRNA表達受抑制。二甲雙胍干預8周后,肝臟AMPK、FGF21 mRNA表達較模型組明顯增加,與Nygaard等[18]報道一致,adiponectin mRNA無明顯變化;然而,脂肪組織adiponectin mRNA較模型組明顯升高。
脂聯素主要由脂肪細胞特異性分泌,在肥胖和代謝綜合征人群中明顯下降;而FGF21水平在代謝疾病(如:IR、T2DM、NAFLD、冠心病、PCOS)中明顯升高。二者之所以呈現相反的變化,其主要原因如下:①FGF21與其他炎性細胞因子及激素(如兒茶酚胺、胰島素、糖皮質激素、TNF-α、IL-6)、內質網應激,氧化應激等共同參與調節adiponectin的分泌;②肥胖狀態下,脂肪組織存在FGF21抵抗。用外界注入重組FGF21或ADPN,可以改善肥胖相關的氧化應激和胰島素抵抗,對體重和高血糖有益。總之,二者是對調節糖脂代謝及胰島素抵抗具有多效作用的代謝因子。
本研究表明,使用二甲雙胍可以刺激肝臟AMPK及FGF21 mRNA表達明顯增加,且血FGF21濃度增加,通過結合脂肪組織FGF21復核受體刺激脂肪組織adiponectin的分泌及表達,發揮增加胰島素敏感性及減輕脂質沉積的作用。同樣,國外動物有實驗提示,FGF21-adiponectin 軸通過調節多器官對話而保護糖脂代謝平衡。綜上所述,二甲雙胍作為AMPK激活劑,可以顯著增加肝臟FGF21表達及分泌,進而刺激脂肪組織分泌劑表達adiponectin水平,最終通過調節FGF21-adiponectin 軸而發揮降糖、逆轉肝臟脂肪變性及改善胰島素敏感性的作用,為二甲雙胍治療NAFLD提供有力的證據。有關FGF21如何刺激脂肪adiponectin的過表達,以及與二甲雙胍的濃度及血脂、血糖的濃度之間是否存在量效反應,今后仍需要進一步的研究。
[1] Angulo P.Nonalcoholic fatty liver disease [J].N Engl J Med,2002,346(16):1221-1231.
[2] Polyzos SA,Kountouras J,Zavos C,et al.The role of adiponectin in the pathogenesis and treatment of non-alcoholic fatty liver disease[J].Diabetes Obes Metab,2010,12(5):365-383.
[3] Lin Z,Tian H,Lam KS,et al.Adiponectin mediates the metabolic effects of FGF21 on glucose homeostasis and insulin sensitivity in mice[J].Cell Metab,2013,17(5):779-789.
[4] Lieber CS,Leo MA,Mak KM,et al.Model of nonalcoholic steatohepatitis[J].Am J Clin Nutr,2004,79(3):502-509.
[5] Fan JG,Zhong L,Xu ZJ,et al.Effects of low-calorie diet on steatohepatitis in rats with obesity and hyperlipidemia[J].World J Gastroenterol,2003,9(9):2045-2049.
[6] Zelber-Sagi S,Lotan R,Shibolet O,et al.Non-alcoholic fatty liver disease independently predicts prediabetes during a 7-year prospective follow-up[J].Liver Int,2013,33(9):1406-1412.
[7] Park SK,Seo MH,Shin HC,et al.Clinical availability of nonalcoholic fatty liver disease as an early predictor of type 2 diabetes mellitus in Korean men:5-year prospective cohort study[J].Hepatology,2013,57(4):1378-1383.
[8] Luo J,Xu L,Li J,et al.Nonalcoholic fatty liver disease as a potential risk factor of cardiovascular disease[J].Eur J Gastroenterol Hepatol,2015,27(3):193-199.

[10]Yamauchi T,Nio Y,Maki T,et al.Targeted disruption of AdipoR1 and AdipoR2 causes abrogation of adiponectin binding and metabolic actions[J].Nat Med,2007,13(3):332-339.
[11]Deepa SS,Walsh ME,Hamilton RT,et al.Rapamycin modulates markers of mitochondrial biogenesis and fatty acid oxidation in the adipose tissue of db/db mice[J].J Biochem Pharmacol Res,2013,1(2):114-123.
[12]Nishimura T,Nakatake Y,Konishi M,et al.Identification of a novel FGF,FGF-21,preferentially expressed in the liver[J].Biochim Biophys Acta,2000,1492(1):203-206.
[13]Yan H,Xia M,Chang X,et al.Circulating fibroblast growth factor 21 levels are closely associated with hepatic fat content:a cross-sectional study[J].PLoS One,2011,6(9):e24895.
[14]Kharitonenkov A,Shiyanova TL,Koester A,et al.FGF-21 as a novel metabolic regulator[J].J Clin Invest,2005,115(6):1627-1635.
[15]Mazza A,Fruci B,Garinis GA,et al.The role of metformin in the management of NAFLD[J].Exp Diabetes Res,2012,2012:716404.
[16]Bugianesi E,Gentilcore E,Manini R,et al.A randomized controlled trial of metformin versus vitamin E or prescriptive diet in nonalcoholic fatty liver disease[J].Am J Gastroenterol,2005,100(5):1082-1090.
[17]Shargorodsky M,Omelchenko E,Matas Z,et al.Relation between augmentation index and adiponectin during one-year metformin treatment for nonalcoholic steatohepatosis:effects beyond glucose lowering[J].Cardiovasc Diabetol,2012,7:11:61-68.
[18]Nygaard EB,Vienberg SG,?rskov C,et al.Metformin stimulates FGF21 expression in primary hepatocytes[J].Exp Diabetes Res,2012,2012:465282.

