多個品種微型月季快速繁殖體系的建立
張小雪,薛巖晟,姚振
(長江大學園藝園林學院,湖北 荊州 434025)
微型月季(Rosahybrida)是由中國小月季、多花月季以及小姐妹型月季雜交育成的,較其他五類群現代月季而言,微型月季具有株型矮小、花形緊湊、耐寒能力強、開花時間長等特點,是一類具有很大發展潛力的室內家居裝飾花卉。作為一種微型花卉資源,微型月季的市場開發前景廣闊,它可以用于地被綠化、花壇花籬的構建,還可陳設于花架、布置于假山之上等。目前在國外,盆栽微型月季已經進入工廠化生產階段,但我國在這方面的工作剛剛起步。目前月季的繁殖技術依舊沿襲了傳統的扦插、嫁接等方法,這些方法限制了月季的繁殖量,不能滿足月季工廠化大生產發展的需要。組織培養技術具有繁殖系數高、速度快、成本低等特點,可以在短時間內獲得大量的商品苗,對于推廣新品種、迅速占領市場具有重要的意義。早在1980年,Hasegawa[1]以攀援月季“Improved fire”的莖尖或休眠芽為材料,在MS培養基上建立了試管苗無性系,開辟了月季組培的先河。近年來,微型月季的組織培養研究越來越多。沈國正等[2]以6個盆栽微型月季品種為試驗材料進行離體培養,以誘導腋芽增殖為繁殖途徑獲得了微型月季的再生植株。于冰沁[3]和劉義存[4]利用帶芽(腋芽)莖段為外植體直接進行離體培養,建立了微型月季的快速繁殖體系。本研究以22個微型月季品種為試材,探討微型月季品種間在腋芽萌動、叢生芽增殖、生根培養等方面的差異,旨在建立微型月季組培快繁體系,為微型月季的組培工廠化生產打下基礎。
1 材料與方法
1.1 試驗材料
22個不同品種微型月季取自長江大學園藝園林學院花卉基地,編號為R1~R22;花色有藍、橙、粉、白、黃、紅、橘紅、桃紅、玫紅、復色等。
1.2 無菌體系的建立及叢生芽誘導
從健康的植株上剪取發育良好的枝條為外植體,用自來水沖洗干凈,表面滅菌條件為 75%乙醇浸泡45s,0.1% HgCl2溶液表面消毒8~10min,無菌水沖洗5次后用濾紙吸干。滅菌后將莖段置于誘導培養基:MS+ 6-BA 3.0mg/L+NAA 0.3mg/L,添加蔗糖30g/L、瓊脂 8g/L,pH調至5.8。30d后記錄叢生芽誘導情況、污染情況。
1.3 叢生芽增殖培養
選取R4、R5、R8、R15、R17、R18、R19的無菌芽,接種于叢生芽誘導培養基中,每個品種設3個重復,每個重復20個無菌芽(長勢、大小基本一致),6-BA濃度設計4個水平,培養基分別為:①MS+ 6- BA 0mg/L+NAA 0.3mg/L;②MS+ 6- BA 1.0mg/L+NAA 0.3mg/L;③MS+6- BA 3.0mg/L+NAA 0.3mg/L;④MS+6- BA 5.0mg/L+NAA 0.3mg/L。培養30d后統計苗高、增殖倍數、生長狀況等指標。
1.4 生根培養
選用5個品種(R4、R5、R8、R15、R17)進行生根培養,4種激素組合如下:①1/ 2 MS+ NAA 0.1mg/L;②1/ 2 MS+NAA 0.5mg/L;③1/2 MS+IAA 0.1mg/L;④1/2 MS+IAA 0.5mg/L。每處理植株20棵,重復3次。
1.5 移栽與成苗
當組培苗根系長達1~3cm時,取出幼苗移栽到泥炭土基質中,澆水使基質保持濕潤,覆蓋塑料薄膜保持濕度,7d后逐漸揭膜通風透氣。
2 結果與分析
2.1 微型月季品種間叢生芽誘導的差異
不同的品種在誘導培養基下的叢生芽誘導效率表現出很大的差異(表1)。有9個品種良好,叢生芽的增殖速度快,生長勢較強,植株健康,占供試品種總數的41%;有7個品種表現一般,生長勢也一般,植株健康,但叢生芽的增殖速度緩慢,不能達到生產上的需求,占供試品種總數的32% ;有6個品種表現較差,生長勢較弱,植株呈淺黃色,叢生芽的獲得極為困難,占供試品種總數的27%。

表1 微型月季不同品種的叢生芽誘導難易程度和誘導狀態
2.2 不同濃度6-BA對微型月季叢生芽增殖效果的影響
從圖1可以看出,當NAA濃度為0.3mg/L、不添加6-BA時,植株表現為莖節伸長,葉片增大,基部容易產生大量愈傷組織,平均株高為1.8cm,增殖倍數為0.6。添加6-BA后,當其濃度為1.0mg/L時,植株表現為莖節粗壯而直立,葉色濃綠,平均株高為1.6cm,增殖倍數為2.0,誘導率可達100%。隨著6-BA濃度的繼續增加,分化率不斷降低。當6-BA濃度為5.0mg/L 時,植株表現為莖細長而瘦弱,平均株高為1.9cm,增殖倍數為0.7,誘導率僅達到20%。

圖1 不同6-BA濃度下微型月季品種R4叢生芽的增殖狀態
2.3 不同品種微型月季試管苗的生根能力比較
試管苗接種到生根培養基上,5~7d開始長出新根,經45d培養后,生根狀態基本穩定。添加了0.1mg/L IAA和0.5mg/L NAA培養基的生根情況最好,生根率分別達到42%和43%,根長平均分別為1.7cm和1.1cm(表2)。在所有的生根培養基中,生根率均沒有超過50%。
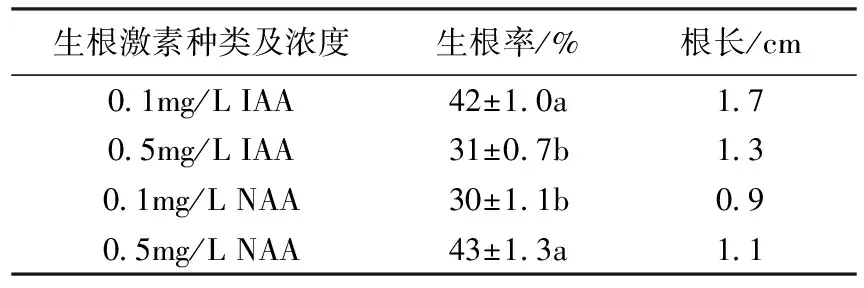
表2 生根激素對微型月季生根的影響
微型月季各品種的生根率差異顯著(表3)。品種R5雖然苗的生長狀態差,但其生根率以及每個叢生芽的生根條數達到最高,分別為75%和2.1條;品種R4苗的生長狀態最好,但其生根率以及每個叢生芽的生根條數達到最低,分別為31%和0.6條;品種R8和R15苗的生長狀態一般,生根率以及每個叢生芽的生根條數分別為32%、0.6條和41%、1.8條。品種R17在4種生根培養基上的生長勢均較差,組培苗幾乎全部死亡。

表3 不同品種微型月季組培苗的生根率
3 討論與結論
1)據報道,叢生芽的增殖主要依靠細胞分裂素和生長素的配合誘導,隨著6-BA濃度的提高(1~3mg/L),叢生芽的增殖系數也相應提高,6-BA和NAA 的組合基本可以滿足誘導叢生芽的要求[5~9]。本研究中,近一半的供試品種可以完成無菌體系的建立和叢生芽誘導。微型月季除了品種間叢生芽誘導效率的差異,無菌體系建立和叢生芽誘導體系初步建立過程中遇到的問題還表現在內生菌和黃化2個方面。內生菌表現為前期叢生芽的生長狀態良好,植株健壯,葉色濃綠,隨著繼代次數的增加,叢生芽的根部位置會出現奶白色的不規則菌落,從而導致叢生芽的生長速度減慢和葉片變黃。張作梅[10]的研究表明,有些植物種類的內生菌污染發生頻率較高,成為組培試驗失敗的一個重要原因。內生菌是指生活在植物組織內的微生物,用于區分那些生活在植物表面的表生菌。由于植物導管直徑大于細菌100倍以上,細菌完全能夠通過外植體導管進入到外植體內部,成為外植體的內生菌,引起接種后的組培苗污染。可采用抑制措施主要有:①外植體材料預處理;②接種后勤檢查,及時檢出污染的和轉移未污染的外植體;③可在培養基中加入防腐劑和抗生素以及醫用殺菌劑混合物等措施進行抑制[11,12]。黃化表現為叢生芽對培養基的極度不適,健壯的叢生芽接種于培養基后,會出現植株瘦弱、下部葉片發黃和頂端發褐等現象,直至最后枯死。目前黃化的根本原因尚無定論,可能與材料的切割、激素的逐漸積累等原因有關。克服植物組織培養中叢生芽黃化現象發生,主要是及時地切割叢生芽,切割時應盡可能減小傷口面積,并縮短切口暴露在空氣中的時間。切口過大易使細胞受損,酚類化合物外溢,因酚類化合物很不穩定,在酶的催化下迅速氧化而形成褐色醌類物質,進一步與組織中的蛋白質發生聚合,導致整個組織代謝紊亂甚至死亡。
2)激素濃度配比是月季叢生芽增殖的關鍵。孫堅紅等[13]報道,6個不同的微型月季供試品種適宜的培養基有所不同。閆海霞等[14]研究表明,低濃度的6-BA有利于芽的增殖,高濃度對芽增殖有抑制作用,適宜的NAA濃度有利于芽和葉生長,偏高則會產生大量愈傷組織,不利于側芽的直接分化和生長。馮歡等[6]的研究表明,6-BA濃度的增大使所形成的愈傷組織致密且含水量低,不利于再分化。沈國正等[15]報道微型月季的腋芽在單獨使用6-BA的培養基上均能誘導芽的萌發,低濃度(0.25~0.5mg/L)有利于提高芽的萌發率,較高濃度有利于誘導叢芽,并且以1.0~1.5mg/L為最佳。冷肖荀等[16]的研究表明,6-BA的最適濃度為 2.0~2.5mg/L,低于2mg/L時,分化能力差,分化時間長;當6-BA為3mg/L時,一部分苗呈水浸狀。本研究中,6-BA在微型月季叢生芽增殖中也起著關鍵的作用。
3)微型月季組培苗的生根不同于其他組培苗的生根,幼嫩的叢生芽不易生根,與田間扦插的插穗相似,組織太嫩不易生根,而半木質化的插穗更易生根[17]。因此壯芽培養是必須的,經過壯芽培養來提高叢生芽的木質化程度,再進行生根培養才能達到較高的生根率。此外,生根培養上的表現差異,可能與不同品種的遺傳背景不同有關。生根后的組培苗經過煉苗移栽,生長狀態與扦插苗無明顯的區別。
4)引進的微型月季品種,在花色、花形及適應性等方面有差異,離體培養中在無菌體系建立時間長短、試管苗成活率、叢生芽增殖及生根能力等方面均有不同。研究各種基因型微型月季的無菌體系建立和叢生芽誘導頻率的差別,以提高微型月季組織培養效率,節約組培成本,對于早日實現微型月季種苗工廠化生產具有重要意義。
[1]Hasegawa P M.Factors Affecting Shoot and Root Initiation from Cultured Rose Shoot Tips[J].J Amer Soc Hort Sci,1980,105:216~220.
[2]沈國正,錢麗華,趙杭蘋.盆栽微型月季離體培養繁殖技術探討[J].浙江農業科學,2006,(4):398~400.
[3]于冰沁.微型月季組織培養的研究[J].遼寧農業科學,2005,(4):53~54.
[4]劉義存.微型月季的離體培養與試管開花研究[D].重慶:西南大學,2007.
[5]葉貽勛,黃青峰,黃瑞方,等.月季的離體快速繁殖技術[J].福建農業大學學報,2000,29(2):172~175.
[6]熊芳,吳安湘.月季快速繁殖技術研究[J].中南林學院學報,2006,26(4):121~124.
[7]徐秋燕,楊平,張邊江.不同激素對月季莖段扦插和組織培養的影響[J].湖北農業科學,2012,51(9):1904~1906.
[8]陳育青.月季的離體培養及快速繁殖研究[J].江西農業學報,2006,18(3):104~105.
[9]李海燕,胡國富,胡寶忠.月季組培快繁技術的研究[J].東北農業大學學報,2014,35(1):84~88.
[10]張作梅.微型月季組培快繁技術體系的研究[D].合肥:安徽農業大學,2009.
[11]馬翠萍.植物組培污染防治的研究[D].泰安:山東農業大學,2002.
[12]周俊輝,周厚高.植物組織培養中內生菌污染問題[J].廣西植物,2003,23(1):41~47.
[13]孫堅紅,錢麗華.微型月季離體培養繁殖技術的探討[J].杭州農業科技,2004,(1):10~11.
[14]閆海霞,蔣月喜,黃昌艷,等.月季“卡羅拉”的組培快繁技術[J].熱帶作物學報,2016,37(9):1741~1746.
[15]沈國正,錢麗華,趙杭蘋.盆栽微型月季離體培養繁殖技術探討[J].浙江農業科學,2006,1(4):398~400.
[16]冷肖荀.月季的組織培養[J].河北林業科技,2001,(6):6~7.
[17]李曉亮,張軍云,張鐘,等.滇紅食用玫瑰莖段增殖培養基的試驗篩選研究[J].中國農學通報,2015,31(25):145~150.
[編輯] 余文斌

