電石渣制備過氧化鈣液相循環工藝的研究*
熊 磊 ,藍師文 ,鄒友琴 ,蔣柏泉 ,
(1.南昌大學科學技術學院生物化學系,江西南昌330029;2.南昌大學資源環境與化學工程學院)
電石渣是電石法生產聚氯乙烯(PVC)過程中產生的主要固體廢棄物,每生產1 t的PVC可副產1.5~1.9 t電石渣。若未經處理而將電石渣任意丟棄或露天堆放,不僅會占用和侵蝕土地,而且還會污染河流水域,嚴重破壞生態環境。近年來,中國廣大科研人員對電石渣綜合利用的研究十分活躍,在利用電石渣制備水泥[1]、高附加值碳酸鈣[2-3]、改性聚氯乙烯[4]、多孔水化硅酸鈣[5]、混凝劑[6]、低強度材料[7]等有用的工業產品和處理煤礦酸性廢水[8]、電鍍廢水[9-10]和吸收/分離 CO2[11]等三廢治理方面都做了大量的研究工作,并取得了一定的成效。筆者利用氯化銨溶液提取電石渣中的鈣離子,再與過氧化氫反應,制備高純過氧化鈣,同時將副產的氯化銨溶液循環使用,以期取得經濟、環保雙重效益,為合理有效利用電石渣探索一條新的出路。
1 實驗
1.1 原料、試劑與儀器
原料:電石渣,取自南昌市某化工廠。
試劑:氯化銨(AR),廣東臺山化工廠;鈣-羧酸指示劑(AR),上海展云化工廠;三乙醇胺(AR)、磷酸二氫鈉(AR),西隴化工有限公司;氫氧化鈉(AR)、雙氧水(質量分數為30%),天津大茂化工廠。
儀器:FA2104型電子分析天平、SHZ-D(Ⅲ)型循環水式真空泵、S-212型恒速攪拌器、PHS-3E型精密PH計、D8 Advcance型X射線衍射儀、Quanta 200型掃描電鏡。
1.2 實驗過程
電石渣預處理:將膏狀固體電石渣經過水洗、熱烘(105℃±5℃)和粉碎后得到干渣供實驗用。測得干渣中鈣質量分數為64.09%(以CaO計)。
電石渣提鈣:將過量的電石渣粉加入一定濃度的NH4Cl溶液中反應,反應結束后經過濾得到氯化鈣和氨水的混合溶液,反應方程式:

過氧化鈣制備:將由電石渣提鈣過程得到的混合溶液調節至規定濃度后加入雙氧水中,反應后過濾,得含有結晶水的CaO2,其反應方程式為式(2),再烘干脫水后得CaO2產品,其反應式為式(3):

液相循環:將反應式(2)產物過濾后所得濾液(NH4Cl為主要溶質)經測濃后循環用于反應(1)的電石渣提鈣。
圖1為上述工藝過程的流程示意圖。

圖1 電石渣制備過氧化鈣的液相循環工藝流程圖
1.3 鈣含量測定
鈣含量按GB/T 19281—2003《碳酸鈣分析方法》測定并按下式計算:
w1=c(V-V0)M1/(m×103×25/250)×100%=c(V-V0)M1/(m×100)×100%
式中,w1為電石渣中的鈣含量 (以CaO的質量分數計),%;c為乙二胺四乙酸二鈉(EDTA)的濃度,mol/L;V為消耗 EDTA的體積,mL;V0為空白試驗消耗EDTA的體積,mL;M1為CaO的相對分子質量;m為電石渣的質量,g。
1.4 鈣提取率計算
鈣提取率按下式計算:

式中,ωCa為鈣提取率,%;m1為濾液中鈣的質量,g;m2為電石渣中鈣的質量,g。
1.5 氯化銨利用率計算
氯化銨利用率按下式計算:

式中,ωNH4Cl為氯化銨利用率,%;m3為反應消耗的氯化銨質量,g;m4為實際添加的氯化銨質量,g。
1.6 過氧化鈣含量的測定
精確稱取0.5 g產品置于100 mL燒杯中,加少量水潤濕后用鹽酸全部溶解,轉移至250 mL容量瓶中定容。移取25 mL上述溶液置于250 mL錐形瓶中,加入三乙醇胺溶液5 mL、水25 mL和少量鈣-羧酸指示劑,用NaOH溶液調成酒紅色,并過量0.5 mL,用EDTA標準液滴定至純藍色(V)。同法做空白試驗(V0)[12]。
鈣離子含量計算:

式中,mCa為鈣離子質量,g;MCa為鈣的原子質量。
過氧化鈣含量計算:

式中,mCaO2為 CaO2的質量,g;MCaO2為過氧化鈣相對分子質量。
1.7 過氧化鈣產率和純度的計算
過氧化鈣產率按下式計算:

式中,θ為過氧化鈣產品的產率,%;m1為實際制備所得產物的質量,g;m理為過氧化鈣的理論產量,g。
過氧化鈣純度按下式計算:

式中,η為產品純度,%;m2為產物中過氧化鈣的質量,g。
1.8 原料和產品物相分析與表征
原料和產品采用D8型X-射線衍射儀分析;產品的表面形貌采用Quanta 200型掃描電鏡觀察。
2 結果與討論
2.1 鈣提取工藝優化

表1 工藝參數對電石渣鈣提取率和氯化銨利用率的影響
固定NH4Cl溶液(質量分數為10%)添加量為62 g,考察工藝參數電石渣過量分數(%)、攪拌速度(r/min)和反應時間(min)對鈣提取率(ωCa)和氯化銨利用率(ωNH4Cl)的影響,結果見表1。由表1可知,鈣提取率和氯化銨利用率均隨電石渣過量分數、攪拌速度和反應時間的增加而提高,當電石渣過量20%、攪拌速度為300 r/min、反應時間為30 min時,鈣提取率和氯化銨利用率分別達到最大值83.30%和98.50%。然而,當進一步提高這3個因素值時,由于此時氯化銨已基本消耗完全,反應接近平衡,對鈣提取率和氯化銨利用率的提高已無明顯作用。因此確定適宜的反應條件:電石渣過量20%、攪拌速度為300 r/min、反應時間為30 min。
2.2 過氧化鈣制備工藝優化
2.2.1 單因素實驗
通過單因素實驗,分別考察了穩定劑(磷酸二氫鈉)用量(質量分數,%)、混合液用量(以氯化鈣過量分數計,%)、反應時間(min)和攪拌速度(r/min)等工藝參數對過氧化鈣產率(%)的影響。結果見表2。由表2可知,穩定劑用量越大,過氧化鈣產率越高,但用量過大,成本會上升;產率隨混合液用量增大而提高,但用量超過10%時,產率提高不明顯;反應時間延長有利于產率提高,但時間太長,過氧化鈣會在水中緩慢分解,使產率降低;攪拌速度過低,體系混合不充分,反應物粒子碰撞幾率較小,產率不高,但超過600 r/min后,過快的攪拌速度會造成雙氧水及產品過氧化鈣的雙重分解,同時也會帶來能耗增加。根據上述分析,可確定最佳工藝參數:穩定劑用量為8%、混合液用量為10%、混合液濃度2 mol/L,反應時間為20 min、攪拌速度為300 r/min。在此條件下,過氧化鈣產率接近80%,純度為67.45%。

表2 工藝參數對過氧化鈣產率的影響
2.2.2 正交實驗
根據單因素實驗結果,取穩定劑用量(A)、混合液用量(B)、反應時間(C)和攪拌速度(D)做 4 因素4水平正交實驗,并進行二次優化。正交實驗因素水平值見表3,正交實驗結果及極差、方差分析見表4。
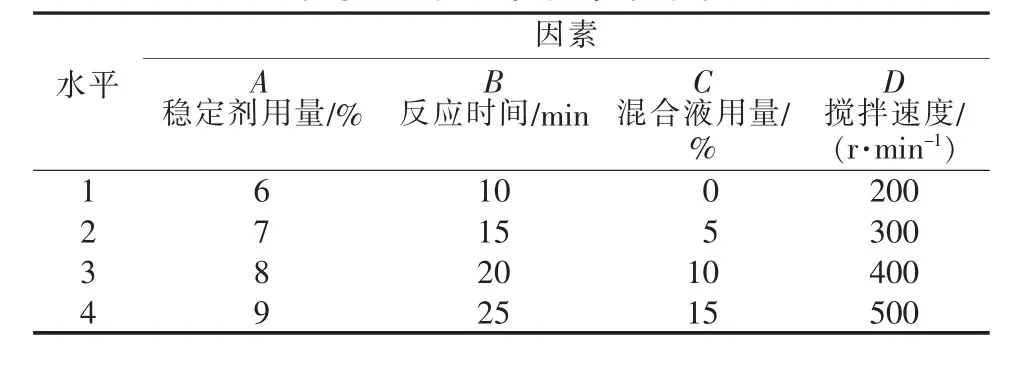
表3 正交實驗因素水平表

表4 正交實驗結果
由表4中R值可知,各因素對產率影響程度大小的主次順序為A>D>C>B,即穩定劑用量>攪拌強度>混合液用量>反應時間。根據k值可知最優水平組合為A4B3C2D4,即穩定劑用量為9%、反應時間為20 min、混合液用量為5%、攪拌速度為500 r/min。在此條件下做3次平行實驗驗證,結果得到產品平均收率為94.69%,平均純度為69.74%。
2.3 氯化銨溶液循環工藝
2.3.1 循環液pH測定
將制備過氧化鈣過程中的副產氯化銨溶液取樣,測定其pH,結果見表5。由表5可知,循環液pH符合工藝要求范圍。2.3.2 循環液氯化銨含量測定

表5 循環液中的pH(23.3℃)
采用銀量法測定循環液中氯化銨的含量,結果見表6。根據表6數據,通過適當調配制成所需濃度氯化銨溶液后循環使用。
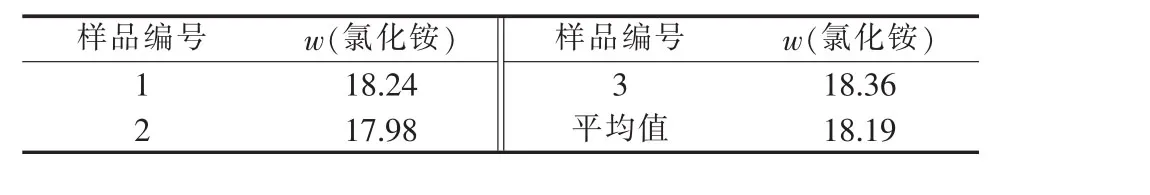
表6 循環液中氯化銨含量 %
2.3.3 循環工藝驗證
取一定量的已調配成所需濃度的副產氯化銨溶液,用于鈣提工藝過程,在電石渣過量20%、攪拌速度為300 r/min、反應時間為30 min的條件下操作,結果見表7。由表7可知,濾液循環提鈣效果較為理想,與氯化銨原料效果相當。
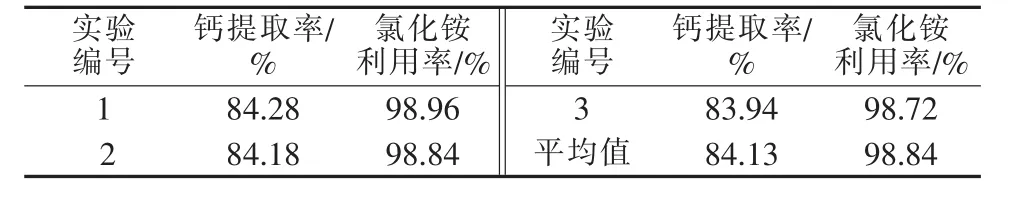
表7 循環工藝實驗結果
2.4 原料和產品表征
2.4.1 XRD物相分析
圖2~3為原料電石渣和產品過氧化鈣的XRD譜圖。由圖2可以看出,原料電石渣主要以氫氧化鈣為主,含有少量 Al、Si的氧化物雜質[13]。 圖 3 經與JCPDS標準卡片對照,證明為碳酸鈣型CaO2,該結果與文獻[14]基本一致。
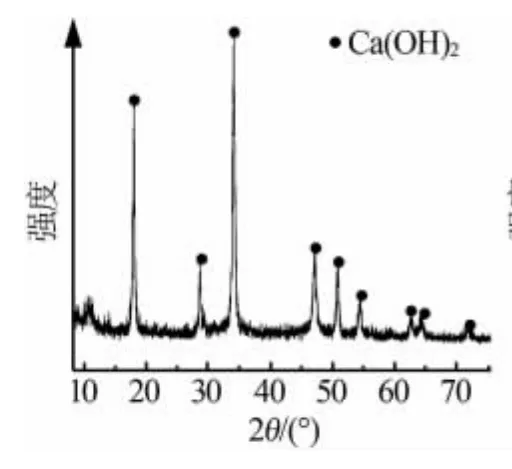
圖2 原料電石渣的XRD譜圖

圖3 過氧化鈣產品的XRD譜圖
2.4.2 SEM表征
圖4為實驗所得產品的SEM照片。由圖4可知,產品基本呈球形顆粒狀,大小和分布都比較均勻。

圖4 產品的SEM表面形貌照片
3 結論
本工藝過程主要包括3個步驟:1)用氯化銨溶液與電石渣中的氫氧化鈣反應,得到氯化鈣和氨水的混合溶液;2)混合溶液與過氧化氫溶液反應制得產物過氧化鈣,并副產氯化銨溶液;3)過氧化鈣經干燥后獲得最終產品,而副產氯化銨溶液經檢測含量后代替原料氯化銨循環使用。
實驗證明該循環工藝切實可行,具有環保、經濟雙重效益和潛在的工業化應用前景。通過單因素實驗確定了鈣離子提取的最佳工藝條件:電石渣過量20%、攪拌速度為300 r/min、反應時間為30 min。此時鈣離子提取率為83.30%,氯化銨利用率為98.50%。通過單因素實驗和正交實驗2次優化,確定了過氧化鈣制備的最佳工藝條件:穩定劑用量9%(質量分數)、反應時間為20 min、混合液用量為5%、攪拌速度為500 r/min。此時產品收率為94.69%,純度為69.74%。
[1]姜文剛.采用100%電石渣生產高抗硫酸鹽硅酸鹽水泥熟料[J].水泥,2016(6):18-19.
[2]梁博,韓鳳蘭.電石渣制備碳酸鈣微粉的晶型轉變[J].無機鹽工業,2016,48(10):63-67.
[3]王百年,葛禮響,曹萌,等.高Ca2+濃度CO2沉淀法由電石渣制備納米 CaCO3[J].化工環保,2016,36(4):460-465.
[4]陳韓江,田生慧,何慧.電石渣增強改性聚氯乙烯塑料[J].高分子材料科學與工程,2015,31(12):98-103.
[5]周君生,徐偉,陳益蘭,等.用工業廢渣生產多微孔膠凝材料的研究[J].無機鹽工業,2012,44(9):39-41.
[6]張衛紅,郝麗娟,安永樂.聚合硅酸硫酸鈣鋁混凝劑的制備工藝研究[J].硅酸鹽通報,2013,32(12):2627-2631.
[7]張駿,藍思杰,李陽,等.用電石渣、鋼渣和煤矸石制備可控性低強度材料[J].環境工程學報,2016,10(4):1967-1972.
[8]胡文,康媞,丁劍秋.電石渣處理煤礦酸性廢水技術的研究[J].環境工程,2013(增刊):139-146.
[9]潘燕鋒.電石渣在電鍍廢水處理中的應用[J].廣東化工,2012,39(5):144-145.
[10]申榮平.電石渣在含鉻廢水處理中的應用[J].廣東化工,2013,40(13):145-146.
[11]龔德鴻,張忠孝,朱兵,等.電石渣循環吸收/分離CO2特性研究[J].化工新型材料,2017,45(2):213-215.
[12]高譽,馬兵,潘易,等.過氧化鈣含量分析方法的比較研究[J].湖北農業科學,2011,50(17):3625-3627.
[13]蔣明,劉紅盼,黃小鳳.電石渣在環境污染控制中的應用[J].無機鹽工業,2017,49(3):6-8.
[14]翟永青,魯秀國,丁士文,等.過氧化鈣常溫水相法合成新工藝的研究(Ⅱ)[J].河北大學學報:自然科學版,2000,20(2):140-143.

