si-RNA介導FGFR1基因沉默對胃癌細胞生長及凋亡的影響
許超超 金嶸 顏小丹 葉麗萍
據Jemal等[1]報道,2008年世界范圍有近10萬例新發(fā)胃癌患者和73萬余例胃癌患者死亡,超過70%的新發(fā)和死亡病例發(fā)生在發(fā)展中國家,其中發(fā)病率最高的是在亞洲東部、東歐和南美。雖然外科手術和術后輔助化療已經改善了胃癌患者的預后,但是胃癌的總體存活率并不令人滿意。因此,了解胃癌發(fā)生、發(fā)展的分子機制和開發(fā)新的靶向治療藥物是必要的。成纖維細胞生長因子受體 1(fibroblast growth factor receptor 1,FGFR1)是一種高度保守的酪氨酸激酶(RTK)受體,通過與成纖維細胞生長因子(FGFs)結合,可以激活下游的一系列通路,在腫瘤細胞的分化、增殖以及腫瘤血管的生成中起到重要作用[2]。已有研究報道,FGFR1在胃癌組織中呈高表達,且在胃癌的發(fā)生、發(fā)展中扮演著重要角色[3]。進一步研究表明,在胃腺癌中FGFR1高表達與否與胃癌患者的 10年生存率相關[4];而且Wen等[5]和 Xu等[6]發(fā)現FGFR1不僅在胃癌組織中是擴增的,在胃癌細胞中也是擴增的,當FGFR1被小分子抑制劑L6123抑制或miR-133b沉默后,可以抑制胃癌細胞的增殖。本研究采用小干擾 RNA(small interfering RNA,siRNA) 介導FGFR1基因沉默來探討其對胃癌細胞SGC-7901生長及凋亡的影響,現報道如下。
1 材料和方法
1.1 實驗材料 人正常胃黏膜上皮細胞GES-1購自中國科學院細胞庫/中國科學院上海生命科學研究院細胞資源中心;人胃癌細胞SGC-7901購于中南大學湘雅細胞中心;人胃癌細胞株SGC-7901、人正常胃黏膜上皮細胞GES-1均用含10%FBS的RPMI-1640完全培養(yǎng)基進行培養(yǎng);所有細胞株均在恒溫培養(yǎng)箱中培養(yǎng)(條件為:37℃、5%CO2、濕度 95%),每隔 1~2d 更換新鮮的培養(yǎng)基,并在細胞長至70%左右,進行傳代、凍存或者下一步實驗。
1.2 方法
1.2.1 Western blotting法檢測細胞中FGFR1蛋白的表達情況 根據Genbank中提供的FGFR1基因序列,設計相應siRNA的序列,靶向FGFR1的siRNA序列:5′-GGAGGUGCUUCACUUAAGATT-3′,陰性對照(NC)的 siRNA 序列:5′-UUCUCCGAACGUGUCACGUTT-3′;取對數期生長的胃癌細胞SGC-7901,分3組:NC-siRNA組(轉染NC的siRNA)、siRNA-FGFR1組(轉染靶向FGFR1的siRNA)及空白組(加入相應劑量的滅菌水),先用250μl無血清的培養(yǎng)基分別與Lipofectamine2000(5μl)和 siRNA(5μl)各自混合均勻,再將Lipofectamine2000和siRNA混合均勻,最后將混合后的Lipofectamine2000和siRNA加入6孔板中,采用無血清培養(yǎng)基,培養(yǎng)6h后換成有血清的培養(yǎng)基;2d后收蛋白,采用Western blotting法檢測細胞中FGFR1蛋白的表達情況。
1.2.2 MTT法檢測細胞增殖情況 取對數生長期的胃癌細胞SGC-7901,分3組,NC-siRNA組、siRNA-FGFR1組及空白組,接種于96孔板(每孔3000~5000個細胞),用配置好的培養(yǎng)基進行培養(yǎng);在鋪板后的 0、24、48h,觀察每組細胞的生長情況并在每個小孔中加入配置好的 MTT(5mg/ml)25μl,置于培養(yǎng)箱培養(yǎng) 4h,之后加入150μlDMSO用來溶解結晶,最后酶標儀490nm下讀取OD值,檢測細胞的增殖能力。
1.2.3 克隆集落形成試驗檢測增殖情況 取對數期生長的胃癌細胞SGC-7901,鋪于6孔板中(1000個/孔)并輕輕搖晃,使細胞分散均勻,靜置培養(yǎng)2周;當培養(yǎng)皿中出現肉眼可見的克隆時,即可終止培養(yǎng),棄去上清液,用PBS小心浸洗1次,加4%多聚甲醛固定15min,然后去固定液,用PBS再次小心浸洗1次,最后用結晶紫染色20min,用PBS洗去染色液,待干燥后觀察并拍照,觀察細胞集落形成的大小。
1.2.4 流式細胞術分析細胞凋亡情況 取對數期生長的胃癌細胞SGC-7901,鋪于6孔板中培養(yǎng),貼壁過夜;培養(yǎng)48h后,收取原先的培養(yǎng)基和清洗所用的PBS,然后再收集貼壁的胃癌細胞,4℃、1000r/min,離心4min,棄上清液,并用PBS清洗1次后,繼續(xù)相同條件下離心,保留沉淀,最后加入200μl Binding-buffer重懸沉淀;接著取100μl的細胞重懸液,先用Annexing-V(3μl)染色 10min,接著用 PI(1μl)繼續(xù)染色 5min,最后用Binding-buffer混合均勻后在流式細胞儀上分析細胞凋亡情況。
1.2.5 Hoechst染色法分析細胞凋亡情況 取經70%乙醇浸泡過的蓋玻片,用PBS洗滌以及酒精燈上過火消毒后放置在6孔板中,將對數期生長的胃癌細胞SGC-7901接種于6孔板上(30~40萬個/孔),過夜貼壁,分3組,NC-siRNA組、siRNA-FGFR1組及空白組;培養(yǎng)48h,吸盡培養(yǎng)基后并用固定液固定15min,PBS清洗7min×3次,加入500μl的Hoechst染色液,避光染色10min后繼續(xù)用PBS清洗7min×3次,最后加入適量的抗熒光淬滅劑,并在熒光顯微鏡下觀察細胞核的形態(tài)學變化。
1.3 統(tǒng)計學處理 采用GraphPad Prism 5.0統(tǒng)計軟件,計量資料以表示,組間比較采用t檢驗。P<0.05為差異有統(tǒng)計學意義。
2 結果
2.1 FGFR的表達量及siRNA轉染效果 見圖1。
由圖1a可見,與人正常胃黏膜上皮細胞GES-1(OD值:0.19±0.03)相比,FGFR1蛋白在胃癌細胞 SGC-7901(OD 值:0.77±0.08)中表達增高(t=6.69,P<0.05)。由圖 1b可見,與空白組(OD 值:0.96±0.08)相比,NC-siRNA組(OD 值:0.88±0.13)對FGFR1蛋白表達的抑制差異無統(tǒng)計學意義(t=0.71,P>0.05);而siRNA-FGFR1組(OD值:0.15±0.05)顯著抑制了FGFR1蛋白的表達(t=12.55,P<0.01)。
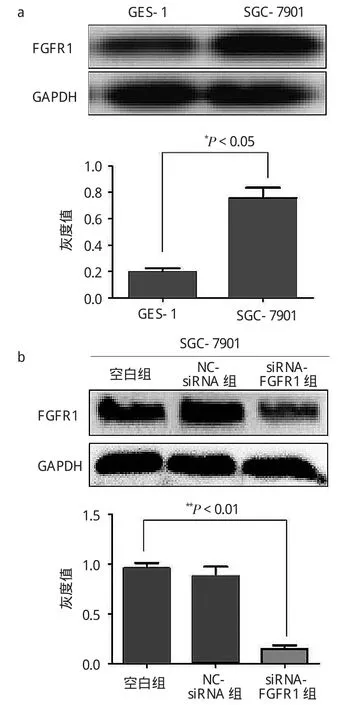
圖1 Western blotting法檢測FGFR1蛋白的表達量
2.2 SGC-7901細胞轉染siRNA后對細胞增殖的影響 見圖 2、3。

圖2 SGC-7901細胞轉染si-RNA后細胞的生長曲線
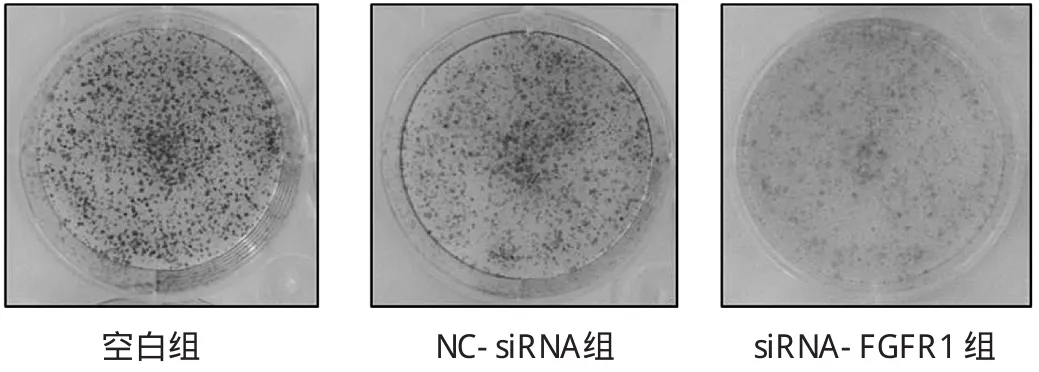
圖3 克隆集落形成試驗檢測S GC-7901細胞轉染si-RNA后細胞集落形成能力
由圖2可見,在轉染后的48h,空白組(OD值:0.62±0.03)和 NC-siRNA 組(OD 值:0.52±0.07)比較差異無統(tǒng)計學意義(t=1.37,P>0.05),siRNA-FGFR1組(OD值:0.27±0.04)與空白組相比,細胞的生長明顯抑制(t=12.21,P<0.01)。由圖3可見,siRNA-FGFR1組SGC-7901克隆集落形成在3組中最小,克隆集落形成實驗結果與細胞增殖實驗結果一致。
2.3 SGC-7901細胞轉染siRNA后對細胞凋亡的影響見圖 4、5。
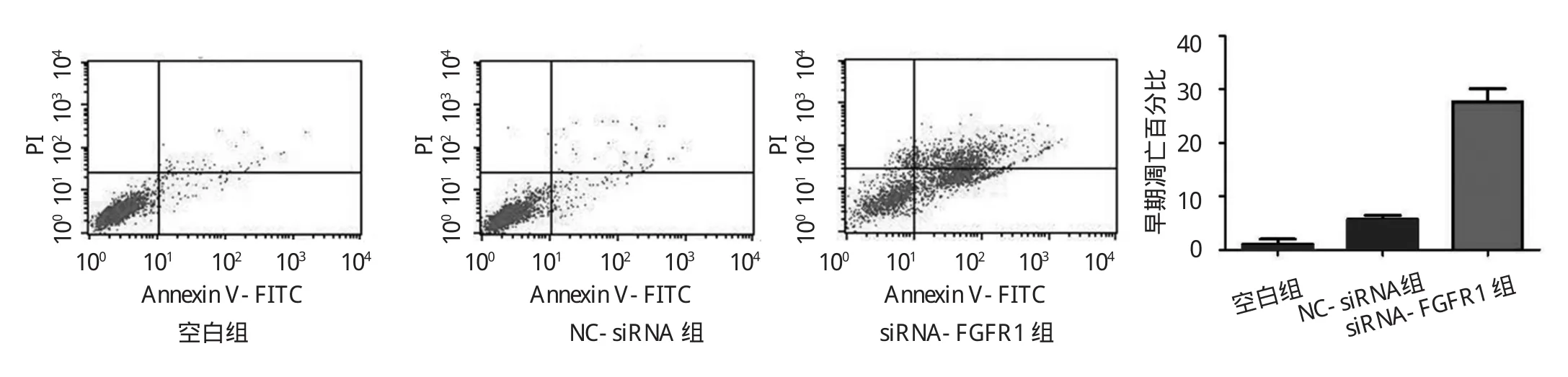
圖4 流式細胞儀檢測SGC-7901細胞轉染s i-R N A后細胞的凋亡情況
由圖 4可見,空白組(1.06±1.35)與 NC-siRNA 組(5.70±1.03)中胃癌SGC-7901細胞早期凋亡百分比差異無統(tǒng)計學意義(t=3.86,P>0.05),而 siRNA-FGFR1組(27.65±3.49)較空白組細胞早期凋亡百分比顯著升高(t=10.05,P<0.01)。由圖 5可見,Hoechst染色法的檢測呈現出同樣的結果,siRNA-FGFR1組顯著增加了細胞核裂解和濃縮的比例,細胞核呈亮藍色,可見核呈分葉,碎片狀改變。
3 討論
FGFRs是酪氨酸激酶受體,由胞外配體結合域、跨膜結構域和細胞內酪氨酸激酶結構域3部分組成,目前已經有4種受體蛋白被發(fā)現(FGFR 1~4)。FGFRs的突變激活或過量表達與包括乳腺癌、膀胱癌、多發(fā)性骨髓瘤、肝癌、腎細胞癌在內的多種癌癥的發(fā)展及腫瘤周圍血管的生成密切相關。
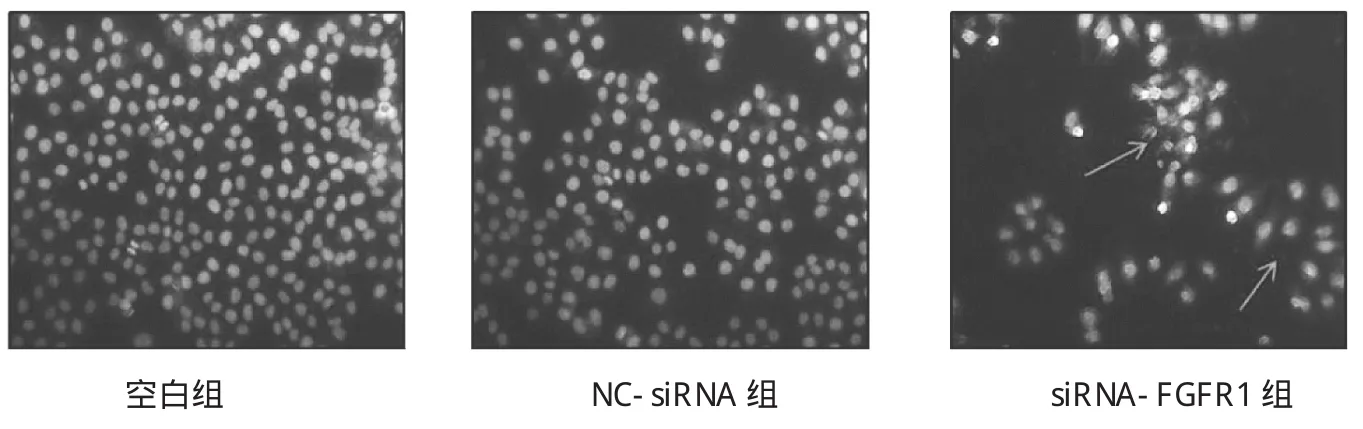
圖5 Hoechst 33258檢測SGC-7901細胞轉染si-RNA后細胞核形態(tài)的變化
在FGFR1擴增的腫瘤中,小分子ATP競爭性抑制劑或siRNA可通過下調FGFR1的表達來發(fā)揮良好的抗腫瘤效果。一些學者發(fā)現FGFR1在非小細胞肺癌中是高表達的,當FGFR1被小分子抑制劑(AZD4547、NDGA類似物等)下調后可以有效抑制腫瘤細胞的增殖[7-9]。同樣是肺癌,還有學者發(fā)現在小細胞肺癌中FGFR1也是高表達的,且與肺癌患者的生存率密切相關[10-11]。在乳腺癌中,一些學者發(fā)現FGFR1的高表達與患者的預后、腫瘤大小以及淋巴結轉移等相關,且PD166866(FGFR1小分子抑制劑)可以有效抑制乳腺癌細胞的增殖并促進其凋亡[12-15]。Koole等[16]發(fā)現在頭頸部鱗狀細胞癌中(不管是否存在人類乳頭瘤病毒感染),FGFR1都是高表達的,而且FGFR抑制劑不僅可以抑制癌細胞增殖,還可以與化療藥物聯合而發(fā)揮更明顯的抗腫瘤效果。因此FGFR1在癌癥的治療中可以作為一個有效的靶點。
為了特異性地研究FGFR1對胃癌細胞生物學行為的影響,本研究選擇FGFR1相對表達量較高的胃癌細胞株SGC-7901作為基因沉默研究模型。Western blotting證實siRNA-FGFR1可顯著抑制FGFR1蛋白的表達;并在FGFR1蛋白表達受到穩(wěn)定沉默后,胃癌細胞時間生長曲線結果顯示,在轉染后的48h細胞增殖受到明顯抑制,而且克隆集落實驗也表明siRNA-FGFR1成功抑制了胃癌細胞克隆集落的形成;此外在促進細胞凋亡方面,流式細胞術結果顯示,siRNA-FGFR1可以顯著促進胃癌細胞的早期凋亡,而且通過Hoechst染色法發(fā)現在細胞的形態(tài)學方面,當FGFR1被沉默后胃癌細胞SGC-7901的細胞核裂解和濃縮的比例也較空白組有增加。
本實驗初步證實了以FGFR1為目的基因,通過siRNA技術成功抑制了其在胃癌細胞SGC-7901中的表達,同時發(fā)揮了顯著的抑制胃癌增殖以及誘導胃癌細胞凋亡的抗腫瘤效果,但是其潛在機制有必要進一步研究,而這也正是下一步筆者研究的重點,除此之外,上皮-間質轉化(EMT)是癌癥進展的核心過程,與癌細胞侵犯間質組織并遷移到其他區(qū)域的能力有關,最近已有研究發(fā)現,在頭頸部鱗狀細胞癌中,FGFR1抑制劑可以通過核轉染因子AP-1來影響上皮-間質轉化過程[17-18];筆者前期研究已經發(fā)現siRNA-FGFR1可以抑制胃癌細胞的侵襲[6],但是否與EMT以及AP-1有關,則需要進一步研究,以確定并闡明潛在的機制。
[1]JemalA,Bray F,Center MM,et al.Globalcancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]Brooks AN,Kilgour E,Smith PD.Molecular pathways:fibroblast growth factor signaling:a new therapeutic opportunity in cancer[J].Clin Cancer Res,2012,18(7):1855-1862.
[3]OkiM,Yamamoto H,TaniguchiH,et al.Overexpression of the receptor tyrosine kinase EphA4 in human gastric cancers[J].World J Gastroenterol,2008,14(37):5650-5656.
[4]Schafer MH,Lingohr P,Strasser A,et al.Fibroblast growth factor receptor 1gene amplification in gastric adenocarcinoma[J].Hum Patho,2015,46(10):1488-1495.
[5]Wen D,Li S,Ji F,et al.miR-133b acts as a tumor suppressor and negatively regulates FGFR1 in gastric cancer[J].Tumour Biol,2013,34(2):793-803.
[6]Xu C,Li W,Qiu P,et al.The herapeutic potential of a novel non-ATP-competitive fibroblast growth factor receptor 1inhibitor on gastric cancer[J].Anti-Cancer Drugs,2015,26(4):379-387.
[7]Zhang J,Zhang L,Su X,et al.Translating the therapeutic potential of AZD4547 in FGFR1-amplified non-small cell lung cancer through the use of patient-derived tumor xenograft models[J].Clinicalcancer research:an officialjournalof the American Association for Cancer Research,2012,18(24):6658-6667.
[8]Wu J,Ji J,Weng B,et al.Discovery of novel non-ATP competitive FGFR1 inhibitors and evaluation oftheir anti-tumor activity in nonsmall cell lung cancer in vitro and in vivo[J].Oncotarget,2014,5(12):4543-4553.
[9]Wang Y,Cai Y,Ji J,et al.Discovery and identification of new non-ATP competitive FGFR1 inhibitors with therapeutic potential on non-small-cell lung cancer[J].Cancer letters,2014,344(1):82-89.
[10]Park JS,Lee JS,Kim EY,et al.The frequency and impact of FGFR1 amplification on clinical outcomes in Korean patients with smallcelllung cancer[J].Lung cancer,2015,88(3):325-331.
[11]Thomas A,Lee JH,Abdullaev Z,et al.Characterization of fibroblast growth factor receptor 1in small-cell lung cancer[J].Journal of thoracic oncology:official publication of the International Association for the Study of Lung Cancer,2014,9(4):567-571.
[12]ShiYJ,Tsang JY,NiYB,et al.FGFR1 is an adverse outcome indicator for luminal A breast cancers[J].Oncotarget,2016,7(4):5063-5073.
[13]Tomiguchi M,Yamamoto Y,Yamamoto-Ibusuki M,et al.Fibroblast growth factor receptor-1protein expression is associated with prognosis in estrogen receptor-positive/human epidermal growth factor receptor-2-negative primary breast cancer[J].Cancer science,2016,107(4):491-498.
[14]Turner N,Pearson A,Sharpe R,et al.FGFR1 amplification drives endocrine therapy resistance and is a therapeutic target in breast cancer[J].Cancer research,2010,70(5):2085-2094.
[15]Chen Y,Xie X,Li X,et al.FGFR antagonist induces protective autophagy in FGFR1-amplified breast cancer cell[J].Biochemical and biophysical research Communications,2016,474(1):1-7.
[16]Koole K,Brunen D,van Kempen PM,et al.FGFR1 Is a Potential Prognostic Biomarker and Therapeutic Target in Head and Neck Squamous Cell Carcinoma[J].Clinical cancer research:an official journal of the American Association for Cancer Research,2016,22(15):3884-3893.
[17]Nieto MA.Epithelial plasticity:a common theme in embryonic and cancer cells[J].Science,2013,342(6159):1234850.
[18]Nguyen PT,Tsunematsu T,Yanagisawa S,et al.The FGFR1 inhibitor PD173074 induces mesenchymal-epithelial transition through the transcription factor AP-1[J].British journal of cancer,2013,109(8):2248-2258.

