負載型磷化鎳催化劑上乙酸加氫制乙醇反應宏觀動力學
任 杰, 吳鴻均, 袁海寬, 慎 煉
(浙江工業大學 化工學院, 浙江 杭州 310014)
乙醇作為一種清潔燃料,將其加入到汽油中,能夠改善汽油燃燒性能和減少污染物排放,得到國內外普遍關注。現在廣泛以農作物秸稈和林業加工廢料為原料生產乙醇,受到原料和技術的限制,生產成本較高,難以滿足燃料乙醇的需求。另外,煤制氣合成甲醇與甲醇羰基化合成乙酸工藝成熟且成本低廉,乙酸相對乙醇有較大的價格差。以煤基乙酸為原料通過催化加氫反應得到乙醇是由煤間接制液體燃料的有效途徑。因此,開展乙酸加氫制乙醇催化反應研究具有重要的意義。
乙酸加氫制乙醇的方法包括間接法和直接法,間接法是原料乙酸先酯化生成乙酸酯,乙酸酯加氫生成乙醇;而直接法是乙酸直接催化加氫生成乙醇,直接法比間接法的工藝流程簡單[1-3]。生成乙醇的催化加氫反應常用Pt、Pd等貴金屬催化劑,為了降低催化劑成本,非貴金屬催化劑的研究受到關注[4]。Cu基催化劑較早用于甲酸甲酯的催化加氫反應,具有較高的催化活性,但易發生熱失活[5-7]。以Fe2O3作為前驅體,石墨烯氧化物為載體,制備活性較高的鐵基加氫催化劑[8]。在制備負載型Ni基催化劑時加入Co、Cu、Fe、La、W等第二活性組分,提高了活性成分Ni的分散性,并且降低了Ni基催化劑的還原反應溫度[9-11]。經過浸漬、還原或硫化過程制備Mo-Ni/γ-Al2O3催化劑,還原處理后的催化劑的乙酸加氫活性明顯高于硫化處理,兩者的乙醇選擇性分別為23.80%和9.22%[12]。對Pt/γ-Al2O3催化劑進行堿金屬改性,鈍化催化劑表面酸性,降低乙酸加氫的乙酸乙酯選擇性,抑制催化劑結焦失活,提高催化劑活性穩定性[13]。
過渡金屬磷化物是一種新型加氫催化劑,首先用于加氫脫硫(HDS)和加氫脫氮(HDN),由于它比氮化物和碳化物具有更好的抗硫中毒性能,因而受到人們的極大關注[14]。在相同金屬負載量時,MoP/SiO2催化劑的HDS活性是MoS2/SiO2的4倍,MoP/Al2O3催化劑的HDN活性比MoS2/Al2O3高6倍[15-16]。在4-甲基酚加氫脫氧(HDO)中,隨著Mo基催化劑的MoO3、MoO2、MoS2和MoP中Mo的電子密度遞增,催化劑的加氫脫氧性能逐漸提高,MoP的催化性能最高[17]。磷化物催化劑的鄰甲氧基苯酚加氫脫氧活性穩定性好于CoMoS/Al2O3催化劑[18]。Fe2P/SiO2、Ni2P/SiO2和CoP/SiO2過渡金屬磷化物催化劑都具有較高的加氫精制初活性,只是Ni2P/SiO2催化劑的活性最高、活性穩定性最好[19]。Ni2P/SiO2的加氫脫氧催化性能優于Co2P/SiO2,并且當n(P)/n(Ni)=3時,催化活性較高[20]。在300℃、4.0 MPa條件下的苯酚加氫脫氧反應中,Ni2P/MCM-41催化劑的苯酚轉化率達到100%[21]。通過300℃磷化處理,制備Ni2P/Al2O3催化劑,由n(P)/n(Ni)=3初始原料制備的催化劑的二苯并噻吩加氫脫硫活性較高[22]。金屬Ti的引入改善Ni2P活性相的分散度,使Ni2P/Ti-MCM-41的加氫脫硫催化活性明顯高于Ni2P/MCM-41[23]。Ni2P/Ti-SBA-15催化劑加氫脫氮催化活性高于Ni2P/SBA-15,并且當n(Si)/n(Ti)=25時催化劑活性最高[24]。在負載型Ni2P催化劑制備過程中,Ni(H2PO2)2和NH4H2PO2熱分解生成Ni2P、P2O3、PH3、H2、NH3和水[25-26]。次磷酸鹽還原法制備金屬磷化物的關鍵是次磷酸根自身發生歧化反應,生成PH3氣體,然后PH3氣體將金屬離子還原,最終使其完全磷化[27-28]。目前,負載型磷化鎳催化劑用于乙酸加氫反應和動力學研究均鮮見報道。
筆者在制備Ni2P/SiO2催化劑的基礎上,經過乙酸加氫反應實驗、反應動力學模型方程推導和模型參數估值,研究了乙酸加氫制乙醇反應宏觀動力學,并優化了加氫反應條件。
1 實驗部分
1.1 原料
乙酸,分析純,杭州化學試劑有限公司產品;高純H2和高純N2,杭州今工特種氣體有限公司產品;次磷酸鎳(Ni(H2PO2)2·6H2O)和次磷酸鈉(NaH2PO2·H2O),分析純,上海笛柏化學品技術有限公司產品;硝酸,化學純,浙江中星化工試劑有限公司產品;活化硅膠,分析純,青島海洋化工分廠產品。
1.2 催化劑制備
首先,對比表面積350 m2/g、孔體積0.5 mL/g、粒度40~60目的活化硅膠進行預處理。配制30%稀硝酸溶液,在25℃下將活化硅膠浸泡24 h,過濾,水洗,在烘箱中110℃下干燥24 h,然后在馬福爐中以1.5℃/min的速率從100℃升溫到550℃,恒溫焙燒4.0 h,得到催化劑載體。測定載體的飽和吸水率為1.65 mL/g。
以次磷酸鎳作為鎳源和磷源,次磷酸鈉作為補充磷源,在確定Ni占Ni、P和載體總質量分數為7.0%、n(P)/n(Ni)為3的條件下,通過等體積浸漬、N2氣流中熱處理過程,制備Ni2P/SiO2催化劑。具體制備過程為:(1)將4.3350 g的Ni(H2PO2)2·6H2O 溶解于適量的蒸餾水中,再加入1.5588 g的 NaH2PO2·H2O,補加蒸餾水并攪拌,得到16.7 mL的浸漬溶液;(2)對10.1005 g處理過的活化硅膠載體攪拌,滴加浸漬溶液,然后靜置24 h,在烘箱中60℃真空干燥12 h,得到催化劑前驅體;(3)將7.5 g干燥的催化劑前驅體裝入固定床反應器中,在N2流量45 mL/min、反應壓力1.5 MPa 條件下,以2℃/min的速率從25℃加熱至250℃,恒溫保持3 h,得到Ni2P/SiO2催化劑。
1.3 加氫反應實驗
采用固定床反應裝置進行乙酸加氫反應,不銹鋼反應器尺寸為內徑10 mm、外徑14 mm、長100 cm,催化劑裝在反應器中部的恒溫區,反應器兩端填滿惰性石英砂。反應溫度由反應溫度控制儀表控制,由背壓閥調節加氫反應壓力。反應原料乙酸由雙柱塞計量泵注入固定床反應器上端,乙酸與H2的混合物流經催化劑床層,從反應器下端流入儲罐,氣體從儲罐上部流出,經過背壓閥、轉子流量計和濕式氣體流量計,經皂膜流量計測定流量后排空;液體產物儲存在儲罐中,并定時取樣和分析。乙酸的進料量由電子天平稱取,以催化劑前驅體填裝量(7.5 g)為基準計算乙酸質量空速。
1.4 產物分析與數據處理
采用島津GC-2014C氣相色譜儀分析反應產物組成,色譜檢測器為熱導檢測器,色譜柱為2 m×4 mm 的GDX-102填充柱,進樣器溫度為140℃,柱溫為120℃,檢測器溫度為130℃,色譜數據處理方法為校正面積歸一化法。
乙酸加氫反應生成的產物含有乙醇(EtOH)、乙酸乙酯(EtOA)、乙醛(ALDE)、丙酮(ACET),以及未轉化的乙酸(HAc),相對乙酸總有機物的量(B0)為:
(1)
乙酸轉化率(XHAc)為:
(2)
以Yi分別表示乙醇、乙酸乙酯、乙醛、丙酮產率,關系式為:
(3)
式中,Ai為i組分色譜面積分率;Mi為i組分摩爾質量,g/mol;λi為i組分色譜校正因子,其中λHAc=1.0208,λEtOH=1.3158,λEtOA=2.9321,λACET=0.9763,λALDE=1.0000。
2 結果與討論
利用制備的Ni2P/SiO2催化劑,采用固定床反應器進行乙酸加氫反應,單因素考察反應溫度(T)、反應壓力(p)、質量空速(MHSV)、氫/酸摩爾比(nH2/HAc)的影響,將反應實驗結果列于表1。
從表1可以看出,乙酸轉化率、乙醇產率、乙酸乙酯產率均隨著反應溫度升高和反應壓力增大而提高,而隨著質量空速和氫/酸摩爾比增大呈現降低趨勢。這是因為,提高反應溫度和反應壓力會增大加氫反應速率,降低質量空速,使反應流體與催化劑接觸時間延長,強化這些反應條件均導致乙酸轉化率,以及乙醇、乙酸乙酯產率增大。在H2遠遠過剩和其他條件不變的情況下,隨著氫/酸摩爾比增大,反應流體與催化劑接觸時間縮短,致使乙酸轉化率,以及乙醇、乙酸乙酯產率降低。
另外,由表1數據得知,乙醛產率隨著反應壓力增大而提高,丙酮產率隨著反應溫度升高而提高;隨其他反應條件變化,乙醛和丙酮產率的變化趨勢不明顯。
3 加氫反應動力學
3.1 加氫反應動力學模型方程的確定
3.1.1 反應流體相態的確定
乙酸加氫反應流體相態對物料混合程度和傳質速率影響很大。如果反應流體處于氣相,乙酸和H2混合較均勻,傳質速率較大,有利于催化反應。乙酸加氫反應流體中主要含有H2和乙酸,還含有水、乙醇、乙酸乙酯、丙酮及少量的乙醛。利用Antoine蒸氣壓方程計算各組分不同反應溫度的飽和蒸氣壓(pS),結果見圖1。由于乙醛產率較低,且飽和蒸氣壓較大,未計算其飽和蒸氣壓。
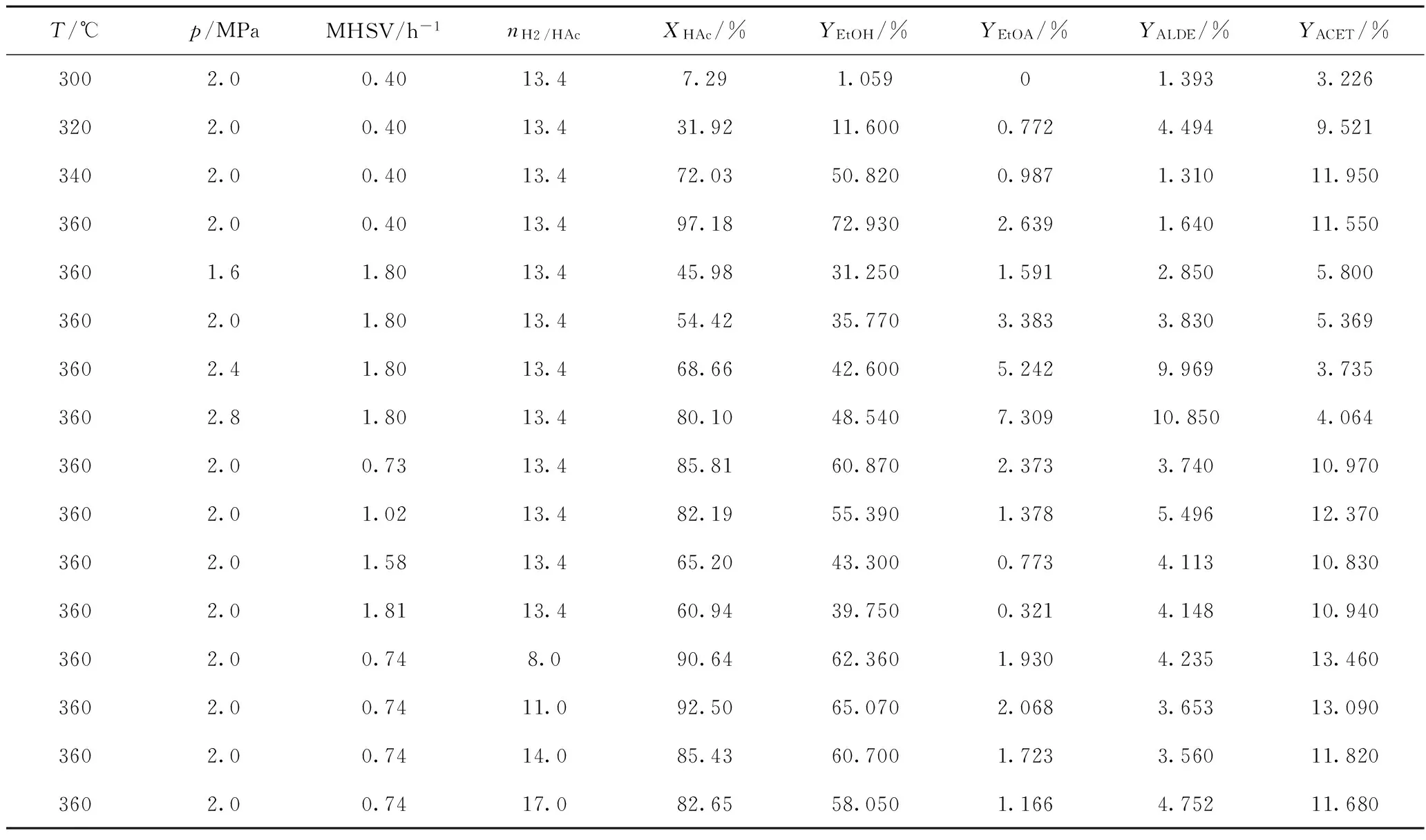
表1 乙酸加氫反應實驗結果Table 1 Experimental results of acetic acid hydrogenation

圖1 各組分飽和蒸氣壓(pS)與反應溫度(T)的關系Fig.1 The relationship between the saturation vapor pressure (pS) and reaction temperature (T) for each component
由圖1得知,反應產物混合物中乙酸的飽和蒸氣壓最低。以乙酸作為模型化合物,如果反應系統氣相乙酸分壓小于乙酸的飽和蒸氣壓,則反應流體處于氣相。在反應實驗中,當反應溫度范圍為300~360℃、反應壓力為1.6~2.8 MPa、氫/酸摩爾比為8~17時,反應系統氣相乙酸分壓明顯小于乙酸的飽和蒸氣壓,催化劑床層中反應流體處于氣相。
3.1.2 反應氣體變化分析
由于加氫反應的氫/酸摩爾比為nH2/HAc,催化劑床層入口處的H2分率為yH20=nH2/HAc/(nH2/HAc+1),入口氣體總摩爾流量與乙酸進料摩爾量之比nD0=nH2/HAc+1,入口H2分率與nD0之比為yH20/nD0=nH2/HAc/(nH2/HAc+1)2。
反應氣體通過催化劑床層,發生系列加氫脫氧反應,氣體H2分率和氣體總摩爾流量均逐漸減小。依據氫/酸摩爾比、乙酸轉化率、各產物產率,確定催化劑床層出口H2分率(yH2)、出口氣體總摩爾流量與乙酸進料摩爾量之比(nD)、出口H2分率與nD之比的關系式,分別表示為:
(4)
nD=1+nH2/HAc-XHAc+YEtOA+YACET+YALDE
(5)
(6)
將表1數據代入式(4),計算催化劑床層出口H2分率,其比床層入口H2分率減小0.5591%~13.1108%,平均減小5.8513%。由式(5)計算出口nD,其比床層入口nD0減小0.1855%~7.8906%,平均減小3.8649%。由式(6)計算床層出口的yH2/nD,其比床層入口yH20/nD0減小0.3743%~5.6675%,平均減小2.0854%。這是因為反應氣體經過催化劑床層,其yH2和nD均減小,致使yH2/nD的減小幅度小于yH2。
在乙酸加氫制乙醇反應動力學研究中,為了簡化數據處理,假設催化劑床層中的yH2/nD不變,取催化劑床層入口yH20/nD0=nH2/HAc/(1+nH2/HAc)2的數值。
3.1.3 反應動力學模型方程推導
將催化劑床層中乙酸摩爾流量與乙酸轉化率的關系表示為式(7)。
vCHAc=v0CHAc0(1-XHAc)
(7)
對催化劑床層高度x處的ΔV床層體積微元進行乙酸物料衡算,將流出與流入微元的乙酸摩爾流量之差表示為:
(8)
關于氣相加氫反應系統,在較高反應溫度條件下,由于組分吸附平衡常數和濃度均較小,忽略組分吸附對反應速率的影響,將反應物和H2濃度對反應速率的影響均表示為1級冪函數形式[29-30]。假設乙酸濃度和H2濃度對乙酸加氫反應的影響均為1級,催化劑床層高度x處的相對高度為x與總高度之比,以Z表示。將式(7)代入式(8),得到式(9)。
(9)
考慮反應氣體為理想氣體,反應器催化劑裝填質量為催化劑床層體積(V)與催化劑堆積密度(ρ)之積,由理想氣體狀態方程計算氣體體積流量,H2濃度CH2=p·yH2/[R×(T+273.15)],乙酸濃度CHAc=v0CHAc0(1-XHAc)/v,對式(9)在Z為0~1范圍內積分,得到乙酸轉化率的反應動力學模型方程式(10)。
(10)
假設乙酸濃度和H2濃度對乙醇生成反應的影響均為1級,經過與上述相似的方法推導,得到乙醇生成速率方程式(11)和乙醇產率的動力學模型方程式(12)。
(11)
(12)
假設乙酸發生平行加氫反應,同理推導出乙酸乙酯、乙醛、丙酮具有相同形式的生成動力學模型方程,統一表示為式(13)。
(13)上述式中,氣體常數R=8.314×10-3L·MPa/(K·mol),MHAc=60.05 g/mol,ρ=690.0 g/L。
依據Arrhenius方程,將反應溫度對反應速率常數影響的關系式表示為:
(14)
其中,T1=360℃,ki1為T1反應溫度下的乙酸加氫或各產物生成速率常數,Ei為乙酸加氫或各產物生成反應表觀活化能。
3.2 動力學參數估值及模型統計檢驗

從表2可以看出,乙醇在反應溫度360℃下的生成速率常數及表觀活化能均明顯大于其他產物,說明在實驗條件范圍內,乙酸加氫反應主要生成乙醇,并且在360℃基礎上進一步升高反應溫度有利于提高乙醇產率。另外,由于乙酸轉化率和乙醇產率的相關系數均較大,說明乙酸加氫反應和乙醇生成反應動力學模型均具有較高的模擬計算精度。表1 數據中從大到小的順序大致為乙酸轉化率、乙醇產率、丙酮產率、乙醛產率、乙酸乙酯產率,該順序與表2中相關系數數值大小順序相同。由此推斷,可能因為乙酸乙酯、乙醛、丙酮的產率均較低,實驗誤差較大,它們的相關系數均不大,模型計算精度偏低。
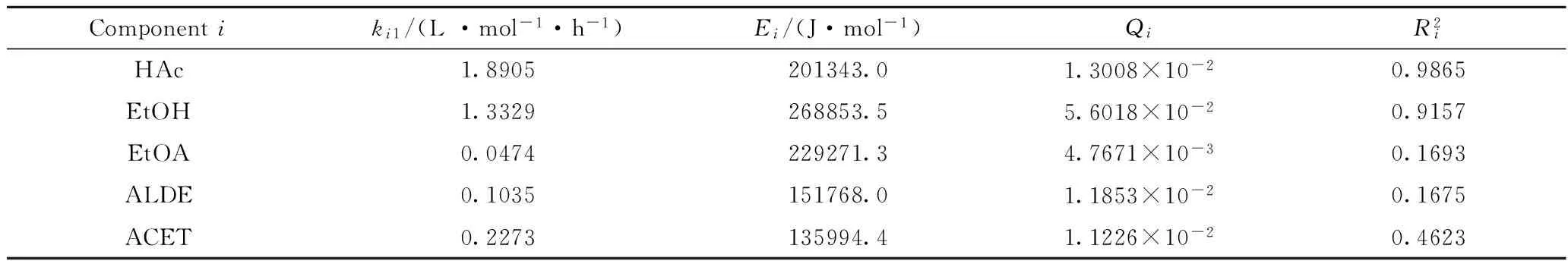
表2 動力學模型參數估值及統計檢驗結果Table 2 Results of paramter estimation and statistic test for kinetic models
3.3 模型預測分析
采用所建動力學模型進行反應條件預測分析,優化反應工藝條件,開展模型應用研究[31-32]。在反應壓力2.5 MPa、氫/酸摩爾比10的反應條件下,將表2中的乙酸加氫速率常數和表觀活化能代入式(14),計算不同反應溫度下的乙酸加氫速率常數,由乙酸加氫動力學模型式(10)預測不同加氫反應溫度、質量空速條件下的乙酸轉化率;利用表2中的乙醇生成速率常數和表觀活化能,由式(12)預測乙醇產率,結果見圖2。由圖2可知,隨著反應溫度升高或質量空速減小,乙酸轉化率和乙醇產率均持續增大。在反應溫度375℃、反應壓力2.5 MPa、質量空速1.0 h-1、氫/酸摩爾比10加氫反應條件下,乙酸轉化率和乙醇產率分別達到99.92%和94.79%。
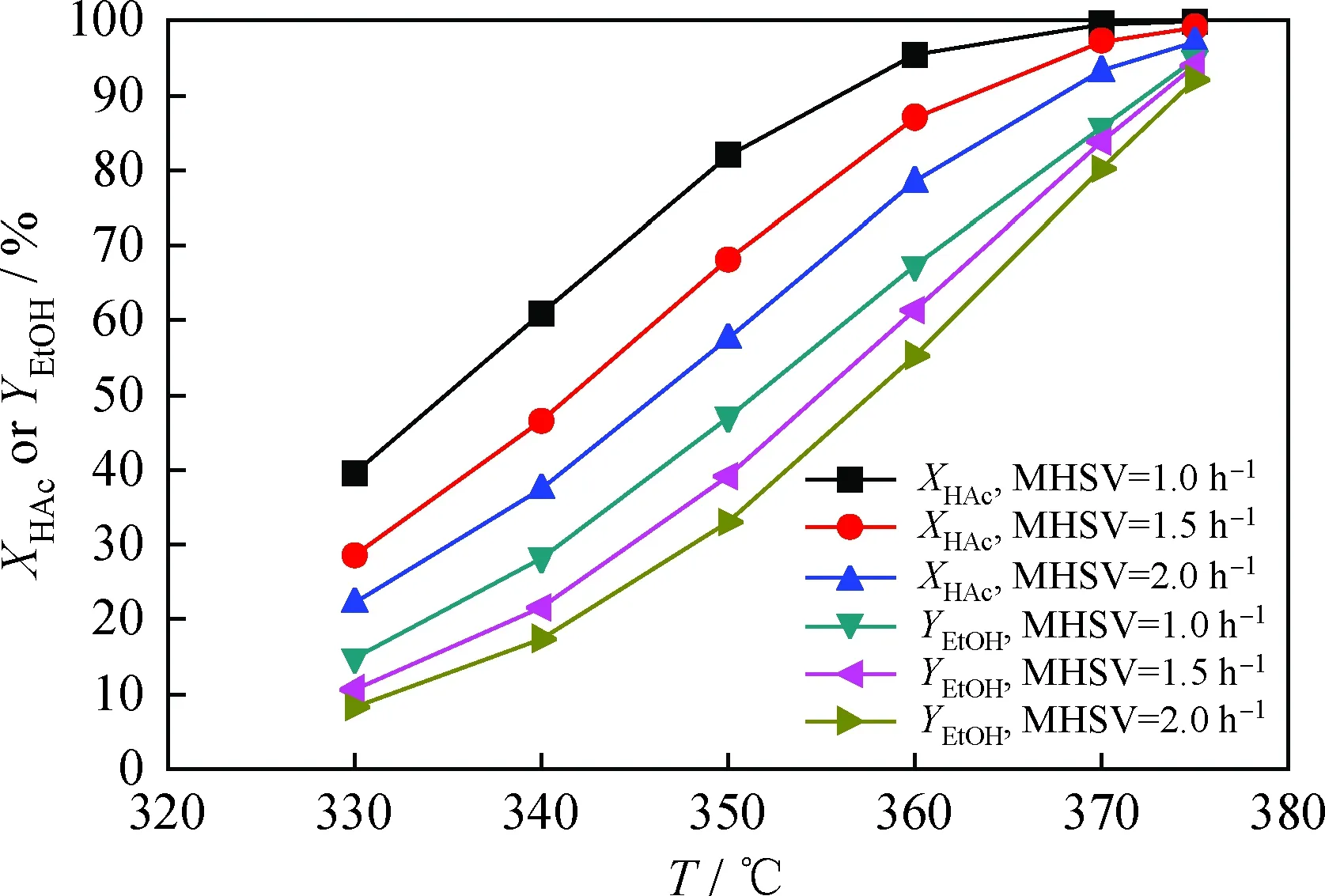
圖2 反應溫度(T)或質量空速(MHSV)對 乙酸轉化率(XHAc)和乙醇產率(YEtOH)的影響Fig.2 Effects of reaction temperature (T) or MHSV on acetic acid conversion (XHAc) and ethanol yield (YEtOH) p=2.5 MPa; nH2/HAc=10
在反應溫度370℃、質量空速1.0 h-1的條件下,由乙酸加氫動力學模型式(10)和乙醇生成動力學模型式(12)預測不同加氫反應壓力、氫/酸摩爾比的乙酸轉化率和乙醇產率,結果見圖3。可見,在H2進料量相對乙酸遠遠過剩情況下,提高反應壓力或減小氫/酸摩爾比均有利于增大乙酸轉化率和乙醇產率。
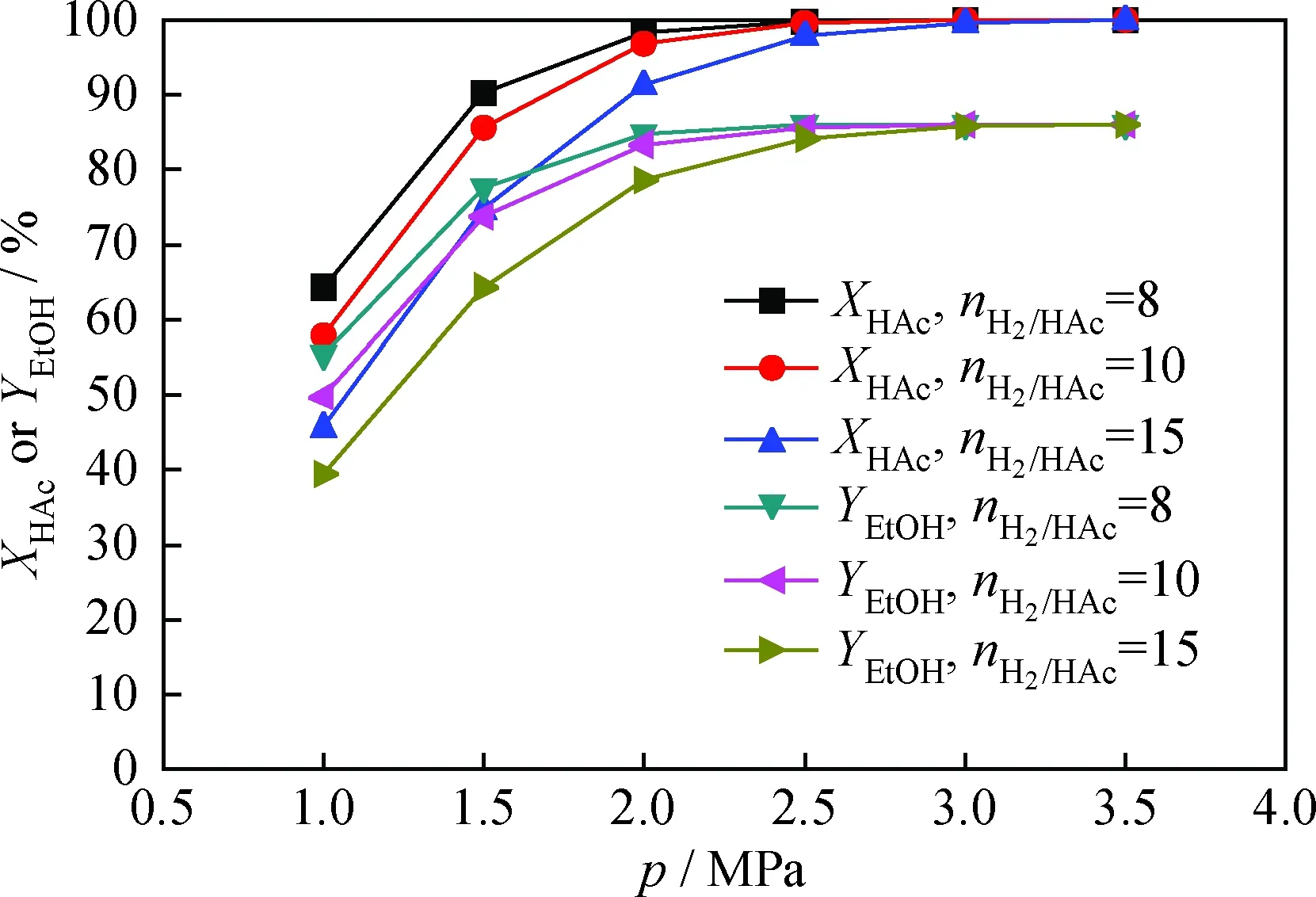
圖3 反應壓力(p)或氫/酸摩爾比(nH2/HAc)對 乙酸轉化率(XHAc)和乙醇產率(YEtOH)的影響Fig.3 Effects of reaction pressure (p) or molar ratio of hydrogen to acid (nH2/HAc) on acetic acid conversion (XHAc) and ethanol yield (YEtOH) T=370℃; MHSV=1.0 h-1
4 結 論
(1)以次磷酸鎳作為磷源和鎳源、次磷酸鈉作為補充磷源,通過等體積浸漬、N2流中250℃熱處理過程,制備了Ni2P/SiO2催化劑。在反應溫度 300~360℃、反應壓力1.6~2.8 MPa、質量空速0.73~1.81 h-1、氫/酸摩爾比8~17反應條件范圍內,采用固定床反應裝置進行乙酸加氫反應。實驗結果顯示,隨著反應溫度升高、反應壓力增大、質量空速及氫/酸摩爾比減小,乙酸轉化率和乙醇產率均逐漸增大。
(2)在確定乙酸加氫反應流體為氣體、分析反應氣體變化的基礎上,經過推導確定了乙酸加氫反應動力學模型方程,以及乙醇及其他產物生成動力學模型方程。利用加氫反應實驗數據確定了各反應的360℃反應速率常數和表觀活化能。統計檢驗結果表明,乙酸加氫反應和乙醇生成反應動力學模型均具有較高的模擬計算精度。
(3)反應動力學模型預測結果表明,隨著反應溫度升高、質量空速減小、反應壓力提高、氫/酸摩爾比減小,乙酸轉化率和乙醇產率均持續增大。在反應溫度375℃、反應壓力2.5 MPa、質量空速1.0 h-1、氫/酸摩爾比10加氫反應條件下,乙酸轉化率和乙醇產率分別達到99.92%和94.79%。
符號說明:
B0——相對乙酸總有機物的量;
CH2——H2摩爾濃度,mol/L;
CHAc——乙酸摩爾濃度,mol/L;
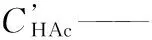
CHAc0——乙酸初始摩爾濃度,mol/L;
Ei——i組分反應表觀活化能,J/mol;
kEtOH——乙醇生成速率常數,L/(mol·h);
kHAc——乙酸反應速率常數,L/(mol·h);
ki——i組分生成速率常數,L/(mol·h);
ki1——360℃的i組分速率常數,L/(mol·h);
MACET——丙酮摩爾質量,g/mol;
MALDE——乙醛摩爾質量,g/mol;
MEtOA——乙酸乙酯摩爾質量,g/mol;
MEtOH——乙醇摩爾質量,g/mol;
MHAc——乙酸摩爾質量,g/mol;
MHSV——質量空速,h-1;
nH2/HAc——氫/酸摩爾比;
p——反應壓力,MPa;
pS——飽和蒸氣壓,MPa;
Qi——轉化率或產率殘差平方和;
R——氣體常數,L·MPa/(mol·K);
-rHAc——乙酸加氫速率,mol/(L·h);
T——反應溫度,℃;
T1——反應溫度,360℃;
v——氣體流量,L/h;
v’——某床層高度流出氣體流量,L/h;
v0——反應器入口氣體流量,L/h;
V——催化劑床層體積,L;
x——催化劑床層高度,dm;
XHAc——乙酸轉化率,%;
yH2——氣體中H2分率;
YACET——丙酮產率,%;
YALDE——乙醛產率,%;
YEtOA——乙酸乙酯產率,%;
YEtOH——乙醇產率,%;
Z——催化劑床層相對高度;
ρ——催化劑堆積密度,g/L。
[1] 李揚, 曾健, 王科, 等. 醋酸酯化合成乙醇工藝及經濟性分析[J].精細化工原料及中間體, 2011, (11): 6-10.(LI Yang, ZENG Jian, WANG Ke, et al. Technology and economic analysis of ethanol synthesis by acetic acid esterification[J].Fine Chemical Raw Materials and Intermediates, 2011, (11): 6-10.)
[2] 劉繼業. 我國醋酸乙酯合成技術進展及市場分析[J].精細與專用化學品, 2010, 18(8): 5-12.(LIU Jiye. Production technologies progress and market analysis of ethyl acetate in China[J].Fine and Specialty Chemicals, 2010, 18(8): 5-12.)
[3] 王科, 陳鵬, 胡玉蓉, 等. 一種用醋酸酯加氫制備乙醇的方法: CN, 102093162A[P].2010-12-13.
[4] JOHNSTON V J, CHEN L Y, KIMMICH B F, et al. Direct and selective production of ethanol from acetic acid utilizing a platinum/tin catalyst: US, 7863489[P].2011-06-04.
[5] 王峰云, 陸大勛. 銅基催化劑上甲酸甲醋的分解和加氫動力學[J].燃料化學學報, 1988, 16(1): 17-23.(WANG Fengyun, LU Daxun. Kinetics of methyl formate decomposition and hydrogenolysis over copper based catalyst[J].Journal of Fuel Chemistry and Technology, 1988, 16(1): 17-23.)
[6] STROUPE J D. An X-ray diffraction study of the copper chromites and of the “copper-chromium oxide” catalyst[J].Journal of the American Chemical Society, 1949, 71(2): 569-572.
[7] YU Jun, MAO Dongsen, HAN Lupeng, et al. CO hydrogenation over Fe-promoted Rh-Mn-Li/SiO2catalyst: The effect of sequences for introducing the Fe promoter[J].Fuel Processing Technology, 2013, 112: 100-105.
[8] ZHAO Huabo, ZHU Qingjun, GAO Yongjun, et al. Iron oxide nanoparticles supported on pyrolytic grapheme oxide as model catalysts for Fischer Tropsch synthesis[J].Applied Catalysis A: General, 2013, 456: 233-239.
[9] ECHEANDIA S, ARIAS P L, BARRIO V L, et al. Synergy effect in the HDO of phenol over Ni-W catalysts supported on active carbon: Effect of tungsten precursors[J].Applied Catalysis B: Environmental, 2010, 101(1-2): 1-12.
[10] HOFFER B W, CREZEE E, DEVRED F, et al. The role of the active phase of Raney-type Ni catalysts in the selective hydrogenation of d-glucose to d-sorbitol[J].Applied Catalysis A: General, 2003, 253(2): 437-452.
[11] 王雪峰, 王鋒, 陳滿英, 等. Ni基雙金屬催化劑加氫脫氧性能的研究[J].燃料化學學報,2005, 33(5): 612-616.(WANG Xuefeng, WANG Feng, CHEN Manying, et al. Studies on nickel-based bimetallic catalysts for hydrodeoxygenation[J].Journal of Fuel Chemistry and Technology, 2005, 33(5): 612-616.)
[12] 呂恩靜, 張懷科, 任杰. 預處理方法對Mo-Ni/γ-Al2O3催化劑加氫脫氧性能的影響[J].石油學報(石油加工), 2012, 28(5): 764-768.(Lü Enjing, ZHANG Huaike, REN Jie. Effect of pretreatment methods of Mo-Ni/γ-Al2O3catalyst on its catalytic performance for hydrodeoxygenation[J].Acta Petrolei Sinica (Petroleum Processing Section), 2012, 28(5): 764-768.)
[13] PRASERTHDAM P, CHOUNGCHAISUKASAM P, ASSABUMRUNGRAT S, et al. Role of Sn and K on hydrogen spillover on Pt/γ-Al2O3catalyst[J].Journal of the Chinese Institute of Chemical Engineers, 2001, 32(2): 143-149.
[14] WU Zili, SUN Fuxia, WU Weicheng, et al. On the surface sites of MoP/SiO2catalyst under sulfiding conditions: IR spectroscopy and catalytic reactivity studies[J].Journal of Catalysis, 2004, 222(1): 41-52.
[15] PHILLIPS D C, SAWHILL S J, SELF R, et al. Synthesis, characterization, and hydrodesulfurization properties of silica-supported molybdenum phosphide catalysts[J].Journal of Catalysis, 2002, 207(2): 266-273.
[16] STINNER C, PRINS R, WEBER T H. Formation, structure, and HDN activity of unsupported molybdenum phosphide[J].Journal of Catalysis, 2000, 191(2): 438-444.
[17] WHIFFEN V M L, SMITH K J. Hydrodeoxygenation of 4-Methyphenol over unsupported MoP, MoS2, and MoOxcatalysts[J].Energy & Fuels, 2010, 24(9): 4728-4737.
[18] ZHAO H Y, LI D, BUI P, et al. Hydrodeoxygenation of guaiacol as model compound for pyrolysis oil on transition metal phosphide hydroprocessing catalysts[J].Applied Catalysis A: General, 2011, 391(1-2): 305-310.
[19] WANG X Q, CLARK P, OYAMA S T. Synthesis, characterization, and hydrotreating activity of several iron group transition metal phosphides[J].Journal of Catalysis, 2002, 208(2): 321-331.
[20] OYAMA S T, WANG X, LEE Y K, et al. Effect of phosphorus content in nickel phosphide catalysts studied by XAFS and other techniques[J].Journal of Catalysis, 2002, 210(1): 207-217.
[21] DUAN Xinping, TENG Yang, WANG Anjie, et al. Role of sulfur in hydrotreating catalysis over nickel phosphide[J].Journal of Catalysis, 2009, 261(2): 232-240.
[22] LIU Dapeng, WANG Anjie, LIU Chenguang, et al. Bulk and Al2O3-supported Ni2P HDS catalysts prepared by separating the nickel and hypophosphite sources[J].Catalysis Communications, 2016, 77: 13-17.
[23] 宋華, 王紫東, 宋華林, 等. Ni2P/Ti-MCM-41的催化加氫脫硫性能[J].石油學報(石油加工), 2015, 31(6): 1275-1280.(SONG Hua, WANG Zidong, SONG Hualin, et al. Hydrodesulfurization performance of Ni2P/Ti-MCM-41 catalyst[J].Acta Petrolei Sinica (Petroleum Processing Section), 2015, 31(6): 1275-1280.)
[24] 王海彥, 齊振東, 鄢景森, 等. Ti摻雜對Ni2P/SBA-15催化劑加氫脫氮催化性能的影響[J].石油學報(石油加工), 2015, 31(6): 1281-1287.(WANG Haiyan, QI Zhendong, YAN Jingsen, et al. The effect of Ti doping in Ni2P/SBA-15 catalyst on its catalytic hydrodenitrogenation performance[J].Acta Petrolei Sinica (Petroleum Processing Section), 2015, 31(6): 1281-1287.)
[25] SHI Guojun, SHEN Jianyi. Mesoporous carbon supported nickel phosphide catalysts prepared by solid phase reaction[J].Catalysis Communications, 2009, 10(13): 1693-1696.
[26] SHI Guojun, SHEN Jianyi. New synthesis method for nickel phosphide nanoparticles: Solid phase reaction of nickel cations with hypophosphites [J].Journal of Materials Chemistry, 2009, 19(16): 2295-2297.
[27] 李景鋒, 李學輝, 柴永明, 等. 磷化鎳的制備、表征及其催化性能研究進展[J].化工進展, 2013, 32(11): 2621-2630.(LI Jingfeng, LI Xuehui, CHAI Yongming, et al. Progress in the fabrication, characterization and catalytic reactivity of nickel phosphide[J].Chemical Industry and Engineering Progress, 2013, 32(11): 2621-2630.)
[28] GUAN Qingxin, LI Wei, ZHANG Minghui, et al. Alternative synthesis of bulk and supported nickel phosphides from the thermal decomposition of hypophosphites[J].Journal of Catalysis, 2009, 263(1): 1-3.
[29] NEGAHDAR L, ALSHAAL M G, HOLZHAUSER F J, et al. Kinetic analysis of the catalytic hydrogenation of alkyl levulinates toγ-valerolactone[J].Chemical Engineering Science, 2017, 158: 545-551.
[30] PIRARD S L, HEINRICHS B, HEYEN G, et al. Optimization of experimental procedure and statistical data treatment for kinetics of ethylene hydrogenation on a copper-magnesia catalyst [J].Chemical Engineering Journal, 2008, 138(1-3): 367-378.
[31] TOHIDIAN T, DEHGHANI O, RAHIMPOUR M R. Modeling and simulation of an industrial three phase trickle bed reactor responsible for the hydrogenation of 1,3-butadiene: A case study[J].Chemical Engineering Journal, 2015, 275: 391-404.
[32] ABOGHANDER N S, LOGIST F, GRACE J R, et al. Heterogeneous modeling of an autothermal membrane reactor coupling dehydrogenation of ethylbenzene to styrene with hydrogenation of nitrobenzene to aniline: Fickian diffusion model[J].Chemical Engineering and Processing, 2014, 77: 50-65.

