電針夾脊穴對兔退變腰椎間盤Actin、Tubulin表達的影響
李妍玲,鄒璟,黃國付,3
椎間盤退變(intervertebral disc degeneration,IVDD)是一個多因素導致的病理過程,是椎間盤突出、椎管狹窄、脊柱失穩(wěn)等脊柱退行性疾病的共同病理基礎。有研究表明,非生理的生物力學環(huán)境及其導致的細胞外基質(zhì)代謝變化是椎間盤退變的始動因素[1],而細胞骨架可能作為機械信號傳導通路的重要組成部分參與了胞外基質(zhì)代謝的調(diào)節(jié)[2]。目前針灸在臨床治療腰椎間盤退行性疾病中備受青睞,前期研究已證明,電針對腰椎間盤退行性疾病有較好的療效[3],但其具體機制尚未完全明確。因此,本實驗從actin、微管蛋白的角度研究電針對退變椎間盤細胞中細胞骨架蛋白的影響,探討電針防治腰椎間盤退變性疾病的作用機制。
1 材料與方法
1.1 材料 健康成年雄性新西蘭大白兔40只,月齡5~6個月,體質(zhì)量3.0~4.0kg,由武漢大學實驗動物中心提供(動物質(zhì)量合格證編號:42000500005471),適應性飼養(yǎng)3周后開始實驗。
1.2 主要儀器和試劑 軸向加壓造模器(十堰東汽);電鉆(型號JIZ-SH09-10C 6910JER,上海銳奇);Signa HD×3.0T 磁共振器(美國通用);多功能實驗兔固定器(北京創(chuàng)博環(huán)球);針灸針(φ0.30×25mm,華佗牌);HANS穴位神經(jīng)刺激儀(南京濟生);TS-1水平搖床(江蘇海門其林貝爾);DYCZ-40電轉(zhuǎn)儀、DYCZ-24DN垂直電泳槽、DYY-7C電泳儀電源(北京六一);丙烯酰胺(Amresco);PMSF、RIPA裂解液、BCA蛋白濃度測定試劑(碧云天);PVDF膜(Millipore);GAPDH抗體(abcam);一抗(NBP1-41294、NB600-506,novus);HRP標記羊抗兔二抗、HRP標記羊抗小鼠二抗(novus);ECL底物液(Thermo)。
1.2 方法 ①分組與造模:采用隨機數(shù)字表法將40只新西蘭大白兔分為正常組、模型組、假模型組、電針組4組,每組各10只。模型組與電針組參考Kroeber M等[4]及黃國付等[5]造模方法建立兔腰椎間盤退變模型。10%水合氯醛(1ml/kg)耳緣靜脈注射麻醉后將新西蘭大白兔俯臥位固定;備皮后于L4、L5椎體的椎旁兩側(cè)約2cm處做長約1cm的垂直切口,鈍性分離各層組織,顯露椎體;直徑1.5mm的克氏針沿切口處鉆入至針尖輕抵骨面,探尋相應椎體近尾端厚實處作為穿刺點,用電鉆將克氏針水平鉆入椎體內(nèi)并從對側(cè)皮膚穿出,過程中保持針身與脊柱垂直;縫合切口處皮膚,在每根克氏針兩端等距處安裝軸向加壓造模器(圖1),施加200N的壓力持續(xù)28d(圖2);最后肌肉注射青霉素鈉4×106U,1次/d,連續(xù)治療5d。術(shù)后28d拆除加壓裝置、拔除克氏針,4組實驗兔每組各取5只進行MRI檢查以評價造模是否成功。②動物干預:正常組:自然飼養(yǎng),不作其他處理和治療;模型組、假模型組:不作任何治療;假模型組造模方式同模型組,但不安裝軸向加壓造模器,不進行椎體間加壓;電針組:造模成功后第1天開始電針治療。參照《實驗針灸學》[6]取L4、L5雙側(cè)夾脊穴,1寸針灸針(φ0.30×25mm,華佗牌)直刺5~8mm后接以韓氏穴位神經(jīng)刺激儀(同側(cè)夾脊穴接通同一對電極),調(diào)頻波2/15Hz,刺激強度1~2mA,持續(xù)時間為20min/次(圖3),1次/d,連續(xù)治療6d為1個療程,療程間隔1d,共治療4個療程。

圖1僅安裝軸向加造模器,未施壓圖2椎體間加壓圖3電針治療
1.3 評定標準 每組分別在達到造模周期后第1天和第28天各取5只,拆除加壓裝置并拔除克氏針,用10%水合氯醛(1ml/kg)耳緣靜脈注射麻醉后行L4~5椎間盤MRI平掃,之后處死并取出所需節(jié)段椎間盤組織,置于-70℃冰箱中保存供Western blot檢測。Western Blot檢測MAPs和Actin的表達:按照實驗試劑說明書,將所取椎間盤組織洗滌、裂解、離心后收集蛋白樣品勻漿,BCA試劑測定蛋白樣品的蛋白濃度;按照蛋白分子量配置10%PAGE凝膠,待目的蛋白充分分離即停止電泳,裁取目的凝膠后轉(zhuǎn)膜;將PVDF膜置于含5%脫脂奶粉的TBST中室溫下?lián)u床封閉2h;再將PVDF膜浸于封閉液稀釋(1∶1000)的一抗溶液中,4℃搖床孵化過夜,TBST充分洗滌5~6次;二抗經(jīng)封閉液稀釋(1∶10000)后浸泡PVDF膜,室溫下?lián)u床孵化2h后充分洗滌;再將ECL顯影液均勻滴在PVDF膜蛋白面,暗室X光片顯影;應用Band-Scan凝膠圖像處理系統(tǒng)分析tubulin和actin平均吸光度。
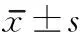
2 結(jié)果
2.1 磁共振影像檢測椎間盤信號變化 術(shù)后第28天各組實驗兔拆除加壓裝置并拔除克氏針,使用Signa HD×3.0T 磁共振器攝L4~5椎間盤T2加權(quán)(矢狀位)像。結(jié)果顯示:正常組與假模型組實驗兔椎間盤各節(jié)段表現(xiàn)為均勻明亮的高信號,各椎間盤信號強度無明顯差異;模型組與電針組L4~5椎間盤信號強度明顯低于上下相鄰椎間盤,表現(xiàn)為黑色低信號,與正常椎間盤差異明顯,表明成功建立椎間盤退變模型。見圖4。
2.2 各組術(shù)后actin,tubulin蛋白表達量比較 正常組與假模型組術(shù)后不同時間點actin,tubulin表達差異均無統(tǒng)計學意義;模型組術(shù)后第28天actin,tubulin表達與該組術(shù)后第56天相比差異無統(tǒng)計學意義;模型組及電針組術(shù)后第28天actin,tubulin表達與正常組及假模型組術(shù)后第28天相比均有明顯下降(均P<0.05);電針組經(jīng)治療56d后actin、tubulin表達與該組術(shù)后第28d及模型組術(shù)后第56天相比均有明顯升高(均P<0.05)。見表1,圖5,6。


圖4 術(shù)后第28天各組實驗兔椎間盤MRI比較
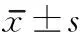

組別nactin術(shù)后第28天術(shù)后第56天微管蛋白術(shù)后第28天術(shù)后第56天正常組51111假模型組50.958±0.0850.951±0.0580.998±0.0591.029±0.087模型組50.539±0.057a0.520±0.105a0.801±0.065a0.863±0.037a電針組50.530±0.155a1.087±0.142bc0.787±0.022a1.298±0.190bc
與正常組及假模型組術(shù)后同時間點比較,aP<0.05;與電針組術(shù)后第28天比較,bP<0.05;與模型組術(shù)后第56天比較,cP<0.05

圖5治療28及56d后4組兔腰椎間盤細胞中actin相對表達量western檢測比較

圖6治療28及56d后4組兔腰椎間盤細胞中tubulin相對表達量western檢測比較
3 討論
椎間盤的解剖結(jié)構(gòu)是由纖維環(huán)、髓核和軟骨終板組成。在正常情況下,椎間盤可分散和緩沖脊柱壓力負荷,但髓核和纖維環(huán)細胞所承載的應力不完全相同。非生理條件下的機械負荷可能影響髓核和纖維環(huán)細胞的合成和分解代謝,進而引起胞外基質(zhì)的成分變化。椎間盤細胞外基質(zhì)具有復雜的生物力學性能,其構(gòu)成的變化可進一步影響椎間盤的力學分布,最終影響椎間盤的形態(tài)和結(jié)構(gòu)。因此,非正常機械應力是引起椎間盤退變的最重要原因之一。然而,椎間盤細胞將外界機械力信號轉(zhuǎn)化為生物化學信號從而引起胞外基質(zhì)成分改變的機制仍不十分清楚。有研究提出,細胞骨架可能在這一信號傳導過程中起到重要作用[7]。
細胞骨架蛋白是指細胞質(zhì)中由蛋白絲組成的非膜相結(jié)構(gòu)系統(tǒng)的蛋白質(zhì),椎間盤細胞中的細胞骨架蛋白有actin、tubulin和波形蛋白(vimentin)等。力學信號在細胞內(nèi)部深層的傳導主要通過細胞骨架蛋白實現(xiàn),機械力刺激作用于椎間盤細胞時,細胞外基質(zhì)結(jié)合細胞骨架,介導細胞內(nèi)蛋白構(gòu)象的改變。actin是細胞運動、維持形態(tài)、跨膜轉(zhuǎn)運及信號轉(zhuǎn)導等的基礎。張德宏等[1]發(fā)現(xiàn),大鼠纖維環(huán)細胞actin骨架在靜態(tài)培養(yǎng)時呈現(xiàn)明顯的應力纖維,而不同幅度和時間的牽拉可影響actin骨架的聚合和解聚,提示細胞骨架組成的結(jié)構(gòu)變異對椎間盤細胞的力學功能起到重要作用。于勝吉等[8]發(fā)現(xiàn),椎間盤細胞受到直接外力作用后,actin收縮且表達相應降低,細胞體積縮小,形態(tài)發(fā)生改變。研究表明,椎間盤細胞受到機械應力時可通過激活Ca2+通道導致細胞內(nèi)Ca2+瞬間變化,從而引起actin的重塑,有利于滲透性應力下細胞體積的重塑[9]。微管蛋白主要參與細胞內(nèi)物質(zhì)轉(zhuǎn)運、維持細胞形態(tài)及細胞器定位等功能活動。椎間盤細胞中微管蛋白的表達和分布隨年齡的增長出現(xiàn)明顯變化,導致其對機械應力的反應發(fā)生改變,進而影響胞外基質(zhì)的代謝。Li等[2,10]研究證實,體外培養(yǎng)的椎間盤細胞在牽張力作用下出現(xiàn)結(jié)構(gòu)和表達的明顯改變,當軟骨細胞中微管蛋白的表達受到干擾時可抑制壓力誘導的蛋白聚糖的合成和分泌。綜上所述,生理狀況下,細胞骨架蛋白將作用于椎間盤細胞的機械力刺激轉(zhuǎn)化生物化學信號,維持胞外基質(zhì)的正常代謝平衡;而異常的機械應力可引起細胞骨架蛋白結(jié)構(gòu)及表達發(fā)生改變,力學信號轉(zhuǎn)導通路異常,進而影響椎間盤細胞外基質(zhì)的合成和分解代謝,導致椎間盤的退變。
本實驗參考Kroeber等[4]通過壓力裝置誘發(fā)椎間盤退變的造模方法,在相鄰兩椎體間進行軸向加壓,通過過度的機械刺激作用于椎間盤細胞引起細胞骨架蛋白的表達變化,從而建立椎間盤退變模型。實驗結(jié)果顯示,模型組術(shù)后第28天、第56天及電針組術(shù)后第28天actin、tubulin表達較正常組及假模型組術(shù)后第28天、第56天相比均明顯下降,說明軸向加壓可誘導椎間盤退變的發(fā)生,退變的椎間盤細胞中actin、tubulin表達下調(diào);而電針組經(jīng)電針治療28d后actin、tubulin表達明顯升高,說明電針可有效上調(diào)退變椎間盤細胞中actin、tubulin的表達。前期研究表明,電針夾脊穴可通過降低椎間盤組織中基質(zhì)金屬蛋白酶13、增強基質(zhì)金屬蛋白酶組織抑制因子1,糾正基質(zhì)降解和合成代謝之間的失衡,從而延緩椎間盤退變[11]。因此,我們認為電針可通過上調(diào)退變椎間盤細胞中actin、tubulin的表達,促進退變椎間盤細胞骨架恢復,從而調(diào)節(jié)椎間盤細胞外基質(zhì)的合成和分解代謝,達到延緩椎間盤退變的作用。有研究認為,胞外刺激如應力刺激等,可通過磷酸化tubulin、actin等增加水通道蛋白(aquaporin,AQPs)mRNA的轉(zhuǎn)錄和蛋白合成,從而改變微管、微絲等細胞骨架對AQPs的轉(zhuǎn)運[12-14]。課題組前期研究已證實[15],退變椎間盤組織中AQP1、3表達降低,而電針可有效上調(diào)模型兔退變椎間盤組織中AQP1、3的表達。基于此我們推測,電針可通過上調(diào)退變椎間盤細胞中actin、tubulin的表達,進而上調(diào)終板軟骨細胞AQP1、3表達,從而延緩椎間盤退變。本研究為闡明電針治療腰椎間盤退行性疾病的可能機制提供了一定的實驗依據(jù),為臨床應用電針治療腰椎間盤退行性疾病提供了理論依據(jù),但細胞骨架蛋白與AQPs之間的關系仍待進一步研究。
[1] 張德宏, 方鵬飛, 王興盛,等. 周期性牽張椎間盤纖維環(huán)細胞肌動蛋白骨架的重排[J]. 中國組織工程研究[J], 2016, 20(7): 972-980.
[2] 薛榮亮, 李思遠. 細胞骨架與機械信號傳導:椎間盤突出機制研究的新靶點[J]. 中國疼痛醫(yī)學雜志, 2016, 22(5): 326-328.
[3] 黃國付, 張紅星, 張?zhí)品? 夾脊平衡電針治療腰椎間盤突出癥的臨床研究[J]. 中國康復醫(yī)學雜志, 2008, 23(3): 236-237.
[4] Kroeber M, Unglaub F, Guegring T, et al. Effects of controlled dynamic disc distraction on degenerated intervertebral discs: an in vivo study on the rabbit lumbar spine model[J]. Spine, 2005, 30(2): 181-187.
[5] 黃國付, 汪伯毅, 鄒璟,等. 夾脊電針對兔退變腰椎間盤組織中decorin蛋白表達的影響[J]. 中國康復, 2015, 30(5): 323-327.
[6] 郭義. 實驗針灸學[M]. 北京: 中國中醫(yī)藥出版社, 2008: 402-417.
[7] Li S, Duance VC, Blain EJ. Zonal variations in cytoskeletal element organization, mRNA and protein expression in the intervertebral disc[J]. J Anat, 2008, 213(6): 725-732.
[8] 于勝吉,邱貴興,Yang BL.周期性壓力下椎間盤細胞中肌動蛋白的變化及其意義[J].中華骨科雜志[J],2005,25(9):560-564.
[9] Irving M, Shapiro Makarand V, Risbud. 椎間盤[M].北京: 北京大學醫(yī)學出版社,2016: 106-107.
[10] Li S, Jia X, Duance VC, et al .The effects of cyclic tensile strain on the organisation and expression of cytoskeletal elements in bovine intervertebral disc cells: an in vitro study[J]. Eur Cell Mater, 2011, 21: 508-522.
[11] 鄒璟,黃國付,張琦,等."夾脊"電針對兔退變腰椎間盤組織中基質(zhì)金屬蛋白酶13和基質(zhì)金屬蛋白酶組織抑制因子1表達的影響[J].針刺研究,2014,39(3):192-197.
[12] Kumari SS, Varadaraj M, Yerramilli VS, et al. Spatial expression of aquaporin 5 in mammalian cornea and lens, and regulation of its localization by phosphokinase A[J]. Molecular Vision, 2012, 18: 957-967.
[13] Gonzalez GA, Montminy MR. Cyclic AMP stimulates somatostatin gene transcription by phosphorylation of CREB at serine133[J]. Cell, 1989, 59(4): 675-680.
[14] Venkataramana K. Sidhaye, Eric Chau, Vasudha Srivastava, et al. A Novel Role for Aquaporin-5 in Enhancing Microtubule Organization and Stability[J]. PLoS ONE, 2012, 7(6): 1-9.
[15] 李解. LDH臨床癥狀與MRI相關性研究及電針對模型兔退變腰椎間盤軟骨終板AQP1、3表達的影響[D].武漢: 湖北省中醫(yī)藥大學, 2016.

