雪蓮細胞培養物活血化瘀及抗炎作用研究?
王彥禮,劉雅萍,高俊鵬,王敦方,徐航宇,馬旭冉,楊偉鵬△
(1. 中國中醫科學院中藥研究所,北京 100700; 2. 大連普瑞康生物技術有限公司,大連 116001; 3. 神威藥業集團有限公司,石家莊 051430)
天山雪蓮(saussurea involucrate (kar.et Kir) Sch.Bip) 是我國珍稀的名貴藥材,具有活血通經、散寒除濕、強筋助陽等功效,在民族地區常用來治療風濕、婦女痛經、月經不調等疾病[1]。由于天山雪蓮生長環境特異,生長緩慢,人工栽培困難,加之過度采挖致使雪蓮資源匱乏,而采用植物細胞工程技術對雪蓮進行細胞培養,能生產出質量穩定、藥效成分高的雪蓮細胞培養物,并可大規模工業化生產,此技術可有效解決雪蓮藥材短缺的問題[2]。本研究觀察雪蓮細胞培養物對急性血瘀模型大鼠的活血化瘀作用及抗子宮內膜異物炎癥的作用,為臨床應用雪蓮細胞培養物治療婦科疾病提供實驗方面支持。
1 材料與方法
1.1 動物
SPF級Wistar大鼠,體質量180~200 g,由中國人民解放軍軍事醫學科學院實驗動物中心提供(合格證號SCXK-(軍)2012-0004)。
1.2 藥物
雪蓮細胞培養物(20166,批號H130401),大連普瑞康生物技術有限公司;阿司匹林(sigma,批號20120928001);鹽酸腎上腺素注射液,天津金耀氨基酸有限公司(批號1307051);ADP血小板聚集功能檢測試劑盒,山東泰利信醫療科技有限公司(批號20160927B);纖維蛋白原FIB含量測定試劑盒,上海太陽生物技術有限公司(批號132090)。
1.3 儀器
LBY-N6K自動血液流變儀、LBY-NW1毛細管黏度計、C2000-4血凝儀、LBY-NJ4血小板聚集儀,北京普利生儀器有限公司;KH-120 M毛細管離心機,日本產;KUBOTA紅細胞壓積讀數板、TGL-16型臺式離心機,上海安亭科學儀器廠;SN-695型智能放免γ測量儀,上海原子核研究所日環儀器一廠生產。
1.4 分組及造模
1.4.1 取雄性大鼠60只,按體質量隨機分出10只作為空白對照組,其余50只大鼠分為血瘀模型組、雪蓮細胞培養物高、中、低3個劑量組和陽性藥阿司匹林組。雪蓮細胞培養物按照140、70、35 mg/kg 3個劑量(相當于人用劑量3.33 mg/kg/d的40、20、10倍),陽性藥阿斯匹林按照100 mg/kg灌胃給藥,空白對照組和模型組給予同體積溶劑,每日1次,持續7 d。于第7天皮下注射腎上腺素1 mg/kg共2次,間隔4 h,在2次注射之間,將大鼠浸入冰水內5 min處置后禁食,次日取血進行血液流變學檢測[3]。
1.4.2 取雌性大鼠60只,用1.6%戊巴比妥鈉麻醉,剪去下腹部毛酒精消毒,于下腹正中切口2 cm,暴露子宮,沿左側子宮角上1 cm處作一橫切口,將消毒后的塑料管(2 mg)放置子宮內縫合固定,滴入青霉素以防感染[4]。次日,將手術后的大鼠按體質量隨機分為模型組、陽性藥阿司匹林組、雪蓮細胞培養物高、中、低劑量組共5組。雪蓮培養物按照140、70、35 mg/kg 3個劑量(相當于人用劑量3.33 mg/kg/d的40、20、10倍),陽性藥阿斯匹林按照100 mg/kg灌胃給藥,模型組給予同體積溶劑,每日1次,連續7 d。
1.5 檢測指標
1.5.1 將1.4.1的禁食大鼠20%烏拉坦腹腔麻醉,腹主動脈采血5 ml,按9∶1的比例將全血與3.8%的枸櫞酸鈉溶液混勻抗凝,取6 ml抗凝血用于血小板、全血黏度和紅細胞壓積的測定,余3 ml 3000 r/min離心15 min以分離血漿,用于血漿黏度和血漿纖維蛋白原含量的測定。將旋轉式黏度計設定剪切率為10、200 s-1,檢測溫度37 ℃,加入710 μL抗凝全血,觀察并記錄其不同切變率下的全血黏度;紅細胞壓積的測定用微量血細胞比積法:取∮1.5×75 mm的毛細管吸取0.2 ml抗凝血,一端封閉,12000 r/min離心5 min,用刻度板讀數,讀數/0.9以去除抗凝劑的影響;血漿纖維蛋白原(Clauss法)按試劑盒說明書在血凝儀上進行測定。
1.5.2 將1.4.2的大鼠末次給藥1 h后取血分離血清,放免法檢測腫瘤壞死因子TNF-α,處死動物摘取致炎側和非致炎側子宮,稱重并計算腫脹率和抑制率。
1.6 統計學方法
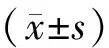
2 結果
2.1 雪蓮細胞培養物對急性血瘀模型大鼠的活血化瘀作用
表1顯示,模型組與對照組比較紅細胞壓積無明顯變化,血漿纖維蛋白原含量、血小板聚集率、血漿黏度、全血黏度均顯著升高,差異有統計學意義(P<0.01或P<0.05),說明急性血瘀模型造模成功。雪蓮細胞培養物低劑量組可明顯降低血漿纖維蛋白原含量,與模型組比較差異有統計學意義(P<0.05);雪蓮細胞培養物高、中、低劑量組可明顯降低全血黏度10、全血黏度200,與模型組比較差異有統計學意義(P<0.01),對于紅細胞壓積、血小板聚集率以及血漿黏度無明顯影響。
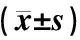
表1 雪蓮細胞培養物對急性血瘀模型大鼠血液流變學的影響
注:與對照組比較:*P<0.05,**P<0.01;與模型組比較:#P<0.05,##P<0.01
2.2 雪蓮細胞培養物對大鼠子宮內膜異物炎癥的作用
表2顯示,雪蓮細胞培養物高、中、低劑量組均可以降低致炎子宮的腫脹率,體現出一定的量效關系,其中高、中劑量組與模型組比較差異有統計學意義(P<0.01或P<0.05);雪蓮細胞培養物高、中、低劑量組均可明顯降低血清中TNF-α含量,與模型組比較差異有統計學意義(P<0.01)。
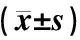
表2 雪蓮細胞培養物對子宮異物炎癥及TNF-α的影響
注:與模型組比較:#P<0.05,##P<0.01
3 討論
天山雪蓮在民族地區常用來治療婦科疾病,如痛經、月經不調等。雪蓮細胞培養物具有與野生雪蓮相近的抗炎、鎮痛、免疫抑制等作用[5-6],且黃酮等有效成分含量高于野生雪蓮[7]。目前,雪蓮細胞培養物已被批準為新資源食品,多種保健功能已得到證實[8-9],但目前針對雪蓮治療婦科疾病的實驗研究尚少。
中醫理論認為“大怒致瘀”“外寒也可致瘀”。本研究采用給予大鼠皮下注射大劑量腎上腺素模擬暴怒時的機體狀態,并以冰水浸泡模擬寒邪入侵,在兩種因素綜合作用下復制大鼠急性血瘀證模型。腎上腺素為α和β受體激動劑,具有收縮外周血管和增加心肌收縮力的作用,使心臟負荷增加,心肌耗氧代謝增加,心功能下降,從而使血液運行障礙,血液黏度增加,加之液體的黏度在溫度降低時升高,再給動物施以冰水冷浴。二者的綜合作用使得模型組除紅細胞壓積指標沒有明顯變化外,其余各項血液流變學指標均較正常組顯著升高,復制出血液流變性呈“黏、濃、凝、集”的血瘀狀態。
血液流變學的主要指標是全血黏度、血漿黏度以及紅細胞聚集指數等,其水平的增高是導致血液高黏滯及血栓形成的重要原因;全血黏度增高是血液黏滯度增高的根本,主要與紅細胞聚集增強有關,而低切變率下的全血黏度在一定程度上反映紅細胞聚集能力;血漿黏度增高是導致血液黏度增高的原因之一,與血漿無形成分的改變有關[10]。
本文采用冰水浴和注射腎上腺素結合的方法造成大鼠血瘀模型。本研究結果顯示,雪蓮細胞培養物可以明顯降低急性血瘀模型大鼠的全血黏度,對血漿纖維蛋白原也有一定的降低作用,說明雪蓮細胞培養物具有一定的活血化瘀作用。
腫瘤壞死因子(TNF-α)是一種具有多種生物學活性的細胞因子。正常水平的 TNF-α可以參與抵抗細菌、病毒和寄生蟲的感染, 促進組織修復,引起腫瘤細胞凋亡等,但TNF-α在體內的大量產生和釋放則會破壞機體的免疫平衡,與其他炎癥因子共同產生多種病理損傷, 如類風濕關節炎、多發性硬化癥、炎癥性腸病等多種疾病[11]。子宮內膜異物可導致子宮內膜炎癥的發生,使致炎子宮出現不同程度的腫脹。雪蓮細胞培養物可以降低致炎子宮的腫脹程度,并可以明顯降低致炎大鼠血清中炎癥介質TNF-α的含量,說明雪蓮細胞培養物對于子宮內膜異物引起的炎癥具有一定的抑制作用。
綜上,雪蓮細胞培養物具有一定的活血化瘀和抗婦科炎癥的作用。本結果對于雪蓮細胞培養物應用于婦科疾病的治療提供了一定的理論基礎和實驗依據。
[1] 國家中醫藥管理局《中華本草》編委會.中華本草[M].上海:上海科學技術出版社,1999: 7927-7929.
[2] 胡顯文,高麗華,趙德修.用于大規模植物細胞培養的穩定高產黃酮的雪蓮細胞系及其建立方法[M].中國專利,CN1424395A,2003.
[3] 陳奇.中藥藥理實驗方法學[M].北京:人民衛生出版社,1993:564.
[4] 劉玉玲,梁資富,呂燕萍,等.女士康寶藥理實驗研究[J].中藥新藥與臨床藥理,1996,7(4):42-43.
[5] 楊偉鵬,王怡薇,王彥禮,等. 培養雪蓮總黃酮對巨噬細胞炎性介質一氧化氮和前列腺素 E2 的影響[J]. 中國實驗方劑學雜志,2010,16(18):157-159.
[6] 楊偉鵬,林娜,劉春芳,等. 水母雪蓮總黃酮和水母雪蓮細胞培養物總黃酮對致炎大鼠血清中炎性因子的影響[J]. 中國實驗方劑學雜志,2005,11(6):41-43.
[7] 高麗華,胡顯文. 分光光度法測定水母雪蓮細胞培養物中的總黃酮[J]. 生物技術通訊,2003,14(2):136-137.
[8] 張會會,王怡薇,王彥禮,等.雪蓮細胞培養物調血脂及抗氧化作用研究[J].中國中醫基礎醫學雜志,2014,36(9):1466-1468.
[9] 王怡薇,劉雅萍,張獻,等.雪蓮細胞培養物對卵巢切除大鼠骨密度的影響[J].國際中醫中藥雜志,2013,19(12):824-826.
[10] 張翼.實用血液流變學[M].南寧:廣西師范大學出版社,2009:28-53.
[11] N SCHEINFELDA. A comprehensive review and evaluation of the side effects of the tumor necrosis factor alpha blockers etanercept, infliximab and adalimumab[J].Journal of Dermatological Treatment,2004,15(5):280-294.

