ABA及氟啶酮調控下冬小麥分蘗節抗寒相關蛋白的鑒定與分析
楊 寧,包雨卓,趙浡彤,呂 巖,彭瞰看,田 宇,徐慶華,于 晶,王軍虹,蒼 晶
(1.東北農業大學生命科學學院,黑龍江哈爾濱 150030; 2.廣東白云學院,廣東廣州 510450)
低溫脅迫是限制小麥產量的主要因素。ABA是重要的植物激素之一。研究證實,外源施加ABA能夠促進植物體內ABA的合成和運輸,增加滲透調節物質的含量,提高抗氧化酶活性,誘導抗寒相關基因表達以及促進相關酶的重新合成,從而提高植物抗寒性[1-2]。氟啶酮是ABA合成的抑制劑,通過抑制ABA前體物質類胡蘿卜素的合成,從而抑制植物體內ABA的合成[3-4]。用氟啶酮作對照,可進一步明確哪些蛋白可能受到ABA的誘導。
雙向電泳技術是蛋白質組學研究的關鍵技術,在植物抗逆相關研究中應用日趨廣泛,對植物抗寒等抗性研究已取得了一些進展。Meza-Basso等[5]首次通過雙向電泳技術在油菜中發現受低溫誘導的蛋白,并在多種植物中得到應用。Hashimoto等[6]采用雙向電泳在對低溫脅迫下水稻幼苗的研究中發現,水稻葉鞘、葉片和根系在低溫處理后出現39個蛋白差異點。Cui等[7]采用雙向電泳對不同溫度處理下水稻幼苗葉片蛋白進行分離,鑒定到41個低溫誘導蛋白。Gao等[8]采用雙向電泳在對鹽芥蓮座葉響應低溫脅迫的蛋白研究中發現,所有參與RNA代謝、防御和蛋白代謝的蛋白質都顯著上調。
東農冬麥1號是首例可在北方高寒地區安全越冬的強抗寒冬小麥品種,返青率大于85%。本課題組前期研究發現,東農冬麥1號分蘗節是其物質準備能力和抗寒代謝適應最強的器官,在冬小麥安全越冬中起重要作用[9]。鑒于此,本試驗以東農冬麥1號為材料,于三葉期分別外源噴施10 μmol·L-1ABA和50 μmol·L-1氟啶酮,待大田自然降溫至4 ℃和-25 ℃時取分蘗節,采用聚丙烯酰胺凝膠電泳對各處理組全蛋白進行分離,然后進一步采用雙向電泳分離蛋白,篩選出與ABA調控相關或與低溫應答相關的差異蛋白后進行質譜分析,探討外源ABA對低溫下冬小麥蛋白質組的影響,進而揭示冬小麥抗寒的蛋白質基礎及其與ABA調控的關系。
1 材料與方法
1.1 試驗材料種植及取樣
供試冬小麥(TriticumaestivumL.)材料為東農冬麥1號,由東北農業大學小麥育種研究室提供。
選取籽粒飽滿一致的冬小麥種子于東北農業大學試驗田播種。完全區組設計,3次重復,小區行長1.5 m,10行區,行距0.2 m,播種量為450粒·m-2,播深5 cm,常規管理。待冬小麥生長至三葉期時,分別采用10 μmol·L-1ABA、50 μmol·L-1氟啶酮(二者濃度為前期試驗確定的最適濃度)進行葉面噴施,用量為0.25 L·m-2,以噴施等量蒸餾水為對照。分別于10 d最低溫平均4 ℃和-25 ℃時取樣。各處理分別取50株長勢相似的麥苗,將分蘗節剪成0.5 cm的小段,混勻后用液氮迅速冷凍,于-80 ℃冰箱保存備用。
1.2 全蛋白的提取、裂解及定量
全蛋白的提取參照Damerval等[10]的方法并略作改進。取1.0 g樣品在液氮中充分研磨,轉入50 mL離心管中。加入10 mL預冷的10% 三氯乙酸(TCA)/丙酮溶液,于-20 ℃冰箱放置45 min。4 ℃、16 000 r·min-1離心15 min,棄上清,重懸沉淀。加入10 mL預冷的10% TCA/丙酮溶液,于-20 ℃冰箱放置45 min。4 ℃、16 000 r·min-1離心15 min,棄上清,沉淀中加入預冷的80%丙酮,振蕩混勻后于-20 ℃冰箱放置45 min(重復兩次該步驟)。棄上清,沉淀低溫冷凍干燥成粉末狀。
在上述所得到的粉末狀蛋白質樣品中加入500 μL裂解液(7 mol·L-1尿素、2 mol·L-1硫脲、4% CHAPS、65 mol·L-1DTT、2% IPG buffer)混勻,渦旋振蕩20 min,4 ℃過夜。取上清,用蛋白質定量試劑盒(2-D Quant-Kit,GE-Healthcare)定量。
1.3 蛋白雙向電泳
根據蛋白質含量吸取一定體積的蛋白溶液,加適量水化液(7 mol·L-1尿素、2 mol·L-1硫脲、2% CHAPS、20 mmol·L-1DTT、0.5% IPG buffer、0.1%溴酚藍)補齊至450 μL,加入膠條槽中,用24 cm IPG strip覆蓋,通過Ettan IPGphor Ⅲ(GE-Healthcare)進行等電聚焦,聚焦程序設置為:主動水化30 V 10 h,200 V 1 h,500 V 1 h,1 000 V 1 h,4 000 V 1 h,8 000 V 1 h,64 000 Vh聚焦,500 V維持。
第一相等電聚焦結束后,將膠條取出置于放入10 mL膠條平衡緩沖液Ⅰ[6 mol·L-1尿素、75 mmol·L-1Tris-HCl(pH 8.8)、29.3%甘油、2% SDS、0.002%溴酚藍、1% DTT]的水化盤中,平衡15 min。取出后再放入10 mL膠條平衡緩沖液Ⅱ[6 mol·L-1尿素、75 mmol·L-1Tris-HCl(pH 8.8)、29.3%甘油、2% SDS、0.002%溴酚藍、2.5%碘乙酰胺]中平衡15 min。平衡完畢后,將膠條在電極緩沖液中浸泡2 s后轉移到12.5%的SDS-PAGE凝膠上,低熔點瓊脂糖封膠后,應用Ettan Dalt Six(GE-Healthcare)進行第二相SDS-PAGE電泳,20 ℃恒溫下,1 W 30 min,13 W直至溴酚藍移至凝膠底部,電泳停止。
1.4 染色與脫色
電泳結束后,將膠塊取出置于20%TCA中固定15 min后,用染色液(450 mL蒸餾水、450 mL無水乙醇、100 mL冰乙酸、2.5 g考馬斯亮藍R250)染色2 h后,轉至脫色液中(450 mL蒸餾水、450 mL無水乙醇、100 mL冰乙酸)中,不斷更換脫色液直到條帶清晰可見。
1.5 凝膠掃描及質譜分析
待凝膠背景清晰后,用Ettan Image Scanner掃描儀拍照后,將凝膠保存于含有10%冰乙酸的溶液中。利用ImageMasterTM2D Platinum 7.0軟件(GE Healthcare)對圖像進行分析,篩選出差異表達的蛋白點,選擇相對體積改變大于2倍的蛋白點,借助SPSS進行分析,選擇其中差異倍數在2倍以上的24個蛋白點切膠后進行質譜分析。
用含50%乙腈的25 mmol·L-1碳酸氫銨洗脫后乙腈脫水。56 ℃下用10 mmol·L-1DTT打開二硫鍵,然后暗處55 m mol·L-1IAM處理,進行半胱氨酸的烷基化封閉,最后用胰蛋白酶溶液裂解。裂解液用MALDI-TOF/TOF進行肽指紋圖譜及二級質譜測定。質譜儀檢測時設置參數為:檢測模式為反射模式,譜圖質量范圍為500~3 500 Da,分辨率為50 000。默認每張一級譜圖選擇5個母離子進行二級鑒定。蛋白質膠點鑒定主要是通過試驗產生的質譜數據,與數據庫模擬得到的理論質譜數據進行匹配,從而得到蛋白質鑒定結果。
2 結果與分析
2.1 各處理組冬小麥分蘗節的雙向電泳圖譜
4 ℃時,各處理組雙向電泳結果如圖1。對圖1各處理組進行軟件分析,得到可匹配的蛋白點587個。ABA處理組與對照組相比,133個蛋白點差異表達變化量達到2倍以上,其中,115個蛋白點上調,18個蛋白點下調(圖1a、圖1b);氟啶酮處理組與對照組相比,59個蛋白點差異表達變化量達到2倍以上,其中,31個點上調,28個點下調(圖1a、圖1c);ABA處理組與氟啶酮處理組相比,差異表達變化量達到2倍以上的點有64個,其中36個點上調,28個點下調(圖1b、圖1c)。
25 ℃時,各處理組雙向電泳結果如圖2。對圖2各處理組進行軟件分析得到可以匹配的蛋白點394個。ABA處理組與對照組相比,61個蛋白點差異表達變化量達到2倍以上,其中,41個蛋白點上調,20個蛋白點下調(圖2a、圖2b);氟啶酮處理組與對照組相比,84個蛋白點差異表達變化量達到2倍以上,其中,29個點上調,55個點下調(圖2a、圖2c);ABA處理組與氟啶酮處理組相比,差異表達變化量達到2倍以上的點有65個,其中34個點上調,31個點下調(圖2b、圖2c)。
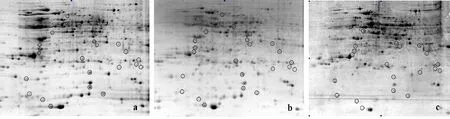
a:對照組;b:ABA處理組;c:氟啶酮處理組。圖2同。
a:Control; b:ABA treatment; c:Fluridone treatment. The same in figure 2.
圖14℃時各處理組的2-DE圖譜
Fig.12-DEmapsofeachtreatmentat4℃
2.2 差異表達蛋白點的選擇和質譜鑒定結果
對各處理之間差異倍數達到2倍以上的蛋白點進行篩選,選擇在低溫下變化倍數較大及在ABA處理組和氟啶酮處理組中變化相反的23個蛋白點,和低溫下消失的蛋白點1個,共24個蛋白點(圖3)。其中,21個(點1~14、點16~17、點19~23)在ABA處理組中上調,而在氟啶酮處理組下調;2個(點15、點18)在ABA處理組中下調,而在氟啶酮處理組上調;1個(點24)在4 ℃特異表達,-25 ℃消失的蛋白點。對以上篩選到的24個蛋白點進行質譜分析,均得到了完整的肽指紋圖譜,Mascot數據庫檢索結果如表1示,其中15種為已知蛋白,9種未知蛋白。
由圖4可知,鑒定出的蛋白與譜圖匹配的肽段長度占整個蛋白長度40%~100%、35%~40%、30%~35%、25%~30%的分別有28%、20%、11%、11%,說明鑒定出的蛋白覆蓋率較高,有較高的可信度。
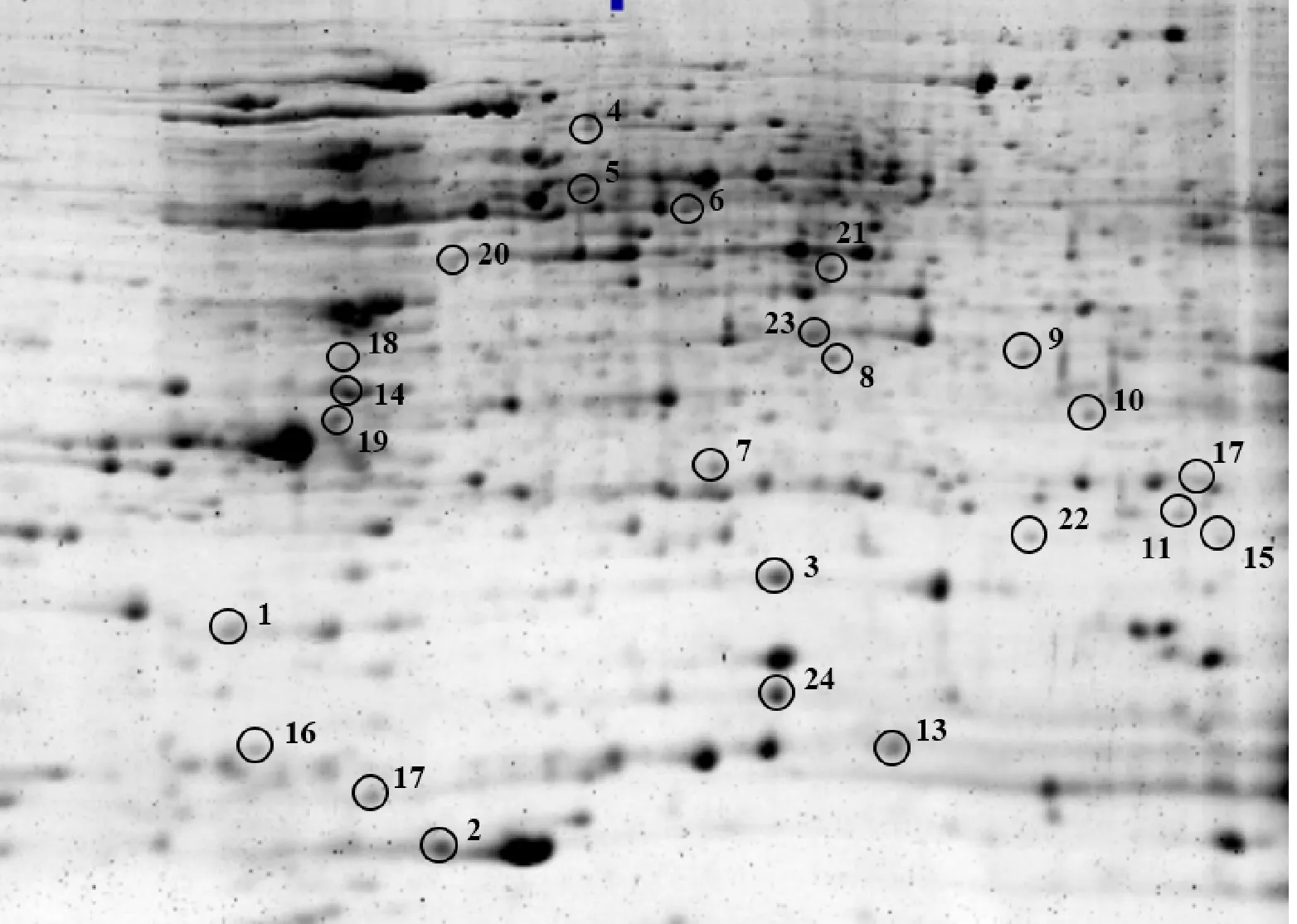
圖3 4 ℃下進行質譜分析的蛋白點
2.3 差異蛋白的功能分析
已鑒定出的差異蛋白可分為逆境蛋白、代謝相關蛋白、轉錄翻譯相關蛋白和未知蛋白。逆境蛋白包括低溫誘導蛋白16(點1)、低溫響應RNA結合蛋白(點2)、冷調節蛋白(點16、點17)。代謝相關蛋白包括磷酸甘油酸變位酶(點4)、磷酸甘油酸激酶(點23)、ATP合酶β亞基(點5)、谷胱甘肽S轉移酶1(點7)、26S蛋白酶非ATP酶調節亞基(點10)、谷胱甘肽轉移酶(點11)和谷胱甘肽轉移酶F5(點15)。轉錄翻譯相關蛋白包括新生多肽相關復合物β亞基(點3)、4A真核起始因子(點6)和真核翻譯起始因子5A3(點24)。未知蛋白包括點8、9、12、13、14、18、19、20、21和22。
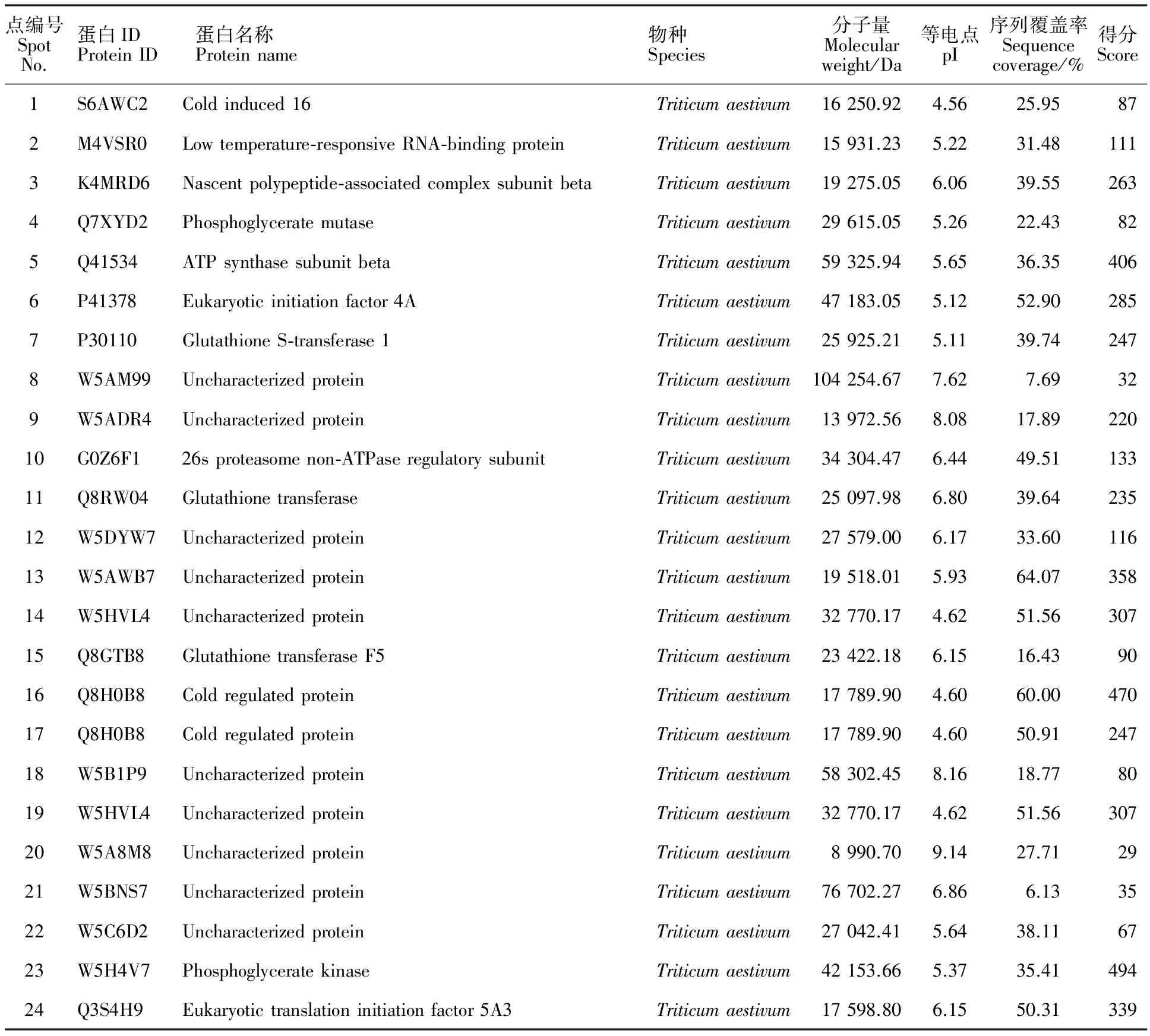
表1 質譜分析結果Table 1 Results of mass spectrometry
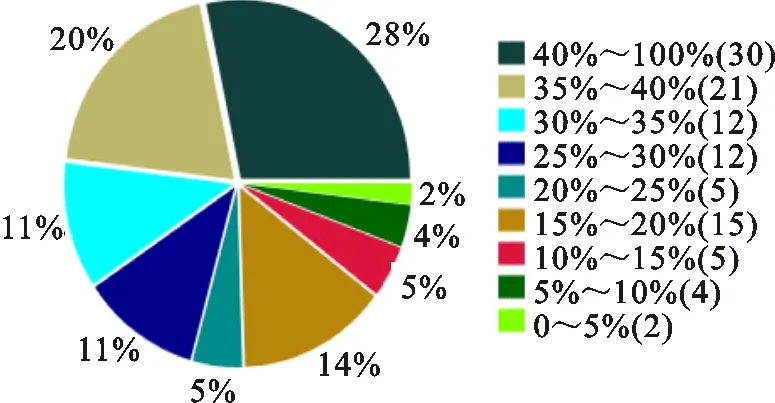
圖例中,百分數表示蛋白鑒定覆蓋率,括號內數字表示覆蓋率范圍內的蛋白種類數。
In the legend,the percentage indicates protein sequence coverage,and the data in the parenthesis indicates the number of protein species within that sequence coverage.
圖4蛋白鑒定覆蓋率分布
Fig.4Distributionofproteinsequencecoverage
3 討 論
3.1 逆境蛋白
低溫誘導蛋白16(cold induced 16, WCI16)(點1)是冬小麥在冷馴化期間誘導的一種蛋白,Sasaki K等[11]的研究從晚期胚胎發育蛋白(late embriogenesis abundant protein, LEA)通常具有的4個特征(超親水性、沸騰溶解度、應力誘導性和應激保護性)證明了WCI16可能代表一類新的LEA蛋白。植物LEA蛋白被認為是一種逆境響應蛋白,低溫、干旱及ABA等均可誘導其表達,其中ABA是LEA蛋白基因表達的重要調節因子,根據LEA蛋白基因表達是否依賴ABA可分為ABA依賴型和非ABA依賴型[12]。本試驗中WCI16在ABA處理組與氟啶酮處理組表達量變化相反的特點,說明該蛋白可能是ABA依賴型LEA蛋白。
RNA結合蛋白(RNA-binding protein, Rbps)是基因表達轉錄后調控的關鍵蛋白[13],植物中編碼該蛋白的基因在玉米、擬南芥、煙草和大麥等植物中均被克隆得到。研究表明,擬南芥中編碼該蛋白的多個基因表達量在低溫條件下顯著增加[14],與本研究中低溫響應RNA結合蛋白(low temperature-responsive RNA-binding protein, LTR-Rbps)在低溫ABA處理下表達量上調的趨勢一致,而在ABA處理組與氟啶酮處理組表達量相反的結果則表明,低溫響應RNA結合蛋白受到外源ABA的誘導。
冷調節蛋白(cold regulated protein, CORPs)(點16、17)是大多數植物在低溫馴化誘導條件下產生的一類特異性蛋白,研究發現,除低溫外,外源ABA、鹽脅迫、干旱、熱激等逆境脅迫均能誘導CORPs產生[15]。本試驗得到的COR蛋白WCOR18與之前報道過的大麥COR蛋白Tma-ap3具有高度同源性[16]。
3.2 代謝相關蛋白
磷酸甘油酸變位酶(phosphoglycerate mutase, PGAM)(點4)是糖酵解和糖異生途徑中催化3-磷酸甘油酸和2-磷酸甘油酸相互轉化的關鍵酶,一般分為輔因子依賴型PGAM(dPGAM)和輔因子非依賴型PGAM(iPGAM),其中,iPGAM廣泛分布在植物中,并且在響應非生物脅迫中起重要作用。Amme等[17]在擬南芥的低溫脅迫研究中發現,AtiPGAM1表達量顯著升高,說明AtiPGAM1在植物遭受冷脅迫時起正調節作用。本試驗中PAGM在低溫和ABA處理下表達量上升,說明該酶能夠響應植物的低溫脅迫,并可能受到外源ABA的誘導。
磷酸甘油酸激酶(phosphoglycerate kinase, PGK)(點23)的主要功能是作為糖酵解途徑的關鍵酶,催化1,3-二磷酸甘油酸轉化成3-磷酸甘油酸的過程,并產生1分子ATP,逆反應生成1分子ADP[18]。PGK在非生物脅迫下表達量升高產生ATP以增強植物抗性,該結果在水稻[19]和豌豆[20]均已被證實。本研究中PGK在低溫和ABA處理下表達量升高,說明PGK能夠提高植物在低溫脅迫下的抗性,一定量的ABA可能誘導PGK表達量升高從而增強植物抗逆性。
20S蛋白酶體能選擇性降解氧化脅迫受損的蛋白,這一功能不依賴ATP和泛素[21]。本研究中得到的26S蛋白酶體非ATP酶調節亞基(26S proteasome non-ATPase regulatory subunit, 26SRP)(點10)在低溫下表達量增加,可能是為了清除低溫脅迫中被氧化的正常蛋白質,在ABA處理下表達量增加結果則表明,該蛋白可能受到外源ABA的誘導。
ATP合成酶廣泛分布于線粒體膜和葉綠體類囊體膜上。作為在高等植物能量代謝中的關鍵酶之一,它跨膜質子動力促進合成ATP,參與氧化磷酸化和光合磷酸化反應。本試驗中ATP合成酶β-亞基(ATP synthase subunit beta, ATPase-β)(點5)的表達量上調這一結果與Kong等[22]在 OsNAS1轉基因甘藍型油菜鹽脅迫條件下得到的結論一致。基于以上推測,ATP合成酶β-亞基在低溫下ABA處理后參與離子轉運能力增強,從而降低細胞滲透勢,提高植物的抗寒性。
谷胱甘肽轉移酶在植物的初級代謝和次級代謝、耐受脅迫和細胞信號轉導過程中行使許多不同的功能,從而影響植物的生長發育。植物GST家族中的許多成員都與植物抗逆性有關,如對除草劑、高鹽、低溫和紫外輻射等的抗性[23]。Harshavardhanan等[24]在關于甘藍GST的全基因組表征研究中,發現BoGST基因具有潛在的抗寒功能。本研究中谷胱甘肽S轉移酶1(glutathione S-transferase 1, GST1)(點7)、谷胱甘肽轉移酶(glutathione transferase,GST)(點11)在低溫下ABA處理后表達量上調,而谷胱甘肽轉移酶F5(glutathione transferase F5, GSTF5)(點15)則下調,這一結果表明GST參與植物應對低溫脅迫的調控過程,一定濃度ABA能提高植物抗寒性。點15表達量下調,則可能是由于這三種不同的谷胱甘肽轉移酶調控的反應不同導致的,點7、點11和點15的調控機制仍有待進一步研究。
3.3 轉錄翻譯相關蛋白
新生多肽復合物β亞基(點3)即為基本轉錄因子3(basic transcription factor 3, BTF3)。有研究從小麥中克隆到一個受凍害脅迫誘導表達上調的BTF3家族基因 TaBTF3,該基因在鹽、干旱、冷、ABA、MeJA和SA脅迫處理下均被誘導表達上調[25],這與本試驗得到的該蛋白在低溫、ABA處理下表達量上調的結果一致。
本研究中真核翻譯起始因子4A(eukaryotic initiation factor 4A, eIF4A)(點6)在低溫ABA處理條件下表達量增加,能夠增加其與真核基因啟動子區域中順式作用元件的特異性結合,通過與其他相關蛋白的相互作用,激活轉錄過程,增強目的基因的表達強度,增加目的蛋白的表達量,從而影響植物抗寒能力。與Stockinger等[26]在研究擬南芥中由 CBF1編碼含有轉錄因子的AP2結構域在低溫脅迫條件下的調節作用時也得到類似的研究結果。
真核細胞翻譯起始因子5A(eukaryotic translation initiation factor 5A3, eIF5A)是真菌、動植物體內普遍存在的蛋白質翻譯起始因子。擬南芥的研究中發現了三個表達特征不同的eIF5Ab編碼基因[27],其中,eIF5A3在細胞分裂活躍的吸脹種子中高表達,在擬南芥中過表達eIF5A3,花瓣從正常的四瓣變為五瓣,葉子變為并生葉,種子變為原來的兩倍大,說明eIF5A3在發育早期促進細胞分裂。本研究中真核翻譯起始因子5A3(點24)在4 ℃下特異表達,該時期恰好是冬小麥分蘗的旺盛期,與其分蘗節的細胞增殖相適應,而在-25 ℃時該蛋白消失,與小麥在-25 ℃低溫下細胞分裂停滯相一致,可能是低溫下eIF5A3不表達的結果。
綜上所述,植物應對低溫是一個復雜的調控過程。本研究發現外源ABA處理下,與對照組相比出現顯著差異的蛋白可分為逆境蛋白、代謝相關蛋白和轉錄翻譯相關蛋白。其中,代謝相關蛋白最多,包括物質代謝和能量代謝。糖代謝相關蛋白在ABA處理下表達量上調,促進植物新陳代謝,為抵御外界脅迫提供一定動力,本課題組前期研究也發現,ABA對東農冬麥1號糖代謝有促進作用[1]。ATP合成酶相關蛋白在ABA處理后表達量上調,為植物體內抵抗脅迫的各種代謝活動提供能量。有兩種低溫誘導的轉錄因子在ABA處理組表達量上調,通過在轉錄水平調控相關目的蛋白的表達量,從而增強植物抗寒性。逆境蛋白都在ABA處理組上調,氟啶酮處理組下調,說明ABA對冬小麥抗逆性的提高起重要作用。此外,本研究還有10種未知蛋白,這主要由于小麥的蛋白信息相對比較匱乏,但近年來蛋白質組學發展迅速,相信隨著蛋白質數據庫的不斷完善,這些問題會很快得到解決。
[1] 劉麗杰,蒼 晶,李懷偉,等.外源ABA對冬小麥越冬期呼吸代謝關鍵酶與糖代謝的影響[J].麥類作物學報,2013,33(1):71.
LIU L J,CANG J,LI H W,etal.Effects of exogenous abscisic acid on key enzymes of respiratory metabolism and sugar metabolism of winter wheat in the wintering period [J].JournalofTriticeaeCrops,2013,33(1):71.
[2] ZENG Y,YU J,CANG J,etal.Detection of sugar accumulation and expression levels of correlative key enzymes in winter wheat(Triticumaestivum) at low temperatures [J].BioscienceBiotechnologyBiochemistry,2011,75(4):681.
[3] TOSHIHITO Y,TAKASHI E,SHIGERU S.Restoration of seed germination at supraoptimal temperatures by fluridone,an inhibitor of abscisic acid biosynthesis [J].PlantCellPhysiology,1998,39(3):308.
[4] RASMUSSEN R D,HOLE D,HESS J R,etal.Wheat kernel dormancy and(+)-abscisic acid level following exposure to fluridone [J].JournalofPlantPhysiology,1997,150(4):444.
[5] MEZA-BASSO L,ALBERDI M,RAYNL M,etal.Changes in protein synthesis in rapeseed seedlings during a low temperature treatment [J].PlantPhysiology,1986,82(3):733.
[6] HASHIMOTO M,KOMATSU S.Proteomic analysis of rice seedlings during cold stress [J].Proteomics,2007,7(8):1293.
[7] CUI S,HUANG F,WANG J,etal.A proteomic analysis of cold stress responses in rice seedlings [J].Proteomics,2005,5(12):3162.
[8] GAO F,ZHOU Y,ZHU W,etal.Proteomic analysis of cold stress-responsive proteins inThellungiellarosette leaves [J].Planta,2009,230(5):1043.
[9] 于 晶,張 林,崔 紅,等.高寒地區冬小麥東農冬麥1號越冬前的生理生化特征[J].作物學報,2008,34(11):2020.
YU J,ZHANG L,CUI H,etal.Physiological and biochemical characteristics of Dongnongdongmai 1 before wintering in high-cold area [J].ActaAgronomicaSinica,2008,34(11):2020.
[10] DAMERVAL C,VIENNE D D,ZIVY M,etal.Technical improvements in two-dimensional electrophoresis increase the level of genetic variation detected in wheat-seedling proteins [J].Electrophoresis,1986,7(1):52.
[11] SASAKI K,CHRISTOV N K,TSUDA S,etal.Identification of a novel LEA protein involved in freezing tolerance in wheat [J].PlantandCellPhysiology,2014,55(1):136.
[12] 劉 洋,邢 鑫,李德全.LEA蛋白的分類與功能研究進展[J].生物技術通報,2011(8):38.
LIU Y,XING X,LI D Q.Studies on classification and function of LEA proteins [J].BiotechnologyBulletin,2011(8):38.
[13] 唐 蜻.植物RNA結合蛋白研究進展[J].安徽農業科學,2010,38(1):38.
TANG J.Research progress on the plant RNA-binding proteins [J].JournalofAnhuiAgriculturalScience,2010,38(1):38.
[14] FUSARO A F,BOCCA S N,RAMOS R L B,etal.AtGRP2,a cold-induced nucleo-cytoplasmic RNA-binding protein,has a role in flower and seed development [J].Planta,2007,225:1348.
[15] 郭新勇,程 晨,王愛英,等.天山雪蓮冷調節蛋白基因siCOR轉化煙草植株的抗旱性分析[J].植物學報,2012,47(2):115.
GUO X Y,CHENG C,WANG A Y,etal.Drought-tolerance analysis of tobacco plant transformed withSasussuredinvolucratasiCORgene [J].ChineseBulletinofBotany,2012,47(2):115.
[16] KOBAVASHIA F,TAKUMIA S,NAKATAA M,etal.Comparative study of the expression profiles of theCor/Leagene family in two wheat cultivars with contrasting levels of freezing tolerance [J].PhysiologlaPlantarum,2003,120:591.
[17] AMME S,MATROS A,SCHLESIER B,etal.Proteome analysis of cold stress response inArabidopsisthalianausing DIGE-technology [J].JournalofExperimentalBotany,2006,57(7):1537.
[18] 郭 楠,趙敬會,高天姝,等.甘藍型油菜PGK基因的克隆與表達分析[J].西北植物學報,2014,34(11):2189.
GUO N,ZHAO J H,GAO T S,etal.Cloning and expression analysis of PGK gene inBrassicanapus[J].ActaBotanicaBoreali-OccidentaliaSinica,2014,34(11):2189.
[19] SINGH R,JWA N S.Understanding the responses of rice to environmental stress using proteomics [J].JournalofProteomeResearch,2013,12:4652.
[20] KHATOON A,REHMAN S,HIRAGA S,etal.Organ-specific proteomics analysis for response mechanism in soybean seedlings under flooding stress [J].JournalofProteomics,2012,75:5706.
[21] SHRINGARPURE R,GRUNESCAPE T,MEHLHASE J,etal.Ubiquitin conjugation is not required for the degradation of oxidized proteins by proteasome [J].JournalofBiologicalChemistry,2003,278(1):311.
[22] KONG F,MAO S,DU K,etal.Comparative proteomics analysis of OsNAS1 transgenicBrassicanapusunder salt stress [J].ChineseScienceBulletin,2011,56(22):2343.
[23] 胡廷章,周大祥,羅 凱.植物谷胱甘肽轉移酶的結構與功能及其基因表達[J].植物生理學通訊,2007,43(1):198.
HU T Z,ZHOU D X,LUO K.Structure and biological function of glutathione transferases and their genes in plant [J].PlantPhysiologyCommunications,2007,43(1):198.
[24] HARSHAVARDHANAN V,SENTHIL K T,ASHOKRAJ S,etal.Glutathione transferases superfamily:cold-inducible expression of distinctGSTgenes inBrassicaoleracea[J].InternationalJournalofMolecularSciences,2016,17:1211.
[25] KANG G Z,MA H Z,LIU G Q,etal.Silencing of TaBTF3 gene impairs tolerance to freezing and drought stresses in wheat [J].MolecularGeneticsandGenomics,2013,288:591.
[26] STOCKINGER E J,GILMOUR S J,THOMASHOW M F,etal.ArabidopsisthalianaCBF1 encodes an AP2 domain containing transcriptional activator that binds to the C-repeat/DRE,acis-acting DNA regulatory element that stimulates transcription in response to low temperature and water deficit [J].PlantBiology,1997,94:1039.
[27] THOMPSON J E,HOPKINS M T,TAYLOR C,etal.Regulation of senescence by eukaryotic translation initiation factor 5A:implications for plant growth and development [J].TrendsinPlantScience,2004,9(4):177.

