通心絡干預的心肌微血管內皮細胞條件培養液對大鼠心肌細胞凋亡的影響
位庚,梁俊清,姚兵,郭志方
心肌微血管不僅可以控制心肌微循環血流,為心肌細胞供血、供氧,而且構成心肌微血管的單層微血管內皮細胞還是重要的代謝和內分泌器官,通過旁分泌和自分泌功能在心肌細胞生長發育、組織代謝、收縮功能以及節律控制方面起著重要作用[1]。已有研究表明,心肌微血管內皮細胞結構和功能破壞成為急性心肌梗死(acute myocardial infarction,AMI)無再流和再灌注損傷、AMI后心律失常及心力衰竭病理過程的重要機制,而且AMI后大部分患者出現心肌電重構、組織重構、神經重構,而導致心律失常的發生,同時AMI患者由于心肌細胞凋亡、炎性損傷、神經內分泌激活進而發生心室重構最終出現心力衰竭[2-4]。亦有研究表明,心肌細胞凋亡是發生多種重癥心血管疾病的關鍵因素[5]。因此本研究以心肌微血管內皮細胞損傷為切入點,觀察心肌微血管內皮細胞受損對心肌細胞凋亡的影響,對闡釋心肌細胞凋亡的心肌微血管發病機制,尋找有效干預措施和藥物將具有重要意義。
1 材料與方法
實驗動物:2周齡SPF級SD雄性大鼠10只,體重(30±5)g,由北京富豪實驗動物養殖中心提供,許可證號:SCXK(京)2011-0012。實驗細胞:大鼠胚胎H9c2心肌細胞購自中國科學院細胞庫。
藥物及試劑:通心絡藥粉由石家莊以嶺藥業股份有限公司提供,批號S-130901。同型半胱氨酸(美國Sigma公司);內皮細胞培養套裝(美國Sciencell公司);活性氧簇(reactive oxygen species,ROS)測試盒(南京建成生物工程研究所);JC-1線粒體膜電位分析試劑盒(美國Cayman公司);細胞色素-C(cytochrome-C,Cyt-C)抗體、半胱氨酸天冬氨酸蛋 白 酶 -3(cysteinyl aspartate specific proteinase-3,Caspase-3)抗體、B細胞白血病/淋巴瘤2(B-cell 1 eukemia/1 ymphoma 2,Bcl-2)抗體及B細胞白血病淋巴瘤-2相關蛋白(Bcl-2-associated X protein gene,Bax)抗體(美國Cell Signaling Technology公司)。
主要儀器:多功能酶標儀(美國BioTek公司);FACSAriaⅢ流式細胞儀(美國BD公司);UVP凝膠掃描系統(美國UVP公司);電轉膜儀、半干轉膜儀、垂直電泳儀(美國Bio-Rad公司);DeltaVision Elite高分辨率細胞成像系統(美國GE公司)。
原代大鼠心肌微血管內皮細胞分離、培養和鑒定:參照文獻[6]并加以改進提取大鼠心肌微血管內皮細胞(rat cardiac microvascular endothelial cells,RCMECs),并用文獻[7]的方法進行鑒定。提取的原代RCMECs經血小板-內皮細胞黏附分子(platelet-endothelial cell adhesion molecule-1,CD31)免疫熒光鑒定顯示純度大于95%。
同型半胱氨酸誘導大鼠心肌微血管內皮細胞損傷模型的建立:取對數生長期RCMECs,胰酶消化后,調整細胞密度為1.0×105個/ml,種于6 cm細胞培養皿中,待細胞生長至融合80%時,棄去舊培養基,更換含10 mmol/L同型半胱氨酸(homocysteine,Hcy)的內皮細胞基礎培養基,置于37℃、5% CO2的培養箱中繼續培養24 h。
通心絡藥液配制:參照文獻[8],稱取通心絡藥粉溶于內皮細胞基礎培養基,超聲促溶20 min,6500 g離心10 min,收集上清液,用0.22 μm微孔濾器過濾除菌,將所得沉淀于60 ℃加熱烘干,計算實際溶于內皮細胞基礎培養基藥物重量,制備成10 mg/ml通心絡貯存液,分裝后-20 ℃貯存備用,實驗時稀釋至400 μg/ml。
大鼠心肌微血管內皮細胞條件培養液的制備:取對數生長期RCMECs,0.25%胰蛋白酶消化后,調整細胞密度為1.0×105個/ml,接種于6 cm細胞培養皿中,待細胞生長至融合80%時用于實驗。制備3種RCMECs條件培養液:(1)正常RCMECs條件培養液(normal-conditioned medium,N-CM):棄去原培養基,換為內皮細胞基礎培養基(endothelial cell medium,ECM);(2)Hcy誘導損傷的 RCMECs條 件 培 養 液(homocysteine-conditioned medium,H-CM):棄去原培養基,換為含10 mmol/L Hcy的內皮細胞基礎培養基;(3)通心絡干預的RCMECs條件培養液(Tongxinluo-conditioned medium,T-CM):棄去原培養基,換為含400 μg/ml通心絡的內皮細胞基礎培養基預孵育4 h后,最后換為含10 mmol/L Hcy和400 μg/ml通心絡的內皮細胞基礎培養基。各組細胞置于37℃、5% CO2的培養箱中培養24 h后,棄去上清液,用無血清細胞培養基(DMEM)清洗兩次,再加入DMEM,置于培養箱中繼續培養6 h,收集各組細胞上清液,離心取上清,獲得各組微血管內皮細胞條件培養液。
H9c2心肌細胞分組及處理:取對數生長期H9c2心肌細胞,胰酶消化后,調整細胞密度為1.0×105個/ml,接種于6 cm細胞培養皿/96孔細胞培養板中,待細胞生長至融合80%時用于實驗。將H9c2心肌細胞分為4組(每組設平行復孔3~4個):(1)正常對照組:棄去原培養基,換為DMEM;(2)N-CM組:棄去原培養基,換為正常RCMECs條件培養液;(3)H-CM組:棄去原培養基,換為Hcy誘導損傷的RCMECs條件培養液;(4)T-CM組:棄去原培養基,換為通心絡干預的RCMECs條件培養液。
采用JC-1試劑測定心肌細胞中線粒體膜電位(mitochondrial membrane potential,MMP)[9]:接種于96孔板的H9c2心肌細胞按上述H9c2細胞分組所示處理結束后,4組細胞置于37℃、5% CO2的培養箱中培養24 h,實驗操作步驟嚴格按JC-1試劑說明書進行檢測。
流式細胞儀檢測心肌細胞活性氧簇水平[7]:接種于6 cm細胞皿培養的H9c2心肌細胞按上述H9c2細胞分組所示處理結束后,4組細胞置于37℃、5%CO2的培養箱中培養24 h后棄取上清,磷酸鹽緩沖液(phosphate buffer saline,PBS)(7.9 g NaCl、0.2 g KCl、1.44 g Na2HPO4和 1.8 g K2HPO4溶于 800 ml 蒸餾水中,用HCl調節溶液的pH值至7.4,最后加蒸餾水定容至1 L)清洗細胞兩次,加入含2',7'-二氯熒光黃雙乙酸鹽(2,7-Dichlorodi -hydrofluorescein diacetate,DCFH-DA)(1:10000)的ECM,37℃、5%CO2培養箱中繼續孵育30 min,0.25%的胰酶消化2 min,加入ECM使細胞終止消化,輕輕吹打制成細胞懸液,移入1.5 ml無菌EP管中800 g離心5 min后棄上清收集細胞,PBS洗滌細胞2次后,移至流式管中,流式細胞儀檢測。
活細胞成像系統動態觀察心肌細胞凋亡過程[10]:取對數生長期的H9c2心肌細胞,0.25%胰蛋白酶消化,以Countess自動細胞計數儀計數后,調整細胞密度至1×105個/ml,用高糖型DMEM培養,接種于96孔玻璃底黑色細胞培養板中(100 μl/孔),待細胞貼壁并達到融合80%時,棄去舊培養基。每孔加入 Hoechst 33342染液 300 μl,37℃、5% CO2培養箱中避光孵育20 min,棄去染液,用高糖型DMEM清洗細胞2~3次,細胞按上述H9c2心肌細胞分組所示處理并加入高糖型DMEM或RCMECs條件培養液,將96孔玻璃底黑板置于活細胞成像系統的37℃、5% CO2飽和濕度的培養罩內,調整鏡頭到目標拍攝孔處,40倍物鏡進行拍攝。以5%光強度,曝光時間0.025 s的4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)(381~399 nm),通道調整焦距,依據細胞厚度調整Z軸步徑,以10 min為時間間隔,EM CCD相機連續拍攝15 h。采集各時間點照片利用Softworx軟件進行圖像處理。
采 用 Western Blot法 檢 測 Cyt-C、Caspase-3、Bax和Bcl-2蛋白表達:接種于6 cm細胞培養皿的H9c2心肌細胞按上述H9c2細胞分組所示處理結束后,4組細胞置于37℃、5% CO2的培養箱中培養24 h后吸凈上清,加入40 μl細胞裂解液于冰上充分裂解20 min,超聲破碎后4℃,6500 g離心20 min,收集上清取2 μl進行蛋白定量后,取等量蛋白樣品進行SDS聚丙烯酰胺凝膠電泳,半干轉膜后封閉,與一抗結合,4℃過夜后洗膜,與二抗結合,洗膜后用化學發光法檢測,以甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作為內參,以各目的蛋白吸光度值與GAPDH吸光度值的比值進行統計分析。
統計學處理:采用SPSS19.0統計軟件進行數據分析。數據以±s表示。組間比較用單因素方差分析,方差齊時采用最小顯著差法(LSD),若方差不齊采用Dunnett's T3法。P<0.05為差異有統計學意義。
2 結果
2.1 各組H9c2心肌細胞線粒體膜電位比較(表1)
與正常對照組比較,N-CM組細胞MMP無明顯變化(P>0.05);與N-CM組比較,H-CM組細胞MMP明顯降低(P<0.01);與H-CM組比較,T-CM組細胞MMP升高(P<0.01)。
表1 各組H9c2心肌細胞線粒體膜電位及活性氧簇水平比較(±s)
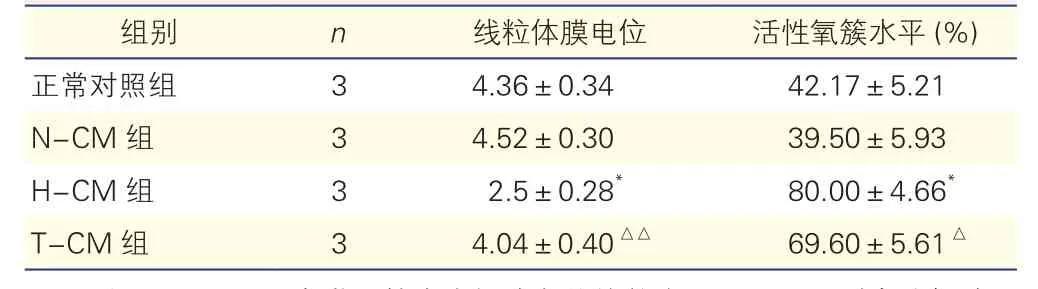
表1 各組H9c2心肌細胞線粒體膜電位及活性氧簇水平比較(±s)
注: N-CM:正常微血管內皮細胞條件培養液;H-CM:同型半胱氨酸誘導損傷的微血管內皮細胞條件培養液;T-CM:通心絡干預的微血管內皮細胞條件培養液。活性氧簇表示P2門內樣本比例,間接代表熒光強度。與N-CM組比較 *P<0.01,與 H-CM 組比較 △P<0.05 △△P<0.01
正常對照組 3 4.36±0.34 42.17±5.21 H-CM組 3 2.5±0.28* 80.00±4.66*
2.2 各組H9c2心肌細胞活性氧簇水平比較(表1、圖1)
與正常對照組比較,N-CM組細胞ROS水平無明顯差異(P>0.05);與N-CM組比較,H-CM組細胞ROS水平增加(P<0.01);與H-CM組比較,T-CM組細胞ROS水平降低(P<0.05)。
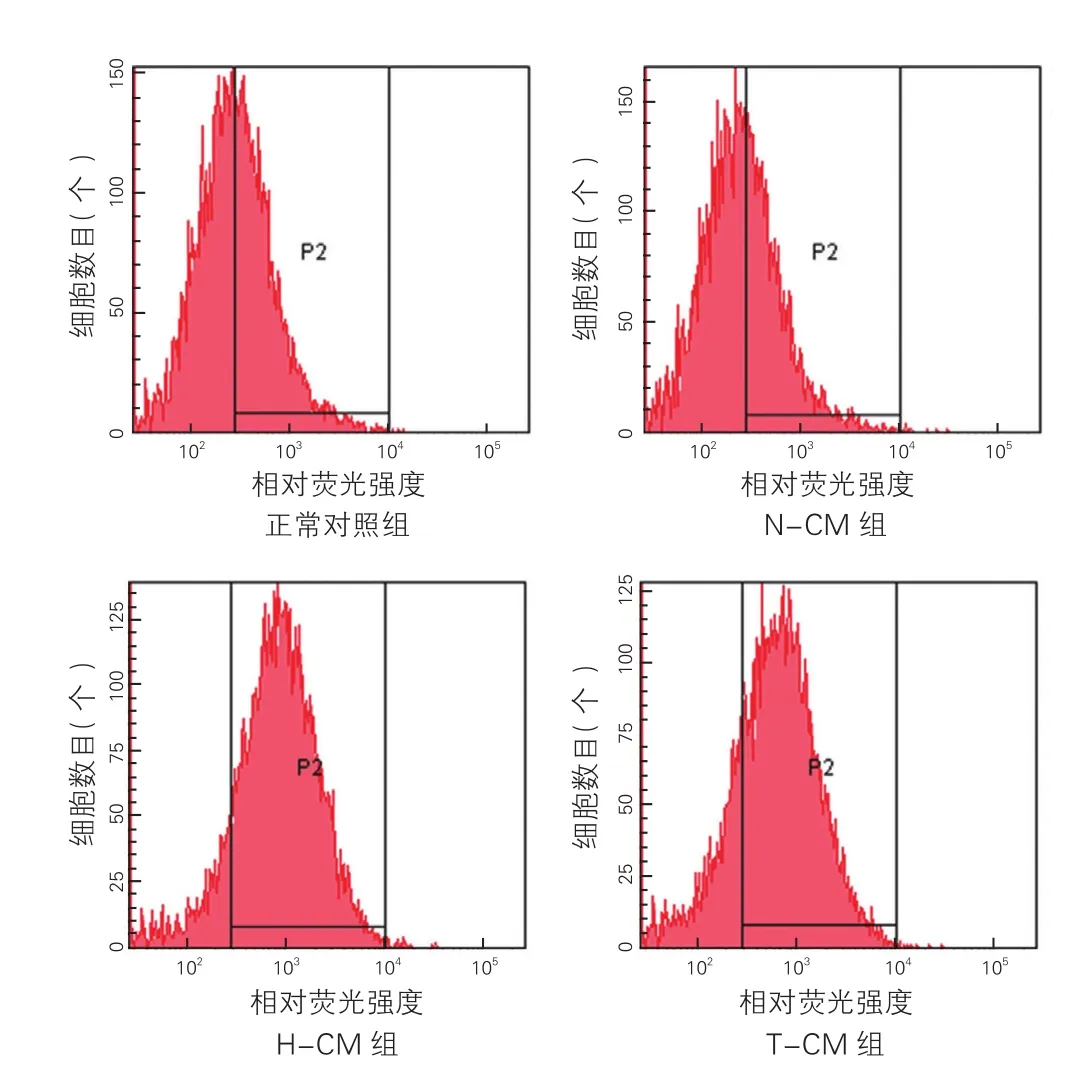
圖1 各組H9c2s心肌細胞活性氧簇水平比較(n=3, ±s)
2.3 活細胞成像系統動態觀察各組H9c2心肌細胞凋亡變化(圖2)
活細胞成像系統動態觀察15 h,發現正常對照組細胞存活狀態良好,細胞核圓潤無皺縮,邊緣清晰,熒光強度均一,部分細胞出現分裂增殖現象,極少數細胞凋亡(藍色為細胞核);與正常對照組比較,N-CM組細胞狀態無明顯差異,部分細胞分裂增殖,極少數細胞凋亡;與N-CM組比較,H-CM組細胞5 h內有極少數細胞分裂增殖,5 h開始出現細胞凋亡,5 h至15 h過程中部分細胞核皺縮、濃染,細胞核體積變小,核碎裂,細胞凋亡明顯,連續觀察至15 h細胞數量也明顯減少;與H-CM組比較,T-CM組細胞5 h未出現明顯的凋亡,有少數細胞分裂增殖,細胞狀態良好,5 h至15 h過程中有部分細胞核皺縮、碎裂,細胞凋亡,但凋亡細胞數量明顯減少。
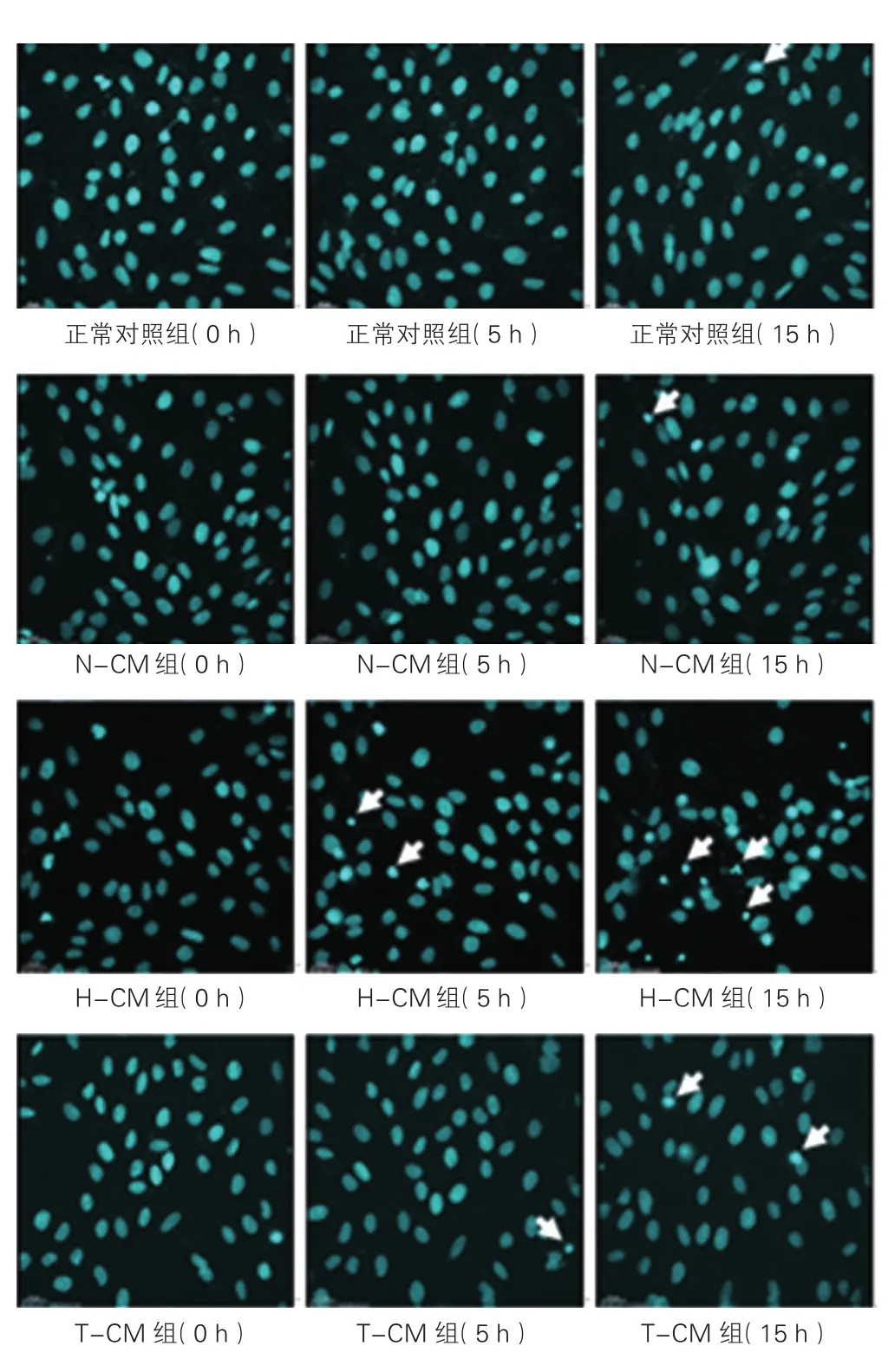
圖2 活細胞成像系統動態觀察各組H9c2心肌細胞凋亡情況(×400)
2.4 各組H9c2心肌細胞Cyt-C、Caspase-3、Bax和Bcl-2蛋白表達比較(圖3)
與正常對照組比較,N-CM組細胞Cyt-C蛋白表達無明顯變化(P>0.05);與N-CM組比較,H-CM組細胞Cyt-C蛋白表達上調(P<0.01);與H-CM組比較,T-CM組細胞Cyt-C蛋白表達明顯下調(P<0.05)。與正常對照組比較,N-CM組細胞Caspase-3、Bax及Bcl-2蛋白表達無明顯變化(P>0.05);與N-CM組比較,H-CM組細胞Caspase-3和Bax蛋白表達上調(P<0.01),Bcl-2蛋白表達下調(P<0.01);與H-CM組比較,T-CM組細胞Caspase-3和Bax蛋白表達下調(P<0.05,P<0.01),Bcl-2蛋白表達上調(P<0.01)。
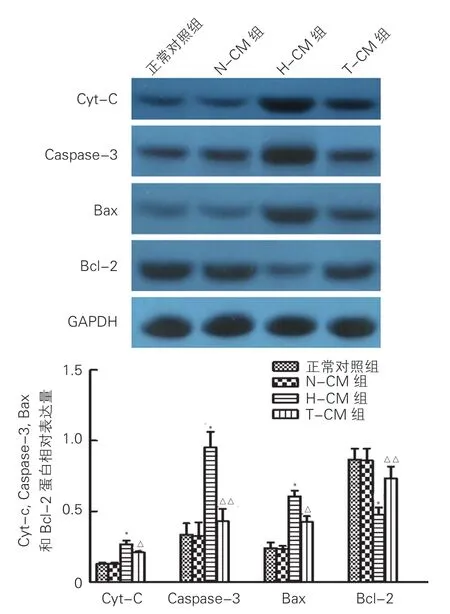
注: N-CM:正常微血管內皮細胞條件培養液;H-CM:同型半胱氨酸誘導損傷的微血管內皮細胞條件培養液;T-CM:通心絡干預的微血管內皮細胞條件培養液。Cyt-C: 細胞色素-C; Caspase-3: 半胱氨酸天冬氨酸蛋白酶-3;Bax: B細胞白血病淋巴瘤-2相關蛋白; Bcl-2: B細胞白血病/淋巴瘤2;GAPDH: 甘油醛-3-磷酸脫氫酶。與N-CM組比較*P<0.01; 與H-CM組比較 △P<0.05 △△P<0.01
3 討論
采用活細胞成像系統進行細胞和基因的功能研究,是生物醫學研究的最新趨勢。固定細胞觀察僅能提供固定瞬間細胞的靜態信息,活細胞成像系統可連續、全面、動態觀察顯微鏡下活細胞的正常生理活動過程。本研究采用活細胞成像系統動態觀察H9c2心肌細胞凋亡過程,結果顯示,正常對照組和N-CM組細胞僅少量細胞凋亡,而H-CM組細胞5 h即出現凋亡,5~15 h小時過程中細胞凋亡明顯;T-CM組細胞5 h未出現明顯的細胞凋亡,5~15 h雖有細胞凋亡,但較H-CM組明顯減少。說明通心絡干預心肌微血管內皮細胞后,可有效抑制心肌細胞的凋亡。
細胞凋亡是細胞為了維持自身內環境穩態而由凋亡調控蛋白控制的細胞程序性死亡。這些調控蛋白分為兩類,即促凋亡蛋白和抗凋亡蛋白,這兩類蛋白之間的平衡喪失可導致細胞凋亡。Bcl-2是抗凋亡調控蛋白之一[11],在凋亡信號刺激下起到關鍵的抗凋亡作用[12]。Bax是促凋亡調控蛋白之一,正常生理情況下以非激活的單體形式存在于細胞漿中,各類刺激信號的誘導下,Bax發生構象變化而聚集到線粒體上,這是線粒體凋亡途徑中的關鍵事件。半胱天冬酶(Caspases)是哺乳動物細胞中凋亡的啟動者和執行者,在細胞內通常以無活性的酶原形式存在,其中Caspase-3是Caspases級聯反應下游最關鍵的促凋亡蛋白。Bcl-2是通過抑制Cyt-C的釋放進而阻斷其上游Caspase蛋白酶活化,可抑制細胞的凋亡[13]。Bax為線粒體膜上離子通道的組成蛋白,使Cyt-C得以穿過線粒體膜,通過激活Caspase-9,進一步激活Caspase-3,最終導致細胞凋亡[14]。本研究中H-CM組較N-CM組細胞Bax和Caspase-3蛋白表達明顯上調,Bcl-2蛋白表達明顯下調,說明受損的RCMECs上清液引起了H9c2心肌細胞的凋亡;T-CM組較H-CM組細胞Bax和Caspase-3蛋白表達明顯下調,Bcl-2蛋白表達明顯上調,說明通心絡干預的RCMECs可有效抑制心肌細胞的凋亡。機體內存在外源性凋亡和內源性凋亡兩種途徑,后者則主要指線粒體凋亡途徑,又稱為“經典途徑”[15],是細胞凋亡的主要途徑之一,其中Bcl-2家族蛋白是關鍵調節蛋白。研究發現,Bcl-2家族能調節線粒體通透性轉換孔(mitochondrial permeability transition pore,mPTP)的開放[16],mPTP大量開放是引起細胞凋亡的始動因素[17]。本研究MMP、Cyt-C的結果顯示,H-CM組心肌細胞MMP下降,Cyt-C釋放增加;通心絡干預的RCMECs條件培養液抑制了線粒體的膜電位降低和Cyt-C釋放,說明通心絡改善內皮細胞分泌功能后可有效逆轉線粒體的損傷狀態。ROS是氧化還原反應的產物,線粒體不僅是ROS產生的主要位點更是ROS損傷的主要靶點。H-CM組心肌細胞中ROS生成增加,而T-CM組較H-CM組細胞ROS生成減少。因此可以推測通心絡干預的心肌微血管內皮細胞通過改善其分泌功能,使心肌細胞ROS生成減少,進而保護線粒體功能。所以本研究綜合線粒體功能檢測結果,可得出H-CM組細胞線粒體損傷,氧化應激的產生、Cyt-C、凋亡相關因子等的釋放,最終導致心肌細胞凋亡;T-CM組中細胞氧化應激減輕,線粒體功能和凋亡相關蛋白均有明顯改善,說明通心絡干預的RCMECs上清液通過保護線粒體、減少氧化應激抑制了H9c2心肌細胞的凋亡。然而本實驗也存在一定的局限性,在收取RCMECs條件培養液之前雖然用DMEM清洗細胞兩次,然后再加入DMEM置于培養箱中繼續培養6 h,收集各組細胞上清液,離心取上清,獲得四種RCMECs條件培養液,但仍不能排除條件培養液中殘存少量同型半胱氨酸或通心絡對心肌細胞凋亡或保護的直接作用,所以在后續的實驗中力爭排除此干擾因素,得到更精準的實驗數據。
[1]Brutsaert DL. Cardiac endothelial-myocardial signaling: its role in cardiac growth, contractile performance, and rhythmicity[J]. Physiol Rev, 2003, 83(1): 59-115. DOI: 10. 1152/physrev. 00017. 2002.
[2]Li XD, Yang YJ, Geng YJ, et al. Tongxinluo reduces myocardial no-reflow and ischemia-reperfusion injury by stimulating the phosphorylation of eNOS via the PKA pathway[J]. Am J Physiol Heart Circ Physiol. 2010, 299(4): H1255-H1261. DOI: 10. 1152/ajpheart.00459. 2010.
[3]Cheng YT, Yang YJ, Zhang HT, et al. Pretreatment with Tongxinluo protects porcine myocardium from ischaemia/reperfusion injury through a nitric oxide related mechanism[J]. Chin Med J(Engl), 2009,122(13): 1529-1538. DOI: 10. 3760/cma. j. issn. 0366-6999. 2009.13. 011.
[4]單兆偉, 劉沈林, 黃峻. 內科多發病中西醫綜合治療[M]. 北京: 人民衛生出版社, 2003: 143.
[5]Bergmann MW, Rechner C, Freund C, et al. Statins inhibit reoxygenation-induced cardiomyocyte apoptosis: role for glycogen synthase kinase 3beta and transcription factor beta-catenin[J]. J Molec Cell Cardio, 2004, 37(3): 681-690. DOI: 10. 1016/j. yjmcc. 2004. 05.025.
[6]Nishida M, Carley WW, Gerritsen ME, et al. Isolation and characterization of human and rat cardiac microvascular endothelial cells[J]. Am J Physiol, 1993, 264(2 Pt 2): H639-H652. DOI: 10. 1152/ajpheart. 1993. 264. 2. H639.
[7]位庚, 劉紅利, 李紅蓉, 等. 通心絡對同型半胱氨酸誘導大鼠心肌微血管內皮細胞損傷干預作用及氧化應激機制研究[J]. 中國循環雜志, 2016, 31(9): 908-912. DOI: 10. 3969/j. issn. 1000-3614. 2016.09. 019.
[8]龐潔, 梁俊清, 王志鑫, 等. 津力達聯合通心絡對高糖誘導胰島微血管內皮細胞損傷干預作用及機制研究[J]. 中國藥理學通報,2015, 31(3): 430-435. DOI: 10. 3969/j. issn. 1001-1978. 2015. 03.27.
[9]姜其鈞, 龔志剛, 李志剛. 乙醛脫氫酶2調節內皮祖細胞氧化應激反應的機制[J]. 中國循環雜志, 2016, 31(5): 502-507. DOI: 10.3969/j. issn. 1000-3614. 2016. 05. 020.
[10]劉紅利. 以脈絡學說為指導探討內皮細胞損傷對AS發病影響及通心絡干預作用研究[D]. 南京: 南京中醫藥大學, 2016.
[11]Martinou JC, Youle RJ. Mitochondria in apoptosis: Bcl-2 family members and mitochondrial dynamics[J]. Dev Cell, 2011, 21(1):92~101. DOI: 10. 1016/j. devcel. 2011. 06. 017.
[12]Babu PP, Suzuki G, Ono Y, et al. Attenuation of ischemia and/or reperfusion injury during myocardial infarction using mild hypothermia in rats: an immunohistochemical study of Bcl-2, Bax, Bak and TUNEL[J]. Pathol Int, 2004, 54(12): 896~903. DOI: 10. 1111/j. 1440-1827. 2004. 01767. x.
[13]Voutsadakis IA. Apoptosis and the pathogenesis of lymphoma[J]. Acta Oncol, 2000, 39(2): 151~156. DOI: 10. 1080/028418600430707.
[14]Schon EA, Manfredi G. Neuronal degeneration and mitochondrial dysfunction[J]. J Clin Invest, 2003, 111(3): 303~312. DOI: 10. 1172/JCI17741.
[15]Ji J, Tyurina YY, Tang M, et al. Mitochondrial injury after mechanical stretch of cortical neurons in vitro: biomarkers of apoptosis and selective peroxidation of anionic phospholipids[J]. J Neurotrauma,2012, 29(5): 776~788. DOI: 10. 1089/neu. 2010. 1602.
[16]Chen ST, Hsu JR, Hsu PC, et al. The retina as a novel in vivo model for studying the role of molecules of the Bcl-2 family in relation to MPTP neurotoxicity[J]. Neurochem Res, 2003, 28(6): 805~814. DOI:10. 1023/A: 1023298604347.
[17]Rasola A, Bernardi P. Mitochondrial permeability transition in Ca(2+)-dependent apoptosis and necrosis[J]. Cell Calcium, 2011, 50(3):222~233. DOI: 10. 1016/j. ceca. 2011. 04. 007.

