全人源化PD-L1單抗功能活性及其對人肺腺癌HCC827細胞毒性作用的研究
謝慶書,束 軍,陳晴晴, 胡思怡
程序性死亡受體1(programmed death receptor-1,PD-1)最初在1992年從鼠T細胞雜交瘤中分離出來[1],屬于CD28分子家族,表達在活化的T細胞、B細胞、單核細胞和樹突狀細胞表面。PD-1有兩個已知的配體,包括程序性死亡配體-1(programmed death ligand-1,PD-L1)又稱B7-1或CD274和程序性死亡配體-2 (programmed death ligand-2,PD-L2)又稱B7-DC或CD273[2]。PD-L1屬于B7家族成員,為Ⅰ型跨膜蛋白,在正常情況下,PD-1/PD-L1通路通過負性調節(jié)免疫應答防止過度刺激和維持自身抗原的免疫耐受[3]。然而,PD-L1在腫瘤組織中的過表達,包括黑色素瘤、卵巢癌及非小細胞肺癌[4],導致腫瘤微環(huán)境中的免疫反應障礙。PD-1/PD-L1通路抑制T淋巴細胞增殖、減少細胞因子的釋放,并降低T淋巴細胞活性,導致腫瘤特異性T細胞耗竭和凋亡[5]。PD-L1抗體可以抑制PD-L1與受體PD-1的相互作用解除其免疫抑制,增強T細胞的細胞毒活性從而發(fā)揮抗腫瘤作用[6]。該研究從分子及細胞水平初步驗證自研PD-L1單抗的體外功能活性,為研究PD-L1類抗體提供新的思路。
1 材料與方法
1.1實驗材料
1.1.1細胞 人肺癌HCC827細胞株購自美國ATCC公司,中國倉鼠卵巢癌細胞DHO-DG44(DHFR缺陷)、中國倉鼠卵巢癌細胞CHO-PD-L1-TCR及急性T細胞白血病細胞Jurkat-PD1-NFAT由安徽安科生物工程股份有限公司技術研發(fā)中心實驗室饋贈。
1.1.2主要試劑 RPMI 1640培養(yǎng)基、DMEM培養(yǎng)基均購于美國Hyclone公司,胎牛血清購自美國Gibco公司,F(xiàn)icoll淋巴細胞分離液購自Biosharp 公司,G418硫酸鹽 (G418 sulfate)及潮霉素B (hygromycin B,Hg)購自上海生工生物工程股份有限公司,生物素標記的人PD-L1(Bio-hPD-L1)、人PD-1與鼠Fc的嵌合體(hPD-1-mFc)[7]突變體由安徽安科生物工程股份有限公司自行研制,異硫氰酸熒光素(FITC)標記的山羊抗人IgG1購自美國Sigma公司,F(xiàn)ITC標記的山羊抗鼠IgG1購自美國Jackson公司,辣根過氧化物酶(HRP)標記山羊抗人IgG1 二抗、HRP標記鏈酶親和素(簡稱SA-HRP)購自Thermo公司,熒光素酶試劑盒購于美國Promega 公司,ExpressPlusTM預制膠購自金斯瑞生物科技公司。以羅氏公開的PD-L1抗體Atezolizumab序列為參考,安徽安科生物工程(集團)股份有限公司自行構建未糖基化的IgG1亞型的PD-L1抗體(為方便描述簡稱阿特朱單抗),自研全人源化PD-L1單抗由安徽安科生物工程(集團)股份有限公司饋贈(簡稱自研PD-L1單抗)。
1.1.3主要儀器 FLX800UV熒光分析儀購于美國Biotek公司,超凈工作臺購于蘇州安泰空氣技術有限公司,CO2培養(yǎng)箱購自美國Thermo公司,流式細胞儀購自美國Beckman 公司。
1.2實驗方法
1.2.1細胞培養(yǎng) HCC827細胞用含10%胎牛血清的RPMI1640培養(yǎng); Jurkat-PD1-NFAT、CHO-PD-L1-TCR細胞分別用含有0.5 mg/ml G418和0.1 mg/ml Hg加壓的Ham's F12和RPMI1640培養(yǎng)基培養(yǎng),細胞生長匯合度達到80%~90%時,消化傳代培養(yǎng),37 ℃、5% CO2培養(yǎng)箱內常規(guī)傳代培養(yǎng)。
1.2.2十二烷基硫酸鈉聚丙烯凝膠電泳(SDS-PAGE)鑒定兩抗體純度 轉染PD-L1的CHO-DG44 細胞的上清液中含抗體,經過濾、提純、12%ExpressPlusTM預制膠凝膠電泳、考馬斯亮藍染色。
1.2.3ELISA法測定兩抗體的結合活性及阻斷活性 緩沖液分別稀釋hPD-L1及hPD-1-mFc鋪板,100 μl/孔4 ℃冰箱鋪板過夜。TPBS(含0.1% Tween20的PBS)洗滌3次,封閉劑37 ℃烘箱封閉1 h。TPBS洗滌3次,結合:封閉劑分別稀釋兩抗體使?jié)舛?1 μg/ml, 3倍稀釋,依次稀釋8個梯度,100 μl/孔;阻斷:稀釋后的兩抗體(8 μg/ml開始,4倍稀釋)分別與Bio-hPD-L1(終濃度為50 ng/ml)預混,向96孔板加入100 μl/孔,室溫震蕩孵育1 h。TPBS洗3次,分別加封閉劑稀釋的HRP-羊抗人Fc、HRP-羊抗鼠Fc二抗 100 μl/孔,室溫震蕩孵育30 min。TPBS洗3次,加入OPD顯色、終止、酶標儀測定490 nm吸光值,每次實驗均重復3次。
1.2.4細胞阻斷實驗測定兩抗體的阻斷活性 取對數(shù)生長期的CHO-PD-L1-TCR細胞(5×105/ml)接種于96孔板,其余孔加入等體積的PBS,CO2培養(yǎng)箱培養(yǎng)16~24 h。用含10% FBS的RPMI1640(理論buffer)培養(yǎng)基稀釋抗體使終濃度為100 μg/ml,3倍梯度稀釋,濃度依次為100.00、33.33、11.11、3.70、1.23、0.41、0.05、0.02、0.00 μg/ml。取對數(shù)生長期的Jurkat-PD1-NFAT細胞,計數(shù)、離心后用理論Buffer重懸調整細胞濃度為6.25×105/ml。棄96孔板中細胞培養(yǎng)上清液,分別加入稀釋后自研PD-L1單抗、阿特朱單抗,其余孔加等體積PBS,室溫孵育20 min后,向96孔板中加入Jurkat-PD1-NFAT,其余孔加入等體積的PBS,CO2培養(yǎng)箱中培養(yǎng)6 h后每孔加入熒光酶底物Bio-GloTMReagent,37 ℃烘箱孵育10 min后FLX800UV酶標儀上機檢測其相對光單位(RLU),實驗重復3次。RLU標化值=實驗組相對光單位/對照組相對光單位。
1.2.5流式細胞儀檢測HCC827細胞PD-L1的表達 收集 HCC827細胞5×105個,分對照組(抗體為0)和實驗組,用含1%牛血清白蛋白(BSA)的PBS封閉后,加入自研PD-L1單抗(10、1、0.1、0.01 μg/ml),冰上孵育30 min,封閉液洗滌2次后,再加入FITC-羊抗人IgG二抗,重復上述洗滌3次后上流式細胞儀檢測。
1.2.6細胞毒性試劑盒檢測抗體ADCC效應 取對數(shù)生長期的HCC827細胞用5%FBS的無酚紅RPMI1640調整細胞濃度為1×105/ml接種于圓底96孔板,每孔50 μl。自研PD-L1單抗、阿特朱單抗用培養(yǎng)基稀釋至終濃度為1 μg/ml,4倍梯度稀釋,共9個梯度,每孔加入50 μl。將昨日提取的等體積的人外周血單個核細胞(human peripheral blood mononuclear cells, PBMCs)(2×106/ml),每孔加入50 μl,6 000 r/min離心4 min,37 ℃、5% CO2的培養(yǎng)箱中培養(yǎng)5 h后,6 000 r/min離心板子4 min,取50 μl上清液至新的96孔板。每孔加入顯色試劑50 μl,室溫避光顯色30 min,酶標儀測量490 nm吸光值。靶細胞組:設置3個復孔,每孔加入上述濃度的HCC 827細胞50 μl,然后用培養(yǎng)基調節(jié)體積為150 μl;靶細胞最大裂解組:設置3個復孔,每孔加入上述濃度的HCC 827細胞50 μl,收集上清液之前15 min加入細胞裂解液,使之充分裂解;效靶細胞組:設置3個復孔,為未加入抗體,用等體積的培養(yǎng)基替代。細胞裂解率=OD(實驗組-效靶細胞組)/OD(靶細胞最大裂解組-靶細胞組)。
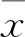
2 結果
2.1兩抗體SDS-PAGE電泳分析轉染PD-L1的CHO-DG44細胞,其培養(yǎng)上清液經過過濾、提純后, SDS-PAGE分析結果顯示,阿特朱單抗與自研PD-L1抗體經過二硫蘇糖醇(DTT)還原后,由分別是45、20 ku輕重鏈組成,與分子為130 ku的未還原型阿特珠單抗及自研PD-L1單抗相符,見圖1。

圖1 阿特朱單抗及自研PD-L1抗體凝膠電泳分析
M:marker;A~D分別為未還原型阿特朱單抗、自研PD-L1單抗;還原型阿特朱單抗、自研PD-L1單抗
2.2ELISA實驗中兩抗體的結合與阻斷活性結果表明阿特朱單抗及自研PD-L1單抗均可以與hPD-L1結合,EC50分別為7.88 ng/ml、18.86 ng/ml(圖2A)。兩者均可以競爭性阻斷hPD-L1與hPD-1-mFc的結合,IC50分別為56.28 ng/ml和190.70 ng/ml(圖2B)。自研PD-L1單抗的結合和阻斷活性稍弱于阿特朱單抗。
2.3細胞阻斷實驗中兩抗體的阻斷活性利用基因工程改造的兩個細胞株:CHO-PD-L1-TCR細胞分別為穩(wěn)定表達PD-L1和TCR激活劑,Jurkat-PD-1-NFAT細胞含熒光素酶驅動基因NFAT并表達PD-1。當兩個細胞共培養(yǎng)時,Jurkat-PD-1-NFAT細胞表面的TCR被CHO細胞表面的TCR激活劑激活,熒光素酶基因表達,但兩細胞表面PD-L1與PD-1的結合阻斷TCR信號,導致熒光素酶活性減弱。PD-L1抗體可以阻斷PD-L1/PD-1抑制通路,導致TCR信號及下游熒光素酶活化。細胞阻斷試驗結果表明,阿特朱單抗及自研PD-L1單抗均可阻斷兩細胞表面PD-L1與PD-1的結合,EC50分別為0.154 8 μg/ml和0.208 5 μg/ml。如圖3所示,阿特朱單抗及自研PD-L1單抗從低濃度(0 μg/ml)到高濃度(100 μg/ml)對應的RLU標化值用均數(shù)±標準差表示,兩抗體在相同濃度下利用兩獨立樣本t檢驗進行兩兩比較,各濃度組差異均無統(tǒng)計學意義。兩個抗體EC50沒有明顯差異,劑量效應呈S型曲線關系。
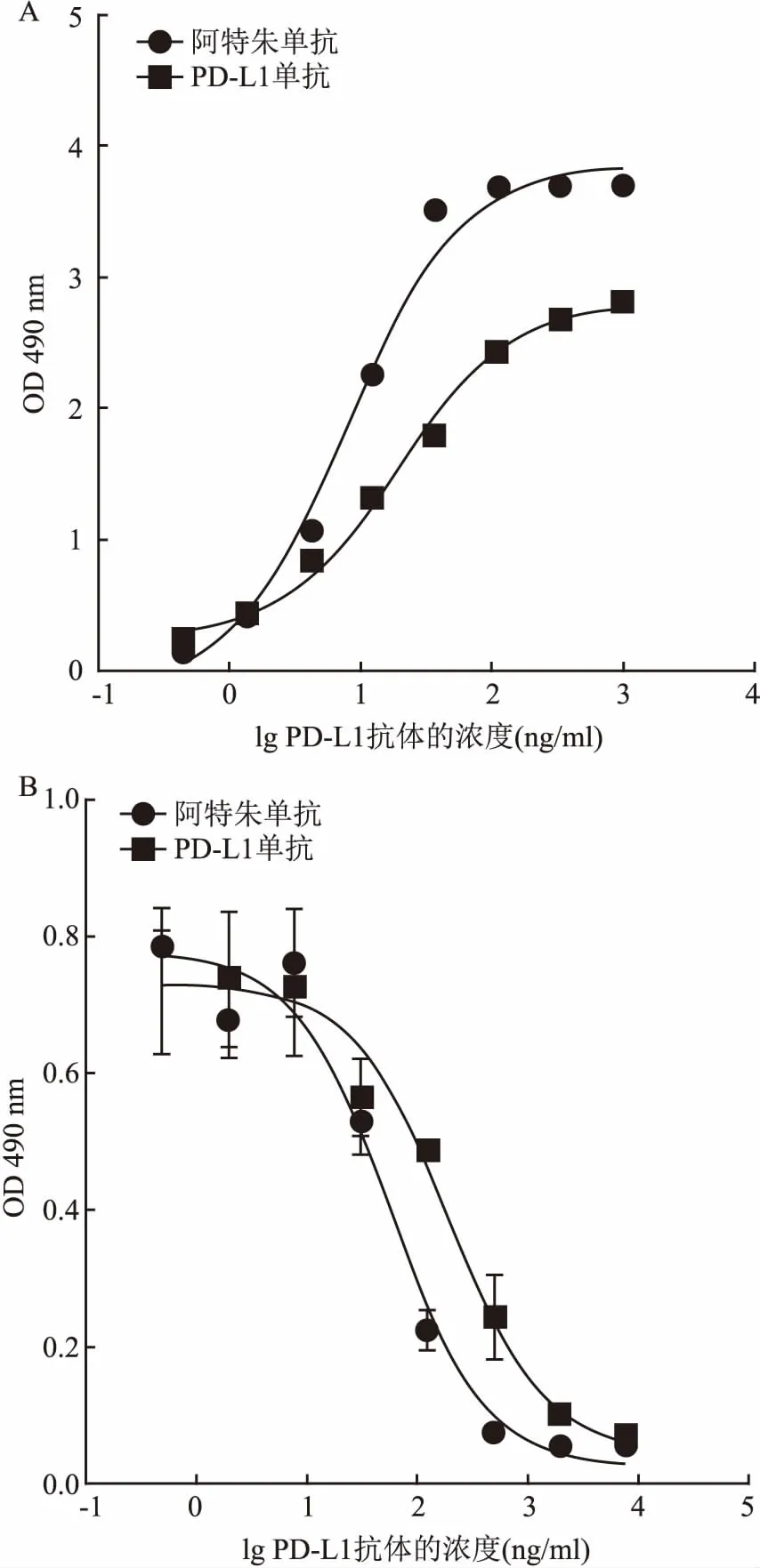
圖2 不同濃度阿特朱單抗及自研PD-L1單抗與hPD-L1的結合及兩抗體阻斷hPD-L1與PD-mFc結合
A:阿特朱單抗及PD-L1單抗的結合活性;B:阿特朱單抗及PD-L1單抗的阻斷活性

圖3 不同濃度阿特朱單抗及自研PD-L1單抗阻斷兩細胞表面PD-L1與PD-1的結合
2.4FACS測定人肺腺癌HCC827細胞表面PD-L1的表達以自研PD-L1單抗作為一抗,檢測結果表明,在一定濃度范圍內隨著抗體濃度增加,熒光強度逐漸增加。表明肺腺癌HCC827細胞高表達PD-L1,自研PD-L1抗體與腫瘤細胞表面PD-L1抗原分子有特異結合,見圖4。
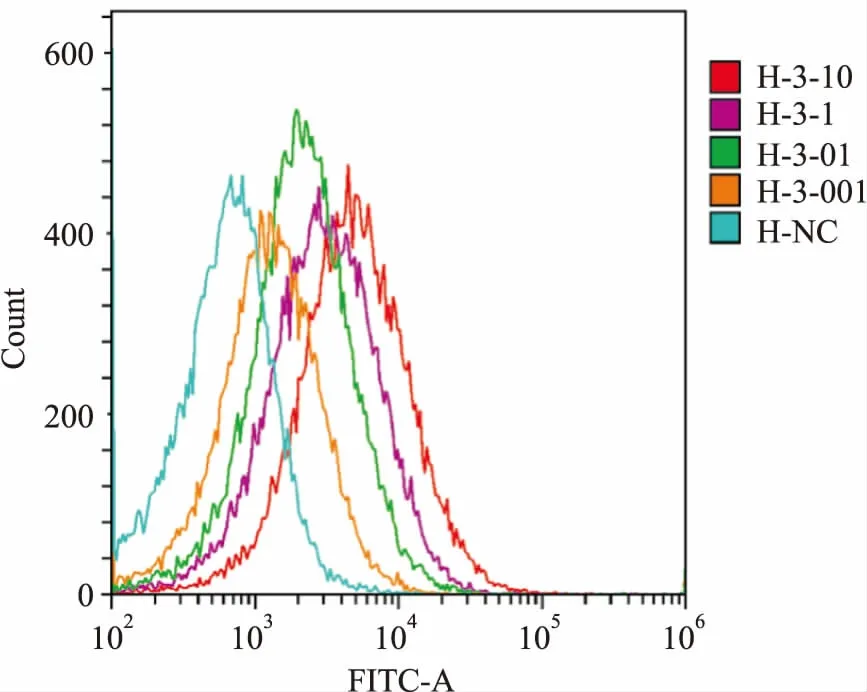
圖4 HCC827細胞表面PD-L1的表達
H-NC:陰性對照;H-3-10、H-3-1、H-3-0.1、H-3-001分別指10、1、0.1、0.01 μg/ml自研PD-L1抗體對應的熒光強度
2.5細胞毒性試驗中兩抗體對HCC827的毒性作用效應細胞與靶細胞比值為20 ∶1時,阿特朱單抗及自研PD-L1單抗均可以介導人外周血單個核細胞對人肺腺癌HCC827細胞的殺傷活性,即有ADCC效應,并隨著抗體濃度增加,殺傷活性增強,呈S型劑量效應曲線。利用單因素方差分析,分別比較自研PD-L1抗體各組(包括對照組即未加抗體組)細胞裂解率,各組之間差異有統(tǒng)計學意義(F=146.234,P=0.000),利用單因素方差分析比較阿特朱單抗各實驗組之間裂解率,差異有統(tǒng)計學意義(F=196.235,P=0.000)。利用Graphpad Prism 6軟件以抗體濃度對數(shù)為x軸,細胞溶解率為y軸(圖5),自研PD-L1及阿特朱單抗的EC50分別為1.791 ng/ml和1.033 ng/ml。
3 討論
在各種類型的癌癥患者中,肺癌是導致患者死亡的主要原因之一,其中非小細胞肺癌占肺癌總數(shù)的85%, 5年生存率不到15%[8]。以鉑類藥物為基礎的雙藥聯(lián)合化療是未提示基因突變或者易位的晚期非小細胞肺癌的一線治療[9],反應率僅有15%~30%[10]。雖然肺癌患者有一部分亞群由特異性驅動基因的變異引起,通過分子靶向療法一定程度可以提高患者中位生存期,然而肺癌治療仍受限。過去人們認為肺癌是無免疫原性的腫瘤[11],然而近年來免疫治療特別是針對免疫檢查點抑制劑相關的抗體使肺癌患者獲益。2015年、2016年分別針對PD-1、PD-L1的抗體:納武單抗(novolumab)、派姆單抗(pembrolizumab)和阿特朱單抗被批準用于非小細胞肺癌的治療。例如羅氏的阿特朱單抗被批準用于鉑類為基礎的初始化療失敗或進展的轉移性非小細胞肺癌的二線治療[12]。
圖5 阿特朱單抗及自研PD-L1單抗介導人PBMCs對HCC827的毒性作用
PD-L1不僅可以和PD-1結合,也可以與CD80結合,而靶向PD-L1的抗體是通過阻斷PD-L1與PD-1的結合而間接發(fā)揮抗腫瘤作用的,本研究中ELISA實驗結果表明自研PD-L1單抗可以與hPD-L1結合,并且可以競爭性阻斷hPD-L1與hPD-1的結合。有研究[13]應用基因工程設計的高表達hPD-1和AP-1驅動的熒光素酶報告基因的Jurkat/AP-1-Luc/hPD-1 細胞和表達人CD20和hPD-L1的HEK293/hCD20/hPD-L1細胞檢測PD-1單抗REGN2810生物學活性。本研究用相似模型在細胞水平上進一步驗證自研PD-L1單抗可以阻斷兩細胞表面PD-L1與PD-1的結合,并且在一定程度上表明自研PD-L1單抗可以通過阻斷PD-L1/PD-1通路激活T細胞受體下游信號。
PD-L1在胃癌[14]、肺癌等多種腫瘤中高表達,胃癌組織中PD-L1的高表達與TNM分期及淋巴結轉移等臨床病理特征相關,提示靶向PD-L1抗體可作為肺癌潛在治療方法。PD-L1抗體不僅可以通過抑制PD-L1/PD-1通路發(fā)揮抗腫瘤作用,ADCC效應也可以發(fā)揮抗腫瘤作用。因此,本研究細胞毒性實驗表明自研PD-L1單抗及阿特朱單抗均有ADCC效應,對肺癌細胞HCC827有相似的毒性作用。雖然研究[15]顯示運用來自同一供體的從外周血單個核細胞提取的NK細胞與人PBMCs相比較,純化的NK細胞與Bavencio(Avelumab)能夠產生更大的溶解活性,實驗中以人PBMCs作為效應細胞驗證也是可行的。
綜上所述,該自研PD-L1單抗在體外有一定的功能活性,能夠介導人外周血單個核細胞對人肺腺癌HCC827細胞產生毒性作用。以往被批準PD-L1單抗大多是從雜交瘤細胞獲得,生產成本高并且雜交瘤細胞基因穩(wěn)定性不易維持,有免疫原性。該自研抗體是從全人源噬菌體抗體庫篩選和改造的,推測具有相對較低的免疫原性,然而本實驗有一定的局限性,在動物和臨床上的應用還有待進一步驗證。
[1] Ishida Y,Agata Y,Shibahara K,et al. Induced expression of PD-1,a novel member of the immunoglobulin gene superfamily,upon programmed cell death [J]. EMBO J,1992,11(11):3887-95.
[2] Ceeraz S, Nowak E C, Noelle R J. B7 family checkpoint regulators in immune regulation and disease [J].Trends Immunol,2013,34( 11) : 556-63.
[3] Riella L V, Paterson A M, Sharpe A H,et al. Role of the PD-1 pathway in the immune response[J]. Am J Transplant,2012, 12(10):2575-87.
[4] Iwai Y, Ishida M, Tanaka Y, et al. Involvement of PD-L1 on tumor cells in the escape from host immune system and tumor immunotherapy by PD-L1 blockade[J]. Proc Natl Acad Sci U S A,2002,99(19):12293-7.
[5] Wherry E J. T cell exhaustion[J]. Nat Immunol,2011,12(6):492-9.
[6] Blank C, Kuball J, Voelkl S, et al. Blockade of PD-L1 (B7-H1) augments human tumor-specific T cell responses in vitro[J]. Int J Cancer, 2006, 119(2):317-27.
[7] Maute R L, Gordon S R, Mayer A T, et al. Engineering high-affinity PD-1 variants for optimized immunotherapy and immuno-PET imaging[J]. Proc Natl Acad Sci U S A,2015 ,112(47): E6506-14.
[8] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013,63(1):11-30.
[9] Aisner D L, Marshall C B. Molecular pathology of non small cell lung cancer: a practical guide[J]. Am J Clin Pathol, 2012,138(3):332-46.
[10] Schiller J H, Harrington D, Belani C P, et al. Comparison of four chemotherapy regimens for advanced non small cell lung cancer[J]. N Engl J Med ,2002,346(2):92-8.
[11] Holt G E, Podack E R, Raez L E. Immunotherapy as a strategy for the treatment of non-small-cell lung cancer[J]. Therapy,2011, 8(1):43-54.
[12] Weinstock C, Khozin S, Suzman D, et al. U.S. Food and Drug Administration approval summary: Atezolizumab for metastatic non-small cell lung cancer[J]. Clin Cancer Res,2017,23(16):4534-9.
[13] Burova E, Hermann A, Waite J,et al. Characterization of the anti-PD-1 antibody REGN2810 and its antitumor activity in human PD-1 knock-in mice[J]. Mol Cancer Ther,2017,16(5):861-70.
[14] 吳 圣,邵婧怡,王 芳,等. PD - L1 和 PD - 1 在胃癌組織中的表達及其臨床意義[J].安徽醫(yī)科大學學報,2015,50(6):821-4.
[15] Boyerinas B, Jochems C, Fantini M, et al. Antibody-dependent cellular cytotoxicity activity of a novel anti-PD-L1 antibody Avelumab (MSB0010718C) on human tumor cells[J]. Cancer Immunol Res,2015,3(10):1148-57.

