人血漿脂蛋白相關磷脂酶A2和腦梗死患者頸動脈斑塊穩定性之間的關聯
馮文清 石彥彥 吳保鑫 張孝良
腦梗死(CI)又稱為缺血性腦卒中(cerebral ischemic stroke, CIS),是因多種因素引起患者腦部血液循環障礙引發缺血缺氧,從而導致腦組織局限性缺血性壞死或軟化,并導致相應神經功能缺損的疾病[1]。CI與心血管及腫瘤屬于人類疾病死亡的三大原因[2],可占到腦血管疾病的70%以上[3]。動脈粥樣硬化(Atherosclerosis, AS)是腦梗死的病理生理學基礎,AS已被證實是慢性炎癥過程,炎癥反應參與了AS斑塊的形成、發展以及穩定性喪失、破潰、脫落的各個階段,因此對AS斑塊的穩定性及時識別并盡早開展治療會大大降低CI的發生率[4]。人血漿脂蛋白相關磷脂酶(Lp-PLA2)是一種貫穿在AS形成過程中的炎性標志物,并對動脈粥樣硬化有促動作用。本研究旨在探討Lp-PLA2與頸動脈斑塊穩定性的關系,現報道如下。
1 資料與方法
1.1一般資料收集2015年12月~2016年12月,本院收入的存在頸動脈斑塊CI患者102例,據頸動脈彩超將其分為不穩定型斑塊組(54例)、穩定型斑塊組(48例),所有患者均符合CI診斷標準(經MRI及CT檢查確診)。無頸動脈斑塊的健康人群作為對照組(46例)(表1)。

表1 3組基線資料比較
1.2標本采集、檢測腦梗死患者入院后清晨抽空腹靜脈血3~5 mL,離心15 min(2500~3000 r/min),取上清置入EP管中,零下80 ℃冰箱中備存,并對同期46名體檢健康者按同樣方法進行樣本采集;標本均采用ELISA法對Lp-PLA2的水平進行檢測,并對所有入組人員的血脂指標水平進行檢測(血脂指標包括HDL-C、TC、LDL-C、TG),同時檢測C反應蛋白(Hs-crp)及白細胞(WBC)水平。
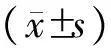
2 結 果
2.1CI患者的Lp-PLA2水平顯著高于對照組(P=0.001),且不穩定型斑塊組水平比穩定型斑塊組要高(P<0.0001)(表2)。
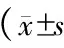
表2 3組Lp-PLA2水平比較, μg/L)
注:與對照組比較,*P<0.01;與穩定型斑塊組比較,△P<0.0001
2.23組血脂水平比較CI患者的TC、LDL-C、TG水平高于對照組,且不穩定型斑塊組水平比穩定型斑塊組要高(P=0.0089);CI患者的HDL-C水平低于對照組,且不穩定型斑塊組水平比穩定型斑塊組低(P=0.0043)(表3)。
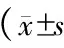
表3 3組血脂水平比較, mmol/L)
注:與穩定型斑塊組比較,*P<0.01
2.3對影響斑塊穩定性因素的Logistic回歸分析以斑塊穩定為自變量,性別、年齡、Lp-PLA2水平、Hs-CRP水平、吸煙、白細胞數(WBC)及高血壓病為因變量,回歸分析顯示Lp-PLA2(OR=7.556)是影響斑塊穩定的獨立危險因素(P=0.004)(表4)。

表4 斑塊穩定性影響因素的Logistic回歸分析
2.4Lp-PLA2的ROC曲線分析Lp-PLA2水平預測斑塊穩定性的ROC曲線下面積為0.936(P<0.05),其臨界值為56.75 μg/L時,靈敏度為76.5%,特異度為83.7%(圖1)。

圖1 Lp?PLA2的ROC曲線
3 討 論
AS貫穿于動脈粥樣硬化斑塊形成的各個階段,由于在破裂的斑塊中炎性細胞較多,因此血清中炎性因子的水平可反映動脈粥樣硬化斑塊的穩定性,并可評估缺血性腦卒中的風險[5]。
Lp-PLA2是水解磷脂酶超家族的一員,人體中成熟的巨噬細胞、單核細胞等其它炎性細胞合成和分泌Lp-PLA2,血小板活化因子對Lp-PLA2的分泌具有促進作用。Lp-PLA2在人體內對血管內膜的氧化型低密度脂蛋白(Ox-LDL)產生水解作用,生成氧化型游離脂肪酸(ox-FFA)和溶血卵磷脂(lyso-PC),(lyso-PC)及ox-FFA對炎癥有促進作用,可促進動脈發生斑塊粥樣硬化[6]。Lp-PLA2可以刺激機體產生大量的細胞因子,導致單核細胞進一步的蓄積并演變為巨噬細胞,攝入Ox-LDL,產生泡沫細胞,泡沫細胞聚集成動脈粥樣硬化斑塊,并引起血管舒縮功能障礙,損害血管內皮細胞,形成AS斑塊,脆弱的斑塊破裂易致血栓形成;同時巨噬細胞對Lp-PLA2有反饋調節作用,誘導產生更多的Lp-PLA2,因此形成惡性循環,促使動脈粥樣硬化進展。Lp-PLA2通過釋放蛋白酶,對纖維帽產生降解作用,使斑塊破裂,影響斑塊的穩定性[7]。一項通過對Lp-PLA2蛋白質表達水平的研究發現,在脆弱易破裂斑塊的壞死中心及周圍的巨噬細胞中Lp-PLA2表達顯著增加,而那些進展緩慢的斑塊中表達較少[8]。亦可見Lp-PLA2在加速斑塊不穩定性方面具有潛在的作用。國內外亦有許多流行病學和臨床前瞻性研究提示,人血漿Lp-PLA2水平、活性與心腦血管疾病風險呈正相關,認為血漿Lp-PLA2水平、活性升高是缺血性腦卒中和心血管事件的獨立危險因素[9 10 11]。
本研究發現不穩定型斑塊組的血漿Lp-PLA2水平高于穩定型斑塊組,而2組Lp-PLA2水平均高于對照組。由此可見Lp-PLA2是一種與動脈粥樣硬化斑塊形成有關的新的炎性標志物,而且可能直接參與AS形成。
綜上所述,CI患者Lp-PLA2水平的波動能夠反映頸動脈粥樣硬化的嚴重程度,具有促進AS形成和致斑塊不穩定的作用,可作為斑塊的炎性新標志物。
[1]牟方波,郭鵬,盧正海.急性腦梗死的中西醫研究進展[J].中西醫結合心腦血管病雜志,2010,8(2):220-223.
[2]王偉,韓永升,韓詠竹,等.缺血性腦血管病的中西醫治療研究進展[J].中醫藥臨床雜志,2015,27(2):283-286.
[3]宗學莉,金偉,劉郅紅.尤瑞克林注射劑治療腦梗死早期療效觀察[J].中國實用醫藥,2011,6(16):152.
[4]李召晨,杜瑞艷,王洪娟,等.頸動脈粥樣硬化與急性腦梗死關系的研究[J].中國現代醫學雜志,2013,23(6):89-93.
[5]Zhou Q,Bea F,Preusch M,et al.Evaluation of plaque stability of advanced atherosclerotic lesions in apo E-deficient mice after treatment with the oral factor Xa inhibitor rivaroxaban[J].Mediators Inflamm,2011(6):432080.
[6]趙穎,董天崴,李海濤,等.脂蛋白相關磷脂酶A2的研究進展[J].心血管康復醫學雜志,2011,20(6):599-601.
[7]Shishkina VS,Toklueva LR,Kashirina SV,et al. Comparison of morphological features of carotid arteries atherosclerotic plaques with clinical-instrumental data in symptomatic and asymptomatic patients with severe carotid atherosclerosis [J].Kardiologiia,2013,53(4):25-31.
[8]Kolodgie FD,Burke AP,Skorija KS,et al.Lipoprotein-associated phospholipase A2 protein expression in the natural progression of human coronary atherosclerosis[J].Arterioscler Thromb Vasc Biol,2006,26(11):2523-2529.
[9]Winkler K,Winkelmann BR,Scharnagl H,et al.Platelet-activating factor acetylhydrolase activity indicates angiographic coronary artery disease independently of systemic inflammation and other risk factors: the Ludwigshafen Risk and Cardiovascular Health Study[J].Circulation,2005,111(8):980-987.
[10] Durrington P.HDL in risk prediction and its direct and indirect involvement in atherogenesis[J].Atheroscler Suppl,2002,3(4):3-12.
[11] O'donoghue M,Morrow DA,Sabatine MS,et al.Lipoprotein-associated phospholipase A2 and its association with cardiovascular outcomes in patients with acute coronary syndromes in the PROVE IT-TIMI 22 (PRavastatin Or atorVastatin Evaluation and Infection Therapy-Thrombolysis In Myocardial Infarction)[J].Circulation,2006,113(14):1745-1752.

