AChR抗體陽性重癥肌無力合并舌肌萎縮2例報道并文獻分析
操亞云 季蘇瓊 桂夢翠 林婧 卜碧濤
重癥肌無力(myasthenia gravis, MG)是一種由抗體介導、細胞免疫依賴、補體參與,累及神經-肌肉接頭突觸后膜,引起神經-肌肉接頭傳遞功能障礙的一種自身免疫性疾病,臨床上以骨骼肌無力、易疲勞、活動后加重、休息或使用膽堿酯酶抑制劑后癥狀緩解為主要表現,伴有肌肉萎縮者少見,單純伴舌肌萎縮者更罕見。本研究結合文獻資料和本院近期收治的2例AChR抗體陽性MG合并舌肌萎縮患者的診治過程,以探討MG患者舌肌萎縮的發病特點及萎縮機制,從而分析此2例AChR抗體陽性MG患者可能存在的肌肉萎縮機制。
1 臨床資料
病例1,患者,男,52歲,因“肌無力7年,吞咽困難、吐詞不清5個月”于2014年10月收入本科。患者7年前無明顯誘因出現雙眼瞼下垂、復視,無眼球活動障礙,伴全身輕度乏力,無呼吸及吞咽困難,上述癥狀有明顯疲勞現象,呈晨輕暮重表現,新斯的明試驗陽性,RNS低頻刺激波幅明顯遞減而診斷MGⅡa型,后行胸部CT發現胸腺異常,并于發病后半年行胸腺切除術,術后病理提示胸腺瘤B1型,免疫組化:CD3(++),CD20(-),AE1/AE3(+),TdT(+),CD30(-),此后患者長期口服膽堿酯酶抑制劑(溴吡斯的明180 mg/d)治療,癥狀基本控制,生活自理并可從事日常辦公室工作;5個月前患者又出現吞咽困難、言語不清及咳痰困難,門診調整口服藥物治療及加用激素(溴吡斯的明240 mg/d,強的松15 mg/d)后癥狀無好轉,而收入本科。
入院查體:雙眼瞼下垂,疲勞試驗(+),左側眼球外展活動受限,吐詞不清,飲水嗆咳,舌肌明顯萎縮(未同意拍照),面部肌肉輕度萎縮,無四肢肌肉萎縮,四肢肌力Ⅴ-級。入院后行胸部CT檢查示胸腺瘤切除術后改變,右肺中葉、左肺舌葉及雙肺下葉支氣管擴張伴感染性病變,縱膈多發小淋巴結,未發現胸腺瘤復發。入院后患者出現危象,AChR-ab滴度大于10 nmol/L(ELISA法,英國RSR公司試劑盒)。經氣管切開、呼吸機輔助呼吸、干涸療法、血漿置換、丙種球蛋白沖擊及激素續貫治療后癥狀好轉,后脫機、堵管成功出院。患者入院時發現舌肌萎縮,經過5個月住院期間的營養神經、改善神經-肌肉接頭功能、免疫治療等處理后,舌肌萎縮得到控制,出院時萎縮較入院時改善。在后續隨診過程中患者一直口服溴吡斯的明240 mg/d,他克莫司3 mg/d,強的松15 mg/d,肌無力癥狀控制穩定,生活恢復自理,可從事簡單的日常工作。
病例2,患者,女,47歲,因“肌無力26年,吞咽困難、吐詞含糊8 d”于2015年12月收入本科。患者26年前無明顯誘因出現雙眼瞼下垂、四肢無力,無復視,無呼吸及吞咽困難,上述癥狀有明顯疲勞現象,呈晨輕暮重表現,于外院行新斯的明試驗陽性,胸部CT示胸腺殘留,診斷MGⅡa型,長期口服膽堿酯酶抑制劑、激素、硫唑嘌呤(150 mg/d)治療,癥狀控制不理想,20多年來因癥狀加重有10次住院治療,曾3次發生危象;8 d前患者無明顯誘因出現癥狀加重,表現為眼瞼下垂、四肢無力、吞咽困難、吐詞含糊,伴飲水嗆咳,偶有胸悶氣短,而入住本科。
入院查體:右眼瞼下垂,疲勞試驗(+),眼球活動正常,吐詞稍不清,吞咽困難、飲水嗆咳,舌肌明顯萎縮(圖1),無面肌及四肢肌肉萎縮,四肢肌力Ⅳ+級。入院后行胸部CT檢查示右肺上葉及雙肺下葉斑片狀及磨玻璃樣影,考慮感染性病變;氣管內見環狀附壁影,考慮粘液可能;雙肺上葉增殖灶,右肺上葉多發小鈣化灶;右肺中葉小肺大泡;前縱隔軟組織密度灶,考慮為胸腺殘留。查AChR抗體>8.00 nmol/L(陽性)(ELISA法,英國RSR公司試劑盒)。入院后經血漿二重濾過、強的松20 mg/d、他克莫司3 mg/d等治療后癥狀好轉而出院。患者發現舌肌萎縮1年,經過強有力的免疫治療及營養神經、改善神經肌肉接頭功能等對癥治療后舌肌萎縮并未得到改善,仍呈緩慢進展性。在后續隨診過程中患者口服上述藥物,肌無力癥狀基本控制穩定,生活基本自理,但仍無法從事日常工作。
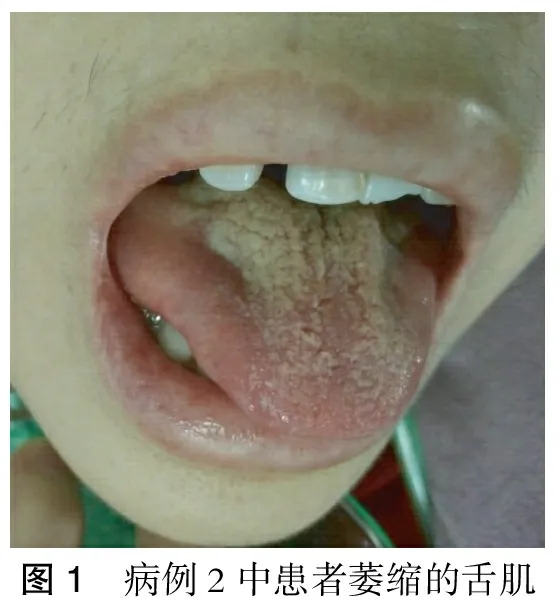
圖1 病例2中患者萎縮的舌肌
2 討 論
2.1臨床特點
本研究2例患者的萎縮舌肌呈三條縱溝現象(圖1),與文獻報道的MG舌肌萎縮呈典型 “三叉舌”[1]相符,并且與運動神經元病等引起的舌肌不規則萎縮明顯不同。
文獻報道MG患者中有5%~10%可出現肌肉萎縮,大多累及面肌、舌肌、咀嚼肌、頸肌,單獨累及四肢者少見,單獨累及舌肌者更罕見。在國內外報道中MG舌肌萎縮均不多見,故其萎縮的機制及其易累及舌肌的原因不詳,可能與舌肌的肌肉類型、收縮功能、代謝需要、神經-肌肉接頭對受體抗體的敏感度不同等有關。
抗體類型:MG舌肌萎縮雖可發生于AChR抗體陽性者,但大多見于MuSK抗體陽性者。MuSK抗體陽性肌肉萎縮除易累及面舌肌外,也易累及其他延髓肌、頸肌,病情往往較危重[2]。上述2例患者病情均較重,在正規的綜合治療下癥狀仍控制不佳,與上述特點相符,但2例患者AChR抗體均陽性(未行MuSK抗體檢測),為MG舌肌萎縮的更罕見情況。
病程的可逆性:病例1入院時發現舌肌萎縮,經過5個月住院期間的營養神經、改善神經-肌肉接頭功能、免疫治療等處理后舌肌萎縮得到控制,出院時萎縮較入院時改善。病例2發現舌肌萎縮1年,經過強有力的免疫治療及營養神經、改善神經肌肉接頭功能等對癥治療后舌肌萎縮并未得到改善,仍呈緩慢進展性。關于MG舌肌萎縮進程是否可逆,目前尚無定論。國內宋林、姜亞平等[3]人報道的2例MG舌肌萎縮患者經膽堿酯酶抑制劑、激素等治療后舌肌恢復飽滿。對于MuSK抗體陽性者的肌肉萎縮,Sanders等[4]人通過長期追蹤觀察,證實了萎縮的肌肉通過有效的免疫抑制劑治療可以逆轉,但對于AChR抗體陽性者肌肉萎縮是否可逆卻未見報道,可能與此類患者舌肌萎縮罕見有關,臨床上需大規模的隊列研究證實。
結合文獻資料本研究發現,MG舌肌萎縮除上述特點外,還可出現以下表現:(1)多為中青年女性;(2)除舌肌萎縮外,多伴延髓肌、咀嚼肌、近端肢體肌肉萎縮, MuSK抗體陽性者肌肉萎縮出現早于AChR抗體陽性者;(3)患者臨床癥狀偏重,對常規藥物治療效果往往不佳,預后較差;(4)多數患者可能存在未處理的胸腺疾病如胸腺瘤等。
2.2機制探索
肌肉萎縮是一個主動的過程,不論潛在的原因如何,都有其共同的分子通路機制[5],基因在其中起著決定性作用,已被發現的肌萎縮相關基因產物包括atrogin-1[6]和肌萎縮相關蛋白橫紋肌環指蛋白-1(MURF-1),有文獻指出其與MG肌肉萎縮有關[7]。
除了最根本的基因調控機制外,其他引起肌肉萎縮的可能機制包括(1)AChR抗體與受體結合,形成神經-肌肉接頭信息傳遞功能的阻滯,Szobor稱為“突觸間失神經作用”,引起神經源性肌萎縮[8];(2)各種免疫反應導致肌纖維破環,而引起肌源性萎縮;(3)長期類固醇激素治療引起類固醇肌病[9],Farrugia等[1]發現舌肌萎縮與激素劑量關系微弱,但與治療時間長短密切相關,若疾病初期、未使用激素便出現肌肉萎縮則多見于MuSK抗體陽性者,但仍有AChR陽性的個案報道[10];(4)廢用性肌萎縮;(5)合并其他自身免疫性疾病如肌炎等導致的肌肉萎縮;(6)與胸腺瘤相關的副腫瘤綜合征亦可引起肌萎縮[11]。
關于MG肌肉萎縮的病理學改變也存在爭議,主要分為神經源性改變和肌源性改變兩大類觀點,并且有學者發現MG患者舌肌萎縮和四肢肌肉萎縮的病理學改變也不盡相同。Brownell等[12]根據2例舌肌組織的病理改變,無炎性細胞浸潤,無吞噬和壞死,但出現了群組化,而推斷舌肌萎縮為神經源性肌萎縮。由于舌肌取材困難,尚未出現其他新的舌肌病理檢查的相關報道。但關于肢體肌肉活檢的病理結果卻呈現出不一樣的結果,且各自差異很大。Brownell等[12]尸檢組織中僅見單個肌纖維萎縮或局部淋巴細胞浸潤,Sanders等[13]的肌肉活檢提示類似發現,而Oosterhuis等[11]對10例MG患者肢體肌肉進行活檢,其中8例為神經源性改變,1例為Ⅱ型肌纖維萎縮,1例為淋巴細胞浸潤。在后續Martignago等[14]更細化的研究中根據AChR抗體、MuSK抗體分組,發現AChR抗體陽性者為神經源性改變,MuSK抗體陽性者呈肌源性改變并伴顯著的線粒體異常。由于眼肌及延髓支配的肌肉為高代謝肌群,這類肌肉細胞中有豐富的線粒體分布,MuSK抗體陽性者線粒體異常,也解釋MuSK抗體陽性者為何以眼肌及延髓支配肌肉受累顯著。Giovanna等[15]人的研究也證實了以上結論。
關于AChR抗體陽性者,無論有無臨床可見的肌肉萎縮,肌纖維萎縮在這類患者中都比較普遍,其肌肉萎縮表現為Ⅰ、Ⅱ型肌纖維均受累[14],遺憾的是本研究中2例患者為舌肌萎縮,舌肌活檢不被接受,未行病理檢查。
關于MG患者肌肉萎縮的神經源性和肌源性之爭,除了肌肉病理檢查外,還有其他輔助檢查結果參與。通過行肌電圖以及肌肉磁共振檢查,文獻報道證實了肌源性改變的肌電圖結果更多見于MuSK抗體陽性者[16-17],而對于AChR抗體陽性者,這種肌源性改變的結果更多見于長期使用激素后的面部肌肉,并且其磁共振檢查可以發現舌肌有顯著的脂肪浸潤[16]。有文獻曾借助磁共振來研究MG肌肉萎縮的特點,發現AchR抗體陽性者萎縮的舌肌有明顯的脂肪浸潤[1,16],遺憾的是本研究中2例患者均未行肌電圖和肌肉磁共振檢查。
綜合以上分析,結合2例患者的病情特點,病程長、活動不受限、AChR抗體陽性、長期使用激素等,
類固醇肌萎縮不能排除,且2患者均存在胸腺問題,胸腺參與的萎縮機制有待進一步探索。由于2例患者未行肌肉活檢、肌電圖、肌肉磁共振等檢查,神經源性肌萎縮與肌源性肌萎縮無法鑒別。例2患者僅見舌肌萎縮,未見其他肢體肌肉及面肌等萎縮,具體機制不詳,有待進一步探索。
MG合并舌肌萎縮少見,嚴重影響患者的言語和咀嚼功能,降低生活質量,多出現在延髓肌麻痹患者中,可提示病情的嚴重程度。其萎縮的進程往往較隱襲,一旦發現,需行AChR抗體以及MuSK抗體檢測,從而啟用更強有力的免疫治療,進而改善患者預后。
[1]Farrugia Elena,Robson D,Clover Linda,et al.MRI and clinical studies of facial and bulbar muscle involvement in MuSK antibody-associated myasthenia gravis[J].Brain,2006,129(Pt 6):1481-1492.
[2]Kurihara Teruyuki.Seronegative myasthenia gravis and muscle atrophy of the tongue[J].Intern Med,2005,44(6):536-537.
[3]宋林,姜亞平,汪春娟,等.重癥肌無力OssermanⅤ型2例報道[J].卒中與神經疾病,2005,12(3):185-186.
[4]Sanders B,Juel C.MuSK-antibody positive myasthenia gravis: questions from the clinic[J].J Neuroimmunol,2008,201-202(6):85-89.
[5]Lecker H,Jagoe Thomas,Gilbert Alexander,et al.Multiple types of skeletal muscle atrophy involve a common program of changes in gene expression[J].FASEB J,2004,18(1):39-51.
[6]Sandri M,Sandri C,Gilbert A,et al.Foxo transcription factors induce the atrophy-related ubiquitin ligase atrogin-1 and cause skeletal muscle atrophy[J].Cell,2004,117(3):399-412.
[7]Benveniste Olivier,Jacobson Leslie,Farrugia Elena,et al.MuSK antibody positive myasthenia gravis plasma modifies MURF-1 expression in C2C12 cultures and mouse muscle in vivo[J].J Neuroimmunol,2005,170(1/2):41-48.
[8]Szobor A, Molnár J, Klein M. Myasthenia gravis: results of thymectomy in 550 patients [J]. Orvosi Hetilap,1990,131(46):2519-2524.
[9]Mastaglia FL.Adverse effects of drugs on muscle[J].Drugs,1982,24(4):304-321.
[10] Zouvelou Vasiliki,Rentzos Michael,Toulas Panagiotis,et al.AchR-positive myasthenia gravis with MRI evidence of early muscle atrophy[J].J Clin Neurosci,2012,19(6):918-919.
[11] Oosterhuis H,Bethlem J.Neurogenic muscle involvement in myasthenia gravis. A clinical and histopathological study[J].J Neurol Neurosurg Psychiatry,1973,36(2):244-254.
[12] Brownell B,Oppenheimer DR,Spalding JM.Neurogenic muscle atrophy in myasthenia gravis[J].Journal of Neurology Neurosurgery&Psychiatry,1972,35(3):311-322.
[13] Sanders B,El-Salem K,Massey M,et al.Clinical aspects of MuSK antibody positive seronegative MG[J].Neurology,2003,60(12):1978-1980.
[14] Martignago S,Fanin M,Albertini E,et al.Muscle histopathology in myasthenia gravis with antibodies against MuSK and AChR[J].Neuropathol Appl Neurobiol,2009,35(1):103-110.
[15] Cenacchi Giovanna,Papa Valentina,Valentina Papa,et al.Comparison of muscle ultrastructure in myasthenia gravis with anti-MuSK and anti-AChR antibodies[J].J Neurol,2011,258(5):746-752.
[17] Farrugia E,Kennett P,Hilton-Jones David,et al.Quantitative EMG of facial muscles in myasthenia patients with MuSK antibodies[J].Clin Neurophysiol,2007,118(2):269-277.

