載阿霉素和順鉑的透明質酸納米粒子對小鼠移植性乳腺癌的抑制作用
馬鴻云,莊新明,許維國,劉 一
(1.吉林大學第一醫院脊柱外科,吉林 長春130021;2.中國科學院長春應用化學研究所 中科院生態環境高分子材料重點實驗室,吉林 長春130022)
乳腺癌是目前世界上最常見的女性惡性腫瘤之一,近年來發病率呈逐年上升趨勢[1]。有資料[2]顯示:中國乳腺癌發病率占全球發病率的12.2%,死亡率占全球的9.6%。乳腺癌惡性程度高,極具侵襲性,多數患者就診時已發生轉移[3],特別是骨轉移,可造成骨骼肌肉組織持續丟失[4],引起疼痛、病理性骨折及關節活動受限等一系列繼發癥狀。病程晚期患者往往喪失自理能力,生活質量差,存活率低。因此,找到一種更為安全有效的治療方法是臨床亟待解決的難題之一,并已經成為治療晚期乳腺癌的迫切需要。
目前臨床上尚缺乏有效的乳腺癌治療措施,其主要的治療手段包括病灶廣泛切除、內分泌治療、雙膦酸鹽治療、放射治療和化學治療等[5]。其中,化學治療起著十分重要的作用,但由于其嚴重的不良反應和耐藥性的發生,臨床應用受到很大限制。為了改善目前的情況,研究者[6]開發了多種聚合物納米顆粒來作為藥物運載體,并利用其靶向性、刺激反應釋放等優點,有效提高了乳腺癌的治療效果。目前,聚合物納米粒子治療乳腺癌等惡性腫瘤的研究[7-8]已有報道。透明質酸(hyaluronic acid, HA)具有CD44受體靶向性[9-11],可以積累聚集于乳腺癌組織中,增加局部藥物水平,提高抗腫瘤效率。本研究以HA為原料合成靶向納米粒子,旨在通過研究HA納米粒子對小鼠4T1乳腺癌的抑制、體內代謝及微觀病理的影響,探討其對4T1腫瘤的殺傷作用及其生物安全性,為HA納米粒子在乳腺癌治療方面的應用提供依據。由于乳腺癌具有高度侵襲性和轉移性,晚期常發生骨轉移,本研究目前僅為前期研究,后續將會進一步探討搭載阿霉素(doxorubicin,DOX)和順鉑(cisplatin,CDDP)的HA納米粒子HACDDP-DOX在乳腺癌骨轉移方面的應用。
1 材料與方法
1.1實驗動物、細胞、主要試劑和儀器4~5周的雌性BALB/c小鼠(長春生物制品研究所有限責任公司),動物許可證號:SCXK(吉)2016-0008。實驗用4T1乳腺癌細胞系(中國科學院典型培養物保藏委員會細胞庫,上海)。HA(相對分子質量為100 000,華熙福瑞達生物醫藥有限公司),鹽酸阿霉素(北京華豐聯博科技有限公司),CDDP(山東鉑源制藥有限公司),青霉素和鏈霉素(華北制藥股份有限公司),抗增殖細胞蛋白Ki-67抗體(Ki-67,西格瑪奧德里奇貿易有限公司,上海),半胱氨酸天冬氨酸蛋白酶3(Caspase-3,美國艾碧康生物有限公司)。Milli-Q水凈化設備(美國密理博有限公司),Uv-Vis型分光光度計(日本島津),透射電子顯微鏡(TEM,日本電子株式會社),動態光散射儀(DLS,美國Wyatt公司),光學顯微鏡(日本尼康顯微鏡光學儀器公司),激光共聚焦顯微鏡LSM 780(德國蔡司公司),體內熒光成像儀(美國Cambridge研究和儀器公司)。
1.2HACDDP-DOX的綠色合成和粒徑測量綠色合成是指采用無毒、無害的原料、催化劑和溶劑,選擇具有高選擇性、高轉化率,不生產或少生產對環境有害的副產品合成,其目的是從根本上消除或減少環境污染[12]。本研究中HACDDP-DOX納米粒子合成過程以水作為溶劑,無毒性原料和催化劑參與,降低了納米粒子的有機毒性。具體合成過程如下:稱取300 mg HA,溶于50 mL去離子水中,攪拌10 min。然后稱取30 mg DOX溶解于5 mL去離子水中,待溶解充分,逐滴加入HA溶液中(3~4滴·min-1),攪拌過夜。隨后,將一定量的CDDP溶液逐滴加入到上述體系,37℃攪拌72 h。通過透析法[截留相對分子質量(MWCO)3 500]透析24 h去除額外游離的藥物,最后將溶液凍干,得到HACDDP-DOX粉末[13]。所有過程均需避光處理。DOX和CDDP的載藥量(DLC)和載藥率(DLE)通過紫外光譜法和電感耦合等離子體原子發射光譜法測定。DLC和DLE通過以下公式計算[14]:DLC=納米粒子負載藥物的質量/載藥納米粒子的質量×100%,DLE=納米粒子負載藥物的質量/總投入藥的質量×100%。
納米粒子的粒徑通過TEM和DLS測定。TEM測試:將10.0 μL濃度為0.1 g·L-1的載藥納米粒子溶液滴到銅網上,室溫下干燥,將樣品置于TEM下觀察,測試電壓100 kV。DLS測試:將載藥納米粒子溶于pH值為7.4的PBS溶液中,利用Wyatt QELS裝置在25℃下測定。
1.3體外釋放實驗載藥納米粒子的釋放表現在PBS中進行,將1.0 mg的HACDDP-DOX分別溶解于10 mL pH值分別為5.5、6.8和7.4的PBS中,將溶液轉移到MWCO 3 500的透析袋中,然后將透析袋放入盛有100.0 mL不同pH值的PBS的燒杯中,放入37℃震蕩恒溫箱中恒溫震蕩,模擬體內藥物釋放環境。在規定的時間點取出2.0 mL釋放液,再補充加入2.0 mL PBS。利用UV-Vis分光光度計通過標準曲線法測定DOX的釋放量。
1.4HACDDP-DOX穩定性實驗將0.5 mg的HACDDP-DOX分別溶解于5 mL pH值分別為5.5、6.8和7.4的PBS中配制成0.1 g·L-1溶液。再將溶液轉移到DLS樣品瓶中,分別在規定時間點用Wyatt QELS裝置檢測其粒徑隨時間的變化。
1.5HACDDP-DOX體內腫瘤抑制實驗選取4~5周的雌性BALB/c小鼠,所有小鼠的飼養過程符合吉林大學動物管理和使用委員會的相關制度。將2.0×106個4T1細胞懸浮于100.0 μL PBS后,原位注射到BALB/c小鼠的第2對乳房脂肪墊以建立小鼠4T1乳腺癌模型。當腫瘤體積增大至約80 mm3時將小鼠隨機平均分成3組(n=8),分別用DOX濃度相同粒徑為(80.0±17.4) nm的HACDDP-DOX納米粒子、游離DOX/CDDP以及作為對照組的PBS通過尾靜脈注射進行治療;DOX濃度相同,均為5 mg·kg-1,每4 d治療1次,共治療3次。治療前一天開始,每天測量小鼠體質量和腫瘤體積,共持續13 d。腫瘤體積采用以下公式計算[15]:V=(L×S2)/2。其中,L和S(mm)分別為腫瘤的最大和最小直徑,實驗利用游標卡尺進行測量。
1.6病理學和免疫組織化學檢測在最后一次治療后第3天,分別收集小鼠體內的腫瘤組織和主要器官(心、肝、脾、肺和腎)。經過固定、切片和染色后用光學顯微鏡觀察切片,確定腫瘤大小和臟器損傷情況,以分析納米粒子在體內對腫瘤的抑制情況和生物安全性。HE染色評估臟器損傷情況及腫瘤抑制情況。腫瘤空白片進行免疫熒光染色,檢測Ki-67表達情況,以反映腫瘤組織增殖情況;檢測Caspase-3水平以反映腫瘤組織凋亡情況。腫瘤免疫熒光通過激光共聚焦顯微鏡成像、觀察,并采用Image J 1.8.0 軟件進行半定量分析。
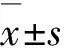
2 結 果
2.1HACDDP-DOX納米粒子的特征HA中的羧基可為DOX與CDDP通過靜電和金屬螯合作用提供結合位點,使得HA能夠相互交聯形成聚合物納米粒子,增加DOX的載藥效率,DOX的DLC和DLE分別為5.4%和52.3%。HACDDP-DOX納米粒子的TEM和DLS檢測結果顯示:HACDDP-DOX納米粒子粒徑(Dh:流體力學直徑)分布均勻,為(80.0±17.4)nm(圖1A)。HACDDP-DOX穩定性實驗:HACDDP-DOX可以在pH值為7.4環境中保持較長時間(>3 d)的穩定性,而在pH值為6.8和5.5酸性環境中粒徑增大、膨脹和裂解(圖1B和C)。HACDDP-DOX在pH值為6.8和5.5條件下較pH值為7.4環境下更易釋放DOX(圖1D)。

A: Typical TEM micrograph of HACDDP-DOX nanoparticles(The insets showed the Dh value); B:Stability of HACDDP-DOX nanoparticles in different pH buffers over time; C: Dh values of HACDDP-DOX nanoparticles in different pH buffers at 48 h; D:Release behavior of DOX from HACDDP-DOX nanoparticles in different pH PBS.*P<0.05,**P<0.01 compared with pH 7.4 group.
圖1HACDDP-DOX納米粒子的特征
Fig.1Characteristics of HACDDP-DOX nanoparticles
2.2各組小鼠的腫瘤體積和體質量以小鼠乳腺癌(4T1)腫瘤為模型,通過腫瘤體積測量觀察HACDDP-DOX的抑瘤效果。與對照組比較,在13 d的治療期內HACDDP-DOX組4T1腫瘤體積的抑制效果最好(P<0.01),其次是DOX/CDDP(P<0.01)。DOX制劑對4T1腫瘤體積的抑制具有以下順序:HACDDP-DOX > DOX/CDDP(P<0.05)。與對照組比較,DOX/CDDP組小鼠體質量明顯下降(P<0.01);HACDDP-DOX組小鼠體質量降低(P<0.05),但小于DOX/CDDP組。見圖2(插頁三)和圖3。
2.3各組小鼠病理學和免疫組織化學檢測和體內代謝對照組小鼠肝臟中央靜脈旁有腫瘤轉移灶,且對照組和DOX/CDDP組小鼠肺泡間隔明顯增寬,而HACDDP-DOX組小鼠未出現上述情況(圖4,見插頁三)。腫瘤的病理組織學檢測結果顯示:HACDDP-DOX組和DOX/CDDP組腫瘤組織均有壞死,HACDDP-DOX組腫瘤組織壞死程度明顯重于DOX/CDDP組。腫瘤免疫熒光檢測結果顯示:與DOX/CDDP組比較,HACDDP-DOX組Caspase-3熒光強度明顯增強,而Ki-67熒光減弱,半定量結果表明:Caspase-3活性明顯升高(P<0.01),而Ki-67活性明顯下降(P<0.01)。見圖5(插頁三)和圖6。生物熒光成像進一步分析在注射藥物不同時間(2、6和12 h)后DOX在體內臟器的組織分布情況發現:隨著時間推移,DOX可有效聚集于乳腺癌腫瘤部位,而非體內正常器官。見圖7(插頁四)。

A:Tumor volume; B: Body weight.*P<0.01 compared with control group;△P<0.05 compared with DOX/CDDP group.
圖3各組小鼠腫瘤體積和體質量
Fig.3Tumor volumes and body weights of mice in various groups
3 討 論
近年來,隨著納米醫學的迅猛發展,納米技術

*P<0.01 compared with control group.
圖6各組小鼠乳腺癌組織中Caspase-3(A)和Ki-67(B)的表達
Fig.6Expression levels of Caspase-3(A) and Ki-67(B) in breast cancer tissue of mice in various groups
已經成為21世紀的關鍵技術之一,推動了多個研究領域的迅猛發展,特別是癌癥精準治療領域。HA具有較好的生物相容性和CD44受體靶[9-11]向性,可以積累聚集于CD44受體過表達的乳腺癌等腫瘤組織中,靶向釋放化療藥物,提高抗腫瘤效率。本研究選擇以HA作為原料通過綠色合成途徑合成載藥納米粒子HACDDP-DOX,并通過荷瘤小鼠尾靜脈注射HACDDP-DOX以驗證、探討其對4T1乳腺癌的靶向抑制作用。
與傳統化療藥物比較,聚合物納米粒子負載的抗腫瘤藥物具有明顯的優點:①刺激反應釋放;②聯合、協同治療[16];③跨越生物屏障[17];④靶向治療[18];⑤增強腫瘤積累;⑥延長循環時間等。HACDDP-DOX納米粒子可以通過CD44受體靶向性積累于腫瘤組織中,并在腫瘤等酸性條件下刺激反應性釋放搭載藥物,增強治療效果。通過體內生物熒光成像分析HACDDP-DOX經由尾靜脈注入體內2、6和12 h后DOX的分布情況顯示:隨著時間延長,HACDDP-DOX在乳腺腫瘤組織中聚集增多,這可能是由于藥物載體與腫瘤表面CD44受體的主動靶向作用,而這也是其靶向性的藥理學基礎。此外,HACDDP-DOX組肝臟熒光強度在注射后2和6 h較高,提示肝臟為其主要代謝器官,納米粒子可被Kupffer吞噬細胞吞噬清除。體外釋放實驗及穩定性實驗證實:HACDDP-DOX能夠在腫瘤等酸性條件下膨脹、裂解,響應性釋放DOX,這也進一步為其提高抗腫瘤效果提供了理論基礎。
本研究中小鼠乳腺癌抑制曲線和體質量變化曲線結果顯示:HACDDP-DOX納米粒子對4T1乳腺癌的抑制效果最好。與對照組比較,DOX/CDDP組小鼠體質量明顯下降,腫瘤體積明顯縮小;HACDDP-DOX組小鼠體質量也減輕,但小于DOX/CDDP組。上述結果表明相對于DOX/CDDP來說,天然高分子納米化可以明顯減小游離化療藥物的系統毒性,提高其安全性。DOX和CDDP作為傳統化療藥物可引起包括消化道反應、骨髓抑制和肝腎功能損害等在內的嚴重不良反應,且長期應用會導致腫瘤耐藥性的出現[19-21]。本文作者通過HE染色對體內主要臟器和腫瘤組織進行了病理學分析,進一步證實了HACDDP-DOX納米粒子的生物安全性,可有效降低化療藥物對肝臟、肺臟等主要臟器的損傷。4T1腫瘤是一種高轉移性腫瘤[22],腫瘤病理學分析顯示:HACDDP-DOX納米粒子能夠引起腫瘤組織壞死,同時有效抑制4T1腫瘤的轉移。Ki-67是在細胞G1、S、G2和M期出現的核抗原,由于其半衰期短,因此可以準確反映細胞的增殖活性。本研究免疫熒光染色顯示:應用HACDDP-DOX納米粒子后,腫瘤Ki-67活性明顯下降,說明腫瘤增殖受到抑制。此外,免疫熒光染色還顯示HACDDP-DOX組Caspase-3活性明顯升高,且Caspase-3在凋亡早期階段即被激活,并裂解相應的胞質胞核底物,執行凋亡功能[23],說明HACDDP-DOX誘導了腫瘤細胞凋亡的發生。
綜上所述,HACDDP-DOX納米粒子可以有效靶向于4T1乳腺癌,在降低化療藥物系統毒性的同時增加腫瘤局部的藥物水平,明顯抑制乳腺癌生長。本研究雖然證實HACDDP-DOX納米粒子能夠靶向積累于腫瘤組織,但未對其在體內的代謝進行定量分析,其對乳腺癌細胞的抑制作用及細胞內代謝分子生物學機制有待進一步研究。
[參考文獻]
[1] DeSantis CE, Fedewa SA, Goding Sauer A, et al. Breast cancer statistics, 2015: Convergence of incidence rates between black and white women[J]. CA Cancer J Clin, 2016,66(1):31-42.
[2] Fan L, Strasser-Weippl K, Li JJ, et al. Breast cancer in China[J]. Lancet Oncol, 2014,15(7):e279-e289.
[3] Bertucci F, Birnbaum D. Distant metastasis: not out of reach any more[J]. J Biol, 2009,8(3):28.
[4] Kubo Y, Naito T, Mori K, et al. Skeletal muscle loss and prognosis of breast cancer patients[J]. Support Care Cancer, 2017,25(7):2221-2227.
[5] Gnant M, Harbeck N, Thomssen C. St. Gallen/Vienna 2017: A brief summary of the consensus discussion about escalation and de-escalation of primary breast cancer treatment[J]. Breast Care(Basel), 2017,12(2):102-107.
[6] Peer D, Karp JM, Hong S, et al. Nanocarriers as an emerging platform for cancer therapy[J]. Nat Nanotechnol, 2007,2(12):751-760.
[7] Wang DG, Wang TT, Xu ZA, et al. Cooperative treatment of metastatic breast cancer using host-guest nanoplatform coloaded with docetaxel and siRNA[J]. Small, 2016,12(4):488-498.
[8] Yu HJ, Guo CY, Feng B, et al. Triple-layered pH-responsive micelleplexes loaded with siRNA and cisplatin prodrug for NF-Kappa B targeted treatment of metastatic breast cancer[J]. Theranostics, 2016,6(1):14-27.
[9] Zhao YQ, Zhang T, Duan SF, et al. CD44-tropic polymeric nanocarrier for breast cancer targeted rapamycin chemotherapy[J]. Nanomedicine, 2014,10(6):1221-1230.
[10]Camacho KM, Kumar S, Menegatti S, et al. Synergistic antitumor activity of camptothecin-doxorubicin combinations and their conjugates with hyaluronic acid[J]. J Control Release, 2015,210:198-207.
[11]Bano F, Banerji S, Howarth M, et al. A single molecule assay to probe monovalent and multivalent bonds between hyaluronan and its key leukocyte receptor CD44 under force[J]. Sci Rep, 2016, 6: 34176.
[12]Ahmed S, Annu, Chaudhry SA, et al. A review on biogenic synthesis of ZnO nanoparticles using plant extracts and microbes: A prospect towards green chemistry[J]. J Photochem Photobiol B Biol, 2017,166:272-284.
[13]谷學源. 以順鉑為交聯劑基于透明質酸為載體的納米藥物對CD44高表達的乳腺癌的治療的研究[D]. 沈陽: 中國醫科大學, 2016.
[14]Guo H, Xu W, Chen J, et al. Positively charged polypeptide nanogel enhances mucoadhesion and penetrability of 10-hydroxycamptothecin in orthotopic bladder carcinoma[J]. J Control Release, 2017,259:136-148.
[15]Schmid D, Park CG, Hartl CA, et al. T cell-targeting nanoparticles focus delivery of immunotherapy to improve antitumor immunity[J]. Nat Commun, 2017,8(1):1747.
[16]Rejinold NS, Baby T, Chennazhi KP, et al. Multi drug loaded thermo-responsive fibrinogen-graft-poly(N-vinyl Caprolactam) nanogels for breast cancer drug delivery[J]. J Biomed Nanotechnol, 2015,11(3):392-402.
[17]Kolter M, Ott M, Hauer C, et al. Nanotoxicity of poly(n-butylcyano-acrylate) nanoparticles at the blood-brain barrier, in human whole blood andinvivo[J]. J Control Release, 2015, 197: 165-179.
[18]Oh SS, Lee BF, Leibfarth FA, et al. Synthetic aptamer-polymer hybrid constructs for programmed drug delivery into specific target cells[J]. J Am Chem Soc, 2014, 136(42): 15010-15015.
[19]Ansari L, Shiehzadeh F, Taherzadeh Z, et al. The most prevalent side effects of pegylated liposomal doxorubicin monotherapy in women with metastatic breast cancer:A systematic review of clinical trials[J]. Cancer Gene Ther, 2017,24(5):189-193.
[20]Florea AM, Busselberg D. Cisplatin as an anti-tumor drug: cellular mechanisms of activity, drug resistance and induced side effects[J]. Cancers (Basel), 2011,3(1):1351-1371.
[21]Pezeshki Z, Maleki M, Talebi A, et al. Age and gender related renal side effects of cisplatin in animal model[J]. Asian Pac J Cancer Prev, 2017,18(6):1703-1705.
[22]Yu PF, Huang Y, Xu CL, et al. Downregulation of CXCL12 in mesenchymal stromal cells by TGFbeta promotes breast cancer metastasis[J]. Oncogene, 2017,36(6):840-849.
[23]Pu X, Storr SJ, Zhang Y, et al. Caspase-3 and caspase-8 expression in breast cancer: caspase-3 is associated with survival[J]. Apoptosis, 2017,22(3):357-368.

