PERK信號通路對實驗性絕經后骨質疏松雌性大鼠成骨細胞分化的影響
李希寧,陳曉春,朱云飛,曹涇楠,鄒憶婷,杜 霄,王旗春
(湖州師范學院醫學院病理學教研室,浙江 湖州 313000)
絕經后骨質疏松(postmennopausal osteoporosis,PMOP) 是一種與衰老有關的常見病,主要發生在絕經后婦女[1]。PMOP核心發病機制為雌激素下降之后導致骨重建與骨吸收失衡,即成骨細胞的骨形成能力下降而破骨細胞的骨吸收能力增強,從而導致骨組織微細結構破壞、骨脆性增加以及易于骨折[2-3]。因此,PMOP的防治已成為目前迫切需要解決的公共健康問題。目前PMOP發病機制研究主要集中在成骨細胞和破骨細胞功能不平衡,導致骨質流失過多[4-6],但成骨細胞功能減弱和破骨細胞功能增強的誘導機制并未給予深入研究[7]。PERK是一種絲氨酸/蘇氨酸的蛋白激酶,內質網上錯誤或未折疊蛋白的聚集可引起PERK的活化,是內質網應激的直接結果[8]。PERK基因敲除的小鼠中,成骨細胞的分化和成熟障礙并伴有Ⅰ型膠原(typeⅠcollogen,ColⅠ)分泌減少,導致骨骼發育受損,同時成骨細胞內核心結合因子1(core-binding factor a1,cbfa1)和osterix的表達下調[9-10],提示PERK很可能是一種新的調節骨骼發育和成骨細胞活動的因子。本實驗通過動物實驗觀察PERK信號通路與成骨細胞分化和凋亡有關的轉錄因子、細胞因子和其他重要信息分子之間的聯系,探討PERK信號通路在PMOP發生時在成骨細胞凋亡和骨轉換加速中的作用,闡明PMOP的發生機制,為制定骨質疏松的防治策略提供新的思路和理論依據。
1 材料與方法
1.1實驗動物、主要試劑和儀器雌性Wistar大鼠(浙江大學實驗動物中心),實驗動物生產許可證號:SYXK(浙)2012-0178。TRIzol試劑盒(Invitrogen公司,美國),High-Capacity cDNA ReverseTranscription Kit和Power SYBR○RGreen PCRMaster Mix(Applied Biosystems公司,美國),SMARTpool reagents Nrf2和Transfection Reagent(ThermoFisher公司,美國),Primary antibody(Santa Cruz公司,美國),RIPA裂解液(Transgen Biotech公司,中國)。凝膠電泳儀、電泳槽和轉膜槽(Bio-Rad公司,美國),PCR儀(ThermoFisher公司,美國)。
1.2大鼠PMOP模型復制及實驗分組雌性Wistar大鼠適應飼養1周后,分為3組,每組15只:① 正常對照組(大鼠不作處理);② 骨質疏松組(雌性大鼠卵巢摘除);③ 骨質疏松治療組(大鼠卵巢摘除后尾靜脈注射雌激素)。
1.3血液分析儀檢測大鼠血清中蛋白水平大鼠飼養3個月后,采用眼球摘除法取大鼠全血樣本,室溫靜置2 h,1 000 r·min-1離心5 min,取上層血清樣本,經血液分析儀檢測各種大鼠血清中ColⅠ、堿性磷酸酶(alkaline phosphatase,ALP)和骨鈣素(osteoclcin,OCN)水平。
1.4RT-PCR法檢測大鼠骨組織中PERK、ATF4、Runx2、osterix、RANKL和OPG基因表達取大鼠股骨,經液氮反復冷凍變脆敲碎,按照TRIzol試劑盒說明書提取總RNA,并用Nano-Drop分光光度計測定RNA濃度。按照High-Capacity cDNA Reverse Transcription Kit和Power SYBR○RGreen PCR Master Mix說明書合成cDNA和PCR擴增,GAPDH 作為內參。使用StepOnePlus system software導出Ct值,基因相對表達水平采用2-(△Ct)計算。
1.5Western blotting法檢測大鼠骨組織中PERK、ATF4、Runx2、osterix、RANKL和OPG蛋白表達取大鼠股骨,經液氮反復冷凍變脆敲碎,RIPA裂解液提取總蛋白,BCA法測定蛋白質濃度,每個泳道加入15 μg蛋白后進行SDS-PAGE電泳,電泳后轉到PVDF膜,使用5%脫脂奶粉封閉PVDF膜2 h后,分別加入稀釋后的抗小鼠一抗4℃孵育過夜,辣根過氧化物酶標記的二抗37℃孵育1 h,ECL顯影,應用Gel Image system-1600凝膠成像系統采集圖像。
1.6HE染色觀察骨組織形態學取大鼠股骨,4%多聚甲醛固定24 h,20%甲酸和15%乙二胺四乙酸脫鈣14 d,各級乙醇脫水、浸蠟、包埋、切片,HE染色觀察。
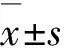
2 結 果
2.1各組大鼠血清中ColⅠ、ALP和OCN水平與對照組比較,骨質疏松組大鼠血清中ColⅠ、ALP和OCN水平明顯降低(P<0.05或P<0.01);與骨質疏松組比較,骨質疏松治療組大鼠血清ColⅠ、ALP和OCN水平明顯升高(P<0.01)。見表1。
表1各組大鼠血清ColⅠ、ALP和OCN水平
Tab.1Levels of serum ColⅠ,ALP and OCN of rats in various groups

GroupColⅠALPOCNControl10.16±1.567.83±1.748.77±2.96Osteoporosis4.99±1.62??3.01±1.24?2.06±0.37??Osteoporosis treatment9.02±2.13△7.50±1.38△8.45±1.37△
*P<0.05,**P<0.01 compared with control group;△P<0.01 compared with osteoporosis group.
2.2各組大鼠骨組織中PERK、ATF4、Runx2、osterix、RANKL和OPG基因表達水平與對照組比較,骨質疏松組大鼠骨組織中PERK和ATF4基因表達水平明顯降低(P<0.05或P<0.01),成骨細胞轉錄因子Runx2和osterix基因表達水平明顯降低(P<0.05或P<0.01),而誘導破骨細胞分化促進骨質吸收因子RANKL基因表達水平明顯升高(P<0.01);與骨質疏松組比較,骨質疏松治療組骨組織中PERK、ATF4、Runx2和osterix基因表達水平均明顯升高(P<0.05或P<0.01),而RANKL表達水平明顯下降(P<0.01)。見表2。
2.3各組大鼠骨組織中PERK、ATF4、Runx2、osterix、RANKL和OPG蛋白表達與對照組比較,骨質疏松組大鼠骨組織中PERK、Runx2和osterix蛋白表達水平明顯降低(P<0.05或P<0.01),ATF4和RANKL蛋白表達水平明顯升高(P<0.05或P<0.01);與骨質疏松組比較,骨質疏松治療組大鼠骨組織中PERK和Runx2蛋白表達水平均明顯升高(P<0.05或P<0.01),而RANKL蛋白表達水平明顯降低(P<0.01)。見圖1和表3。
表2各組大鼠骨組織中成骨標志物基因表達水平


GroupPERKATF4Runx2osterixRANKLOPGControl3.24±2.136.12±1.654.17±0.748.65±2.955.87±1.856.10±0.98Osteoporosis0.80±1.62??2.51±1.40?1.66±0.48??1.72±1.56??14.62±3.01??4.74±1.52Osteoporosistreatment3.65±2.68△△6.01±0.37△△3.82±1.17△7.41±2.51△△6.37±1.74△△5.89±2.09
*P<0.05,**P<0.01 compared with control group;△P<0.05,△△P<0.01 compared with osteoporosis group.

Lane 1: Control group; Lane 2: Osteoporosis treatment group; Lane 3: Osteoporosis group.
圖1各組大鼠骨組織中成骨標志物蛋白表達電泳圖
Fig.1Electrophoregram of protein expressions of osteogenic markers in bone tissue of rats in various groups
2.4各組大鼠骨組織形態表現與對照組比較,骨質疏松組大鼠股骨骨干中破骨細胞數量增多,功能活躍,骨干中出現多個骨質吸收形成的骨陷窩;與骨質疏松組比較,骨質疏松治療組大鼠股骨骨干結構恢復正常,破骨細胞功能減弱,骨質吸收陷窩消失。見圖2(插頁四)。
3 討 論
PMOP的核心發病機制為雌激素下降后導致骨重建與骨吸收失衡[11]。目前對于PMOP發病機制的研究[12]主要集中在成骨細胞的活性下降和破骨細胞的活性增強,但內在的調控機制尚缺乏研究。本研究通過動物體內實驗探討PMOP發生時分子水平調控機制的異常改變,為PMOP的防治提供新的分子靶點和理論依據。
表3各組大鼠骨組織中成骨標志物蛋白表達水平


GroupPERKATF4Runx2OsterixRANKLOPGControl0.87±0.541.24±0.651.17±0.740.25±0.130.07±0.030.40±0.74Osteoporosis0.06±0.02??1.51±0.34?0.66±0.13??0.72±0.39??0.69±0.49??0.54±0.22Osteoporosistreatment0.38±0.15△△1.61±0.571.12±0.68△0.96±0.51△△0.15±0.38△△0.49±0.09
*P<0.05,**P<0.01 compared with control group;△P<0.05,△△P<0.01 compared with osteoporosis group.
正常情況下,骨骼的結構完整和功能保持取決于破骨細胞和成骨細胞協同作用,維持骨重建與骨吸收的平衡[13]。成骨細胞作為骨形成的主要功能細胞,在分化成熟過程中會逐步表達特異性標志物,如ALP、OCN和ColⅠ等[14-15]。同時,在此過程中也會受到一系列轉錄因子的調控,如Runx2、Osterix/Sp7、β-catenin、ATF4、核轉錄因子激活蛋白1和Smads 等[16-17],它們彼此協同作用,共同參與調節成骨細胞分化及骨形成。成骨細胞功能下降,導致骨轉錄因子和成骨因子表達減少,是導致骨質疏松形成的主要因素。PERK基因敲除的小鼠中,成骨細胞分化和成熟障礙,并伴有ColⅠ分泌減少,導致骨骼發育受損。ATF4是PERK通路下游靶分子,同時也是較早受到關注的與成骨細胞分化和骨形成相關的轉錄因子[18]。ATF4可協同cbfa1刺激成骨細胞內OCN的表達,提示ATF4在成骨細胞分化、成熟和骨骼發育中有重要作用[18]。研究[19]顯示:體外培養功能活躍的成骨細胞中BiP和PDI表達水平明顯升高,而骨質疏松癥患者功能不活躍的成骨細胞中BiP和PDI表達水平明顯下降,由此推測內質網應激很可能刺激成骨細胞的成骨作用。
本研究結果顯示:雌性大鼠卵巢切除后,PERK和ATF4表達水平明顯降低,成骨細胞轉錄因子Runx2和osterix表達水平明顯降低,而誘導破骨細胞分化促進骨質吸收的因子RANKL表達明顯升高,提示雌性大鼠卵巢切除后成骨細胞分化功能減弱而破骨細胞成熟增強引起骨質吸收增強導致出現PMOP,通過外源補充雌激素能有效緩解此種癥狀。本研究結果為PMOP發生機制研究提供了科學依據,為制定骨質疏松的防治策略提供了新的思路和理論依據。
[參考文獻]
[1] Hannafon F,Cadogan MP.Recognition and treatment of postmenopausal osteoporosis [J].J Gerontol Nurs,2014,40(3):10-14.
[2] Geusens P.New insights into treatment of osteoporosis in postmenopausal women [J].RMD Open,2015,1(Suppl 1):e000051.
[3] Cohen A,Kamanda-Kosseh M,Recker RR,et al.Bone density after teriparatide discontinuation in premenopausal idiopathic osteoporosis[J].J Clin Endocrinol Metab,2015,100(11):4208-4214.
[4] Shieh A,Han W,Ishii S,et al.Quantifying the balance between total bone formation and total bone resorption: An index of net bone formation[J].J Clin Endocrinol Metab,2016,101(7):2802-2809.
[5] Hu S,Liu CC,Chen G,et al.In vivo effects of two novel ALN-EP4a conjugate drugs on bone in the ovariectomized rat model for reversing postmenopausal bone loss[J].Osteoporos Int,2016,27(2):797-808.
[6] McNabb BL,Vittinghoff E,Schwartz AV,et al.BMD changes and predictors of increased bone loss in postmenopausal women after a 5-year course of alendronate[J].J Bone Miner Res,2013,28(6):1319-1327.
[7] Jafari A,Qanie D,Andersen TL,et al.Legumain regulates differentiation fate of human bone marrow stromal cells and is altered in postmenopausal ssteoporosis[J].Stem Cell Rep,2017,8(2):373-386.
[8] Mujcic H,Nagelkerke A,Rouschop KM,et al.Hypoxic activation of the PERK/eIF2α arm of the unfolded protein response promotes metastasis through induction of LAMP3[J].Clin Cancer Res,2013,19(22):6126-6137.
[9] Wei J,Sheng X,Feng D,et al.PERK is essential for neonatal skeletal development to regulate osteoblast proliferation and differentiation[J].J Cell Physiol,2008,217(3): 693-707.
[10]Yu Y,Pierciey FJ Jr,Maguire TG,et al.PKR-like endoplasmic reticulum kinase is necessary for lipogenic activation during HCMV infection[J].PLoS Pathog,2013,9(4):e1003266.
[11]Dizdar M,Irdesel JF,Dizdar OS,et al.Effects of balance-coordination,strengthening and aerobic exercises to prevent falls in postmenopausal patients with osteoporosis: A 6-month randomized parallel prospective study[J].J Aging Phys Act,2018,26(1):41-51.
[12]Satpathy S,Patra A,Ahirwar B.Experimental techniques for screening of antiosteoporotic activity in postmenopausal osteoporosis[J].J Complement Integr Med,2015,12(4):251-266.
[13]Zhao R,Xie P,Zhang K,et al.Selective effect of hydroxyapatite nanoparticles on osteoporotic and healthy bone formation correlates with intracellular calcium homeostasis regulation[J].Acta Biomater, 2017,59:338-350.
[14]Moshiri A,Oryan A,Meimandi-Parizi A.Synthesis,development,characterization and effectiveness of bovine pure platelet gel-collagen-polydioxanone bioactive graft on tendon healing[J].J Cell Mol Med,2015,19(6):1308-1332.
[15]Fang Z,Yang Q,Xiong W,et al.Effect of CGRP-adenoviral vector transduction on the osteoblastic differentiation of rat adipose-derived stem cells[J]. PLoS One,2013,8(8):e72738.
[16]Choi YH,Han Y,Jin SW,et al.Pseudoshikonin I enhances osteoblast differentiation by stimulating Runx2 and Osterix[J].J Cell Biochem,2018, 119(1):748-757.
[17]Xu L,Kong Q.Research progress of key signaling pathways in osteoblast differentiation and bone formation regulation[J].Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi,2014,28(12):1484-1489.
[18]Sun F,Li X,Yang C,et al.A role for PERK in the mechanism underlying fluoride-induced bone turnover[J].Toxicology,2014,325:52-66.
[19]Wei J,Sheng X,Feng D,et al.PERK is essential for neonatal skeletal development to regulate osteoblast proliferation and differentiation[J].J Cell Physiol,2008,217(3): 693-707.

