腦蛋白水解物對H2O2誘導的PC12細胞氧化損傷的修復作用及其胃漂浮片處方的優化
楊昕祺,王廣紅,糜心雅,安麗萍,杜培革,王曼力
(北華大學長白山藥用動植物活性多肽國家地方聯合工程實驗室,吉林 吉林 132013)
腦蛋白水解物 (brain protein hydrolyzate,BPH) 由動物腦組織中提取分離所得,內含小分子多肽、神經營養因子和游離氨基酸等活性成分[1]。研究[2-3]顯示:BPH可跨過血腦屏障作用于中樞神經系統,具有增加腦活性、保護神經細胞免受缺血、低氧和神經毒素等損害的作用,并對神經退行性疾病有良好療效。BPH中含有的肽類及氨基酸等有效物質,在小腸中上部無菌部位通過主動轉運被小腸上皮細胞吸收,因此滯留時間越長吸收越好[4-5]。目前國內外對BPH的劑型研究僅限于注射劑和片劑,劑型過于單一而常規片劑通過無菌部位時間僅為2~3 h,對多數口服制劑來說胃腸滯留時間相對過短,因此許多藥物未被釋放完全就已通過吸收部位,導致生物利用度不高,并且由于胃排空的個體差異較大,使某些藥物的藥效差異顯著[6-8]。本研究通過BPH在人工胃液、腸液處理后對H2O2誘導的PC12細胞氧化損傷修復作用的對比,制備BPH 胃漂浮片劑,觀察其胃腸滯留時間,并運用星點設計-效應面法優化 BPH 胃漂浮片處方,為該成分的有效利用提供參考。
1 材料與方法
1.1主要試劑與儀器BPH (長春長慶藥業),BPH片 (黑龍江江世藥業有限公司),PC12細胞(通派上海生物科技有限公司),十八醇 (湖南爾康制藥股份有限公司,批號:105220140801),羥丙甲纖維素HPMC-K4M (安徽山河藥用輔料股份有限公司,批號:F20072003),聚丙烯酸樹脂Ⅱ (安徽山河藥用輔料股份有限公司,批號:F20090001),乳糖 (曲阜市天利藥用輔料有限公司,批號:20110106),硬脂酸鎂 (鄭州亨多寶化工有限公司,批號:G20130358),微晶纖維素 (曲阜市天利藥用輔料有限公司,批號:20140305),MTT (北京鼎國昌盛生物技術有限責任公司,批號:51L10156 ),H2O2(沈陽市華東試劑廠,批號:20121009),胎牛血清(天津市灝洋生物制品科技有限公司)。TDP-5 型單沖壓片機 (長沙市云麓區中南制藥機械廠),電熱恒溫水浴鍋(上海博訊實業有限公司醫療設備廠),MODEL LD310-2電子天平 (沈陽龍騰電子有限公司),SY-6D 型片劑四用測定儀 (常州銳品精密儀器有限公司),實驗室微型噴霧干燥機L-117 (北京來亨科貿有限公司技術開發中心)。
1.2細胞培養PC12細胞由上海生物科技有限公司提供。PC12細胞采用含10% FBS 的 DMEM在37℃、5% CO2的培養箱中常規培養。
1.3BPH對正常PC12細胞的作用取對數生長期的PC12細胞(1.0×105mL-1)分為正常對照組和給藥組,另設空白對照組。正常對照組和給藥組每孔加入100 μL細胞懸液,接種到96孔板中,空白對照組只加100 μL培養基,設置3個復孔。24 h后空白對照組、正常對照組每孔加入100 μL培養基,給藥組加入100 μL 不同濃度(20、40、60和120 mg·L-1) BPH,再培養24 h后加20 μL、0.5 g·L-1的MTT,培養2 h,去除培養液,各孔分別加入100 μL DMSO,37℃下孵育5 min,于酶標儀550 nm 處測定吸光度(A)值,計算細胞活力。細胞活力=(給藥組A值-空白對照組A值)/(正常對照組A值-空白對照組A值)×100%。
1.4H2O2誘導PC12細胞氧化損傷模型的建立取對數生長期的PC12細胞分為正常對照組和模型組,另設空白對照組。正常對照組和模型組每孔加入100 μL細胞懸液,空白對照組加100 μL培養基,設置3個復孔。24 h后向模型組加入梯度濃度(100、200、300、400和500 μmol·L-1)的H2O2溶液100 μL,空白對照組和正常對照組每孔加入培養基100 μL,采用MTT法,在1、2、3、4和5 h 時檢測A值,計算細胞活力。選擇細胞活力為65% 時的條件為最佳損傷條件。
1.5BPH在不同條件下對PC12細胞氧化損傷的作用取對數生長期的PC12細胞分為BPH組、人工胃液處理的BPH(GBPH) 組、人工腸液處理的BPH (IBPH)組、人工胃液處理的BPH片(GBPH-T) 組和人工胃液處理的BPH漂浮片(GBPH-FT) 組,接種到96孔板中,設置3個復孔,每孔加入100 μL細胞懸液;另設空白對照組,只加100 μL培養基。24 h后空白對照組和正常對照組每孔加入100 μL培養基,其余各組加入以上處理的BPH 100 μL,濃度為20、40、60、80和100 mg·L-1,再培養24 h后用300 μmol·L-1的H2O2損傷3 h,采用MTT法于酶標儀550 nm處檢測A值,計算細胞活力,細胞活力越高氧化損傷修復水平越高。
1.6BPH胃漂浮片的制備將BPH噴成固體粉末。十八醇在60℃ 熔融,加入丙烯酸樹脂Ⅱ號和HPMC-K4M質量的2/3立即用16目篩制粒,剩余的HKMC-K4M與乳糖、微晶纖維素和BPH 濕法制粒。2次制得的粒混合后干燥,整粒,加0.3% 硬脂酸鎂,壓片。
1.7體外漂浮性能的觀察取6片放入 (37±0.5) ℃ 的人工胃液中,模擬胃蠕動。記錄起漂時間與持續漂浮時間,觀察漂浮性。每片的起漂時間均 <5 s,持續漂浮時間 >8 h,說明漂浮性能良好。

1.9星點設計-效應面優化工藝由預實驗確定 BPH 20 mg、乳糖10 mg 和微晶纖維素 20 mg 為固定含量。十八醇 (X1)、HPMC-K4M (X2) 和丙烯酸樹脂Ⅱ號 (X3) 質量為考察因素,其 8 h 的累計釋放度為指標,用 Design-expert 8.0.6 Trial 按水平編碼表進行 3 因素 3 水平試驗。模型擬合:根據顯著性 (P<0.05) 以及R2,優選出二次模型方程為最佳擬合方程。并對其各項系數進行方差分析。響應面及優化處方[10]:根據擬合方程,固定一個變量后對其余2個變量以 8 h 總釋放度對其影響做曲面圖和等高線圖。
1.10處方驗證進行 3 次平行實驗,驗證最佳處方的可行性。比較8 h 總釋放度的預測值和實測值。
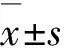
2 結 果
2.1BPH 作用下各組 PC12 細胞活力與正常對照組比較,60 mg·L-1BPH組細胞活力明顯升高(121.17%±1.80%) (P<0.05),120 mg·L-1BPH 組細胞活力時明顯降低(89.61%±1.70%)(P<0.05)。見圖1。
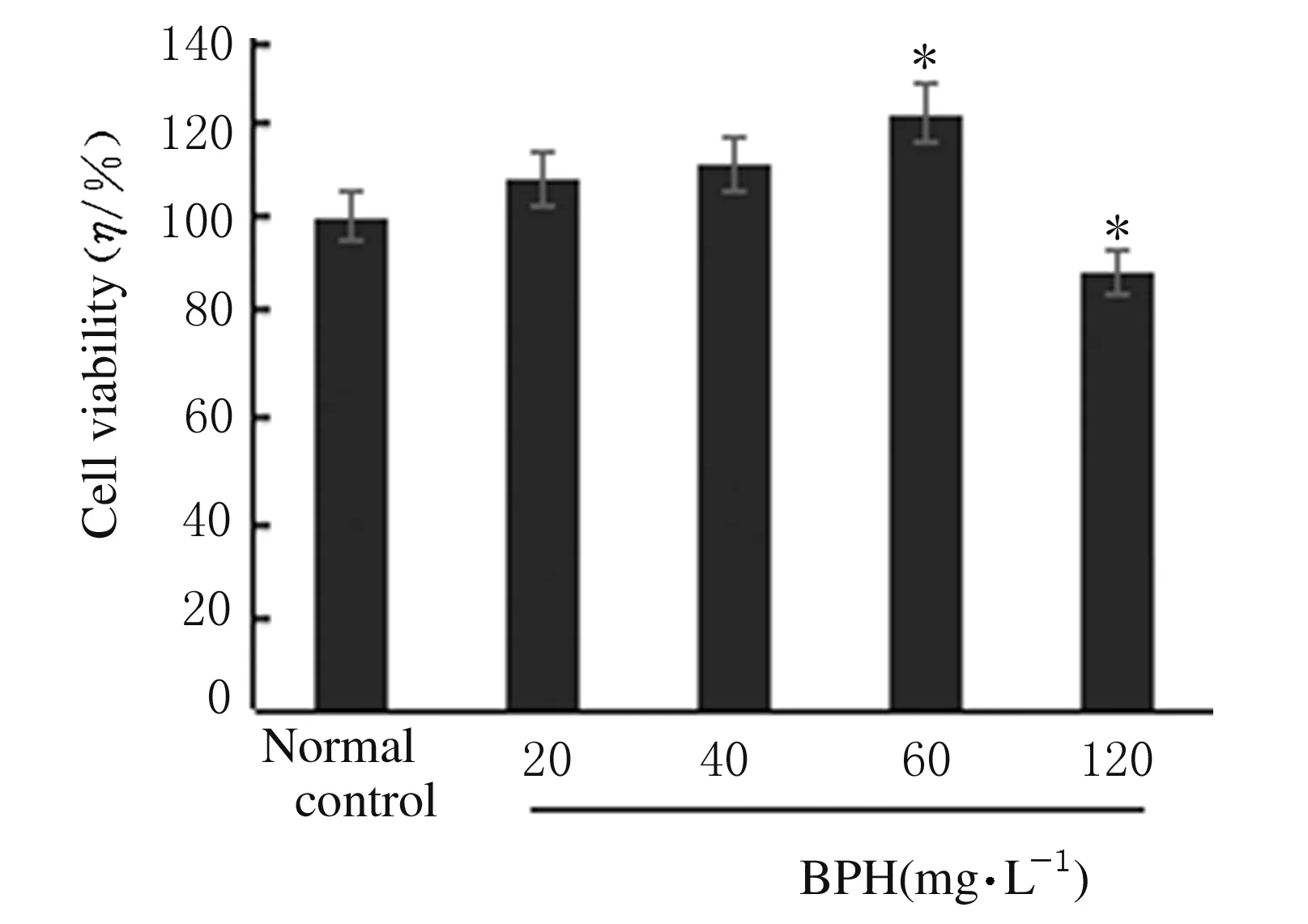
2.2H2O2作用下各組PC12細胞活力與正常對照組比較,300 μmol·L-1H2O2組損傷3 h時,細胞活力為 (65.37%±0.90%) (P<0.05),為最佳條件,其他各組細胞活力均未達到65%。見圖2。
2.3各組PC12細胞氧化損傷修復水平與模型組比較,60 mg·L-1BPH 組和GBPH-FT 組細胞活力明顯升高 (P<0.01),IBPH 組和GBPH組細胞活力升高 (P<0.05);與BPH 組比較,IBPH 組細胞活力降低 (P<0.05),GBPH組細胞活力差異無統計學意義 (P>0.05);與GBPH-T 組比較,GBPH-FT 組細胞活力明顯升高 (P<0.05)。見表1。
*P<0.05 vs normal control group.
Fig.1Viabilities of PC12 cells in various groups detected by MTT assay
*P<0.05 vs normal control group.
Fig.2Viabilities of PC12 cells in various groups after treated with H2O2
2.4星點設計-響應面優化工藝根據星點設計實驗水平編碼表和實驗結果以及曲面圖和等高線圖,t檢驗在P<0.05 水平上簡化得到擬合方程:y=-1 170.295 15+31.173 45X1+6.522 81X2+28.428 72X3+0.047 361X1X2+0.048 359X1X3-0.114 51X2X3-0.261 82X12-0.148 85X22-0.101 81X32(R2=0.963 6),F=20.60,P=0.000 3<0.05,表明該模型高度顯著,失擬度和擬合度良好,實驗誤差小,有較高的可信度[11-12]。可用其對 BPH 胃漂浮片的工藝進行分析和預測。通過對回歸模型方程計算,最大釋放率為85.437 7%;BPH 胃漂浮片最佳處方為HPMC-K4M27 mg,十八醇 63 mg,丙烯酸樹脂Ⅱ號13 mg,BPH 20 mg,乳糖 10 mg,微晶纖維素 20 mg,硬脂酸鎂 0.4 mg。水平編碼表見表 2,實驗結果見表 3,方差分析見表 4。曲面圖和等高線圖見圖3~5(插頁五)。
表1各組PC12 細胞活力

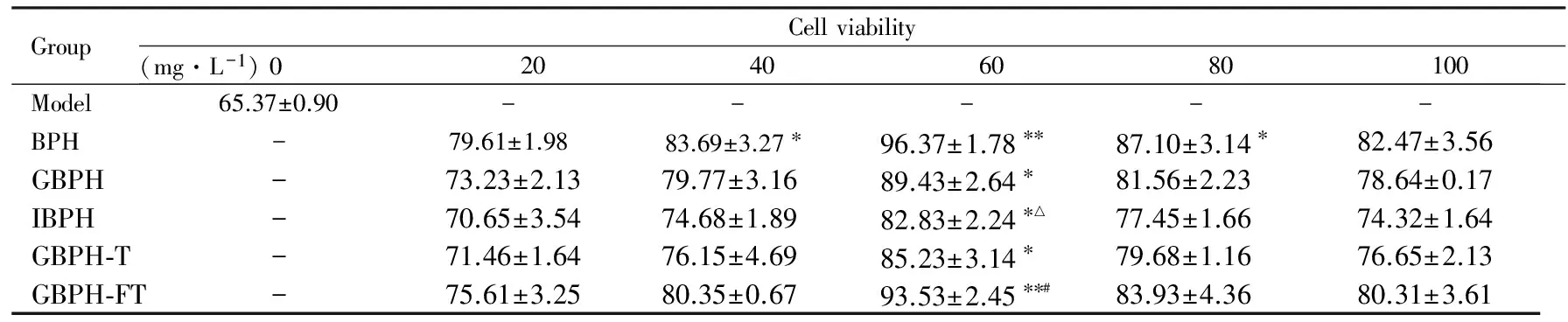
GroupCellviability(mg·L-1)020406080100Model65.37±0.90-----BPH-79.61±1.9883.69±3.27?96.37±1.78??87.10±3.14?82.47±3.56GBPH-73.23±2.1379.77±3.1689.43±2.64?81.56±2.2378.64±0.17IBPH-70.65±3.5474.68±1.8982.83±2.24?△77.45±1.6674.32±1.64GBPH?T-71.46±1.6476.15±4.6985.23±3.14?79.68±1.1676.65±2.13GBPH?FT-75.61±3.2580.35±0.6793.53±2.45??#83.93±4.3680.31±3.61
*P<0.05,**P<0.01vsmodel group;△P<0.05vsBPH group;#P<0.05vsGBPH-T group.“-”:No data.
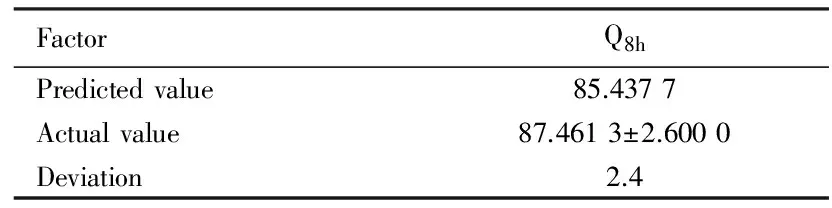
2.5處方的驗證藥物累積釋放度的實測值與預測值偏差 < 5%,非常接近,BPH胃漂浮片漂浮滯后時間均<5 s,持續漂浮時間>8 h。見表5。
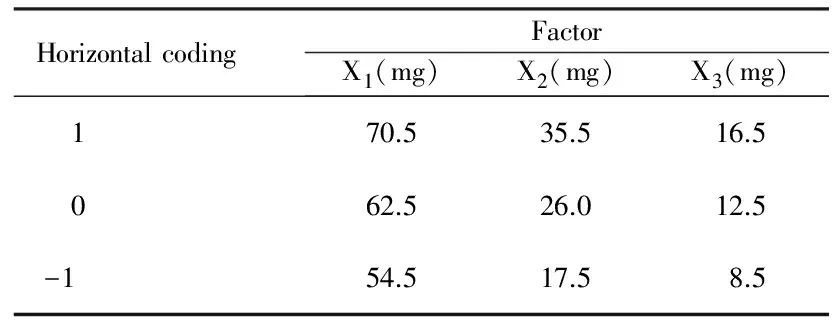
表2 實驗因素水平編碼表
表3效應面法設計實驗結果
Tab.3Experimental results designed by effect surface method
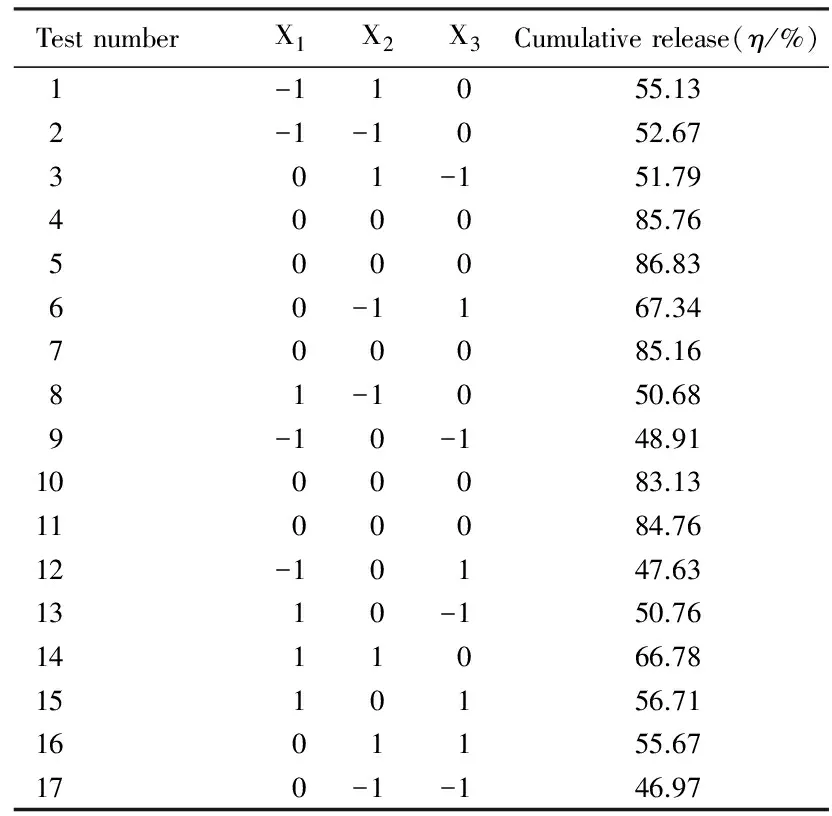
TestnumberX1X2X3Cumulativerelease(η/%)1-11055.132-1-1052.67301-151.79400085.76500086.8360-1167.34700085.1681-1050.689-10-148.911000083.131100084.7612-10147.631310-150.761411066.781510156.711601155.67170-1-146.97
表4響應面二次回歸方程方差分析
Tab.4Variance analysis of response surface quadratic regression equation

SourceofvarianceSSDFMFFPModel3741.339415.7020.600.0003A?X147.78147.782.370.1678B?X217.14117.140.850.3874C?X397.16197.164.810.0643X1X246.51146.512.300.1728X1X39.5819.580.470.5131X2X367.98167.983.370.1091X121182.2311182.2358.570.0001X22612.041612.0430.320.0009X321308.5511308.5564.830.0001Residual141.29720.18--Lackoffittest133.86344.6224.040.0051Pureerror7.4241.86- - Totalerror3882.6216---
“-”:No data.
表5處方 8 h 累積釋放度驗證
Tab.5Verification of cumulative release of prescription for 8 h (Q8h)(η/%)
3 討 論
BPH 含有的成分具有修復腦神經元的作用,能夠促進腦蛋白合成和突觸形成,誘導神經元分化進而改善神經元代謝,并可增加腦內葡萄糖及氧的利用,促進腦功能的恢復[13-14]。研究[15-16]表明:PC12 細胞源于生成神經系統的外胚層,具有某些神經元的特征,是比較理想的細胞模型,主要用于評價各類藥物對神經元氧化損傷的影響。因此本研究選用 PC12 細胞并建立H2O2對PC12細胞氧化損傷模型,結果表明:在 60 mg·L-1濃度時BPH 不僅對正常 PC12細胞有很好的增殖作用,而且對損傷細胞有明顯的修復作用,同時與人工腸液相比,人工胃液環境處理的BPH的修復作用與BPH對損傷細胞修復作用最為接近,證明BPH在胃環境下可以穩定存在,使BPH胃漂浮片劑的研制成為可能。
BPH 相對分子質量小并易被腎小球濾過,導致體內循環的半衰期過短,這樣不僅達不到療效還需要多次注射給藥才能穩定藥效,造成治療成本高并且患者順應性差[17]。而本文作者研制的 BPH 胃漂浮片劑可以充分延長胃滯留時間,從而提高小腸上皮細胞吸收藥物,釋放的藥物以溶液狀態大量到達無菌部位,通過主動轉運跨越生物膜,促進細胞的代謝調節功能,能很好地提高生物利用度,從而減少多次給藥降低治療成本并提高患者順應性,在神經退行性疾病治療中具有較強的應用潛力。本實驗運用的星點設計-效應面法在藥學領域是新型的設計實驗方法,實驗次數少且精確度高,能科學有效處理處方輔料因素的影響[18]。根據星點設計-響應面法擬合方程 (P<0.05,R2=0.963 6),模型顯著性及擬合度良好,實驗誤差小,方差分析結果顯示:十八醇是影響漂浮片的體外釋放的最顯著因素,HPMC-K4M和丙烯酸樹脂Ⅱ號分別次之。制成的漂浮片可持續漂浮 8 h,充分延長了胃內滯留時間,體外釋放率可達 85.437 7%,釋放充分而且藥效與 BPH 片對比能得到更好的利用。與BPH 片比較,研制成的漂浮片劑與在人工胃環境中能更好地抑制 H2O2引起的 PC12 細胞活力降低。
處方中 HPMC-K4M 在漂浮片中含量越少, 漂浮片的密度越低、十八醇密度較低、質量小,且越多在水中越呈不溶性, 在 HPMC-K4M 形成的凝膠體制中, 一定程度上起助漂作用[19];丙烯酸樹脂Ⅱ號可用于增加藥物的穩定性,改變藥物的釋放性能[20];乳糖作為致孔劑并有水溶性,可增加藥物的緩釋作用[21]。本實驗為今后的 BPH 活性探討及其胃漂浮制劑處方優化和輔料研究等提供了參考。
[參考文獻]
[1] 魏婧,馬玉玲,邵曉彤,等. 腦蛋白水解物對小鼠記憶鞏固能力的影響及機制[J].中國老年學雜志,2015,35(9):2362-2365.
[2] Liu Z,Zhou T,Ziegler A,et al.Oxidative stress in neurodegenerative diseases:From molecular mechanisms to clinical applications[J].Oxid Med Cell Longev,2017,2017:2525967.
[3] Acosta SA,Tajiri N,Sanberg PR,et al. Increased amyloid precursor protein and tau expression manifests as key secondary cell death in chronic traumatic brain injury[J]. Cell Physiol,2017,232(3):665-677.
[4] 李倩.反芻動物小肽的吸收及營養生理研究進展[J].廣東農業科學,2011,38(16):99-101,110.
[5] 張嬋,侯威,王成濤,等.高F值活性肽的生物活性、制備技術及吸收評價技術的研究進展[J].食品安全質量檢測學報,2014,5(1):131-135.
[6] Bomma R,Swamy Naidu RA,Yamsani MR,et al.Development and evaluation of gastroretentive norfloxacin floating ablets[J].Acta Pharm,2009,59(2):211-221.
[7] 吳黛麗.腦蛋白水解物制劑的質量標準及不良反應[J].生物技術世界,2015(7):136.
[8] 盧芳,井月娥,任燕冬,等.星點設計-效應面法優化復方拜顫停片劑的處方[J].中國中醫藥信息雜志,2016,23(7):87-91.
[9] 國家藥典委員會.中華人民共和國藥典:四部[M].北京:中國醫藥科技出版社,2015:通則 0931.
[10]杜娟,林寧.星點設計-效應面法優化尼可地爾胃漂浮緩釋片制劑處方[J].中國醫院藥學雜志,2016,36(4):293-296.
[11]王雙雙,劉睿,何新.星點設計-效應面法優化桔梗泡騰片的處方[J].中國實驗方劑學雜志,2016,22(12):23-27.
[12]Raza A,Bukhari NI,Karim S,et al.Floating tablets of minocycline hydrochloride:Formulation,in-vitroevaluation and optimization[J].Future J Pharmaceut Sci,2017,3(2):131-139.
[13]王月古,陳鳴.腦蛋白水解物治療缺血性腦血管病的臨床療效及對神經功能的影響分析[J]. 中國處方藥,2017,15(7):72-73.
[14]Rah YC,Yoo MH,Choi J,et al.Invivoassessment of hair cell damage and developmental toxicity caused by gestational caffeine exposure using zebrafish (Danio rerio) models[J]. Neurotoxicol Teratol,2017,64:1-7.
[15]劉靜波,劉文超,徐夢蕾,等. 基于PC12細胞模型分析大豆蛋白水解物對神經元氧化損傷的保護作用[J].現代食品科技,2015,31(4):8-12,57.
[16]Zeng Z,Xu J,Zheng W. Artemisinin protects PC12 cells against β-amyloid-induced apoptosis through activation of the ERK1/2 signaling pathway[J]. Redox Biol,2017,12:625-633.
[17]張榮華.腦蛋白水解物類藥物研究進展[J].大家健康:學術版,2013(19):206-207.
[18]胡靜,周衛.星點設計-效應面法對帕利哌酮滲透泵控釋片處方的優化[J].中國醫院藥學雜志,2016(16):1369-1374.
[19]Patel SG,Bummer PM. Development of a robust method for simultaneous quantification of polymer (HPMC) and surfactant(dodecyl β-D-maltoside) in nanosuspensions[J].AAPS Pharm Sci Tech,2016,17(5):1182-1191.
[20]李樾,劉艷林,賀瑞玲,等.首批聚丙烯酸樹脂Ⅱ國家標準物質的研制與建立[J].藥物分析雜志,2013,33(3):514-516.
[21]Tan S,Jiang T,Ebrahimi A,et al. Effect of spray-drying temperature on the formation of flower-like lactose for griseofulvin loading[J].Eur J Pharm Sci,2018,111:534-539.

