iPSC-NSCs腦立體定向注射對腦出血大鼠腦血腫周圍組織中IL-6、TGF-β1表達及神經功能的影響
秦 潔,馬 丹,李 珠,孫石磊,楊 靖,史長河,宋 波,許予明
鄭州大學第一附屬醫院神經內科 鄭州 450052
腦卒中嚴重威脅人類健康, 是全球范圍內導致人類死亡的第二大因素[1-2]。腦出血(intracerebral hemorrhage,ICH)是腦卒中患者發病和死亡的主要原因之一,病死率為30%~50%,并且近75%的幸存者1 a后不能獨立生活[3]。針對ICH,現有的臨床治療手段主要是對癥支持治療(如降低血壓、顱內壓力或外科手術治療等),治療效果有限[4]。同時,ICH的病理生理機制非常復雜,目前仍不非常明確[5]。越來越多的證據[6-7]表明ICH急性期免疫炎癥反應在繼發性腦損傷中起重要作用,但臨床上尚缺乏針對ICH繼發性腦損傷的免疫調節干預方法。研究[8-9]表明誘導多能干細胞來源的神經干細胞(induced pluripotent stem cells derived neural stem cells, iPSC-NSCs)具有免疫調節和抗炎作用,能全面改善ICH預后。已有研究[10]證實IL-6可促進炎癥反應和加重腦水腫,而TGF-β1則具有強大的免疫抑制作用。目前關于IL-6和TGF-β1在ICH后血腫組織周圍表達水平的研究很少。本研究旨在探討腦立體定向注射iPSC-NSCs對早期ICH模型大鼠神經功能及腦血腫周圍組織中IL-6和TGF-β1表達的影響,為ICH的治療提供實驗依據。
1 材料與方法
1.1動物和細胞動物:選取清潔級雄性SD大鼠84只(250~300 g),均購自河南省實驗動物中心(批號:41003100004315),大鼠的飼養及相關實驗程序均經過鄭州大學倫理委員會批準;細胞:大鼠iPSC由上海生命科學研究院肖磊研究員建立并提供,經鄭州大學第一附屬醫院重點實驗室誘導分化為iPSC-NSCs。
1.2主要試劑和儀器DMEM、DMEM/F12、胰蛋白酶、胎牛血清、青霉素-鏈霉素溶液(HyClone公司),氯胺酮、基質膠、Ⅶ型膠原酶(Sigma公司),大鼠腦立體定位儀(Narishige SN-3公司),倒置顯微鏡(LEICA公司),IL-6、TGF-β1 ELISA檢測試劑盒(武漢谷歌生物科技有限公司),酶標檢測儀(BioTeK公司),電子天平(上海梅特勒-托利多儀器有限公司)。
1.3動物分組及模型制作選取84只SD雄性大鼠,采用隨機數字表法分為假手術組28只(采用立體定位儀僅定位穿刺,不注射Ⅶ型膠原酶和PBS溶液)、對照組28只(采用立體定位儀定位穿刺并注射Ⅶ型膠原酶,ICH后4~6 h在鑒定造模成功后注射PBS溶液)、實驗組28只(采用立體定位儀定位穿刺注射Ⅶ型膠原酶,ICH后4~6 h在鑒定造模成功后,經腦立體定位注射含iPSC-NSCs的PBS溶液)。模型制作方法[7]:腹腔注射30 mg/kg氯胺酮麻醉SD大鼠,麻醉滿意后將大鼠俯臥位固定在大鼠腦立體定位儀上,取大鼠左側紋狀體為定位點,選取前囟后0.5 mm,左側旁開3.5 mm,垂直進針5.5 mm。以10 μL微量進樣器緩慢注入0.5 U Ⅶ型膠原酶溶液,留針10 min,之后緩慢退針。針退出后,清潔創面,縫合頭皮。模型成功的判定:術后大鼠完全蘇醒后,采用mNSS評分對ICH模型大鼠進行神經功能缺損評估,mNSS評分>6分,且灌注區腦組織可見血腫形成,即為造模成功,選取mNSS 8~12分的ICH模型大鼠。神經功能缺損癥狀過輕無明顯癥狀或過重出現意識障礙、移動困難或死亡的棄去,重新造模補入。
1.4iPSC-NSCs的培養在預鋪C57/BL6小鼠胚胎成纖維細胞條件下傳代培養iPSC,經差速貼壁法去除滋養層細胞,用擬胚體培養基繼續培養iPSC形成擬胚體,經全反式維甲酸誘導分化為iPSC-NSCs, 用NSC培養基懸浮培養iPSC-NSCs, 經3~5 d連續傳代培養2次后得到第3代iPSC-NSCs。將生長良好的第3代iPSC-NSCs 培養直至達到所需移植細胞數(105μL-1),在ICH后4~6 h將iPSC-NSCs立體定向注入ICH模型大鼠腦內。
1.5ICH模型大鼠的神經功能評分各組選10只ICH模型大鼠分別在術后第1、3、7、14和28天進行mNSS評分。
1.6腦血腫周圍組織中IL-6、TGF-β1水平的測定
造模后分別在第1、3、7天,每個時間點取6只大鼠,麻醉滿意后斷頭取腦組織標本,全部標本均以冰箱凍存。用ELISA法檢測各組大鼠腦血腫周圍組織中IL-6及TGF-β1。首先準確稱取腦組織,加入生理鹽水,在冰水浴條件下機械勻漿,制備成勻漿液,2 500~3 000 r/min離心10 min,取上清液,然后采用ELISA試劑盒進行檢測,分別設空白孔、標準孔和樣品孔,各孔中分別加入標準品或樣品100 μL,封板膜封板,37 ℃孵育90 min,甩去孔內液體。每孔加入生物素化抗體工作液100 μL,封板膜封板,37 ℃孵育60 min,甩板并洗板3次;每孔加酶結合物工作液100 μL,封板膜封板,37 ℃孵育30 min,甩板并洗板3次;每孔加底物溶液(TMB)90 μL,封板膜封板,37 ℃避光孵育15 min左右。當標準孔出現明顯梯度時,每孔加入終止液50 μL終止反應,立即用酶標儀在450 nm波長處檢測OD值。最后以標準品孔OD值繪制標準曲線,根據標準曲線計算樣品濃度。
1.7統計學處理采用SPSS 21.0進行數據分析。3組間IL-6和TGF-β1表達量的比較采用重復測量數據的方差分析。檢驗水準α=0.05。
2 結果
2.1iPSC-NSCs腦立體定向注射對ICH模型大鼠神經功能的影響假手術組大鼠在各時間點均未出現神經功能缺損癥狀;對照組及實驗組大鼠在造模4~6 h蘇醒后即出現對側肢體癱瘓等神經功能缺損的表現,其癥狀、體征于術后第1天達到高峰,持續至第3天左右,而后隨時間推移神經功能逐漸恢復。與對照組大鼠相比,實驗組大鼠在造模術后第14天起評分較低,這一效果持續至第28天(圖1)。
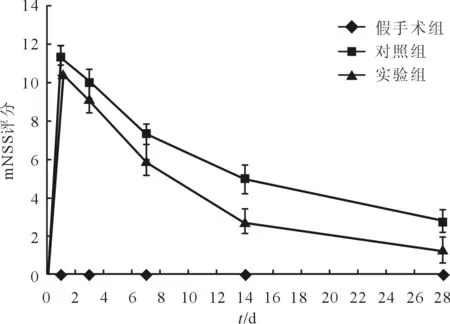
圖1 3組大鼠mNSS評分比較
2.2iPSC-NSCs腦立體定向注射對ICH模型大鼠腦血腫周圍組織中IL-6表達水平的影響見表1。
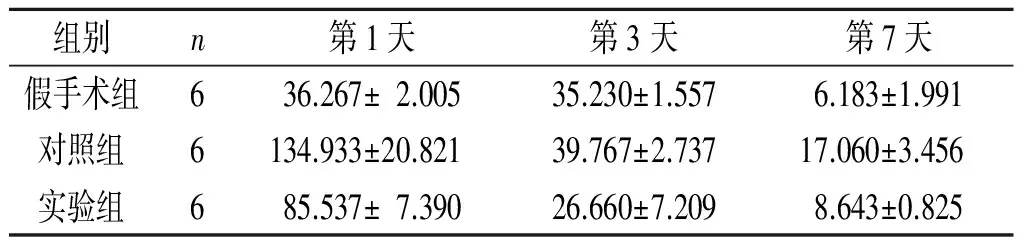
表1 3組大鼠腦血腫周圍組織中IL-6的表達 ng/L
F組間=133.290,F時間=524.720,F交互=82.142,P均<0.001
2.3iPSC-NSCs腦立體定向注射對ICH模型大鼠腦血腫周圍組織中TGF-β1表達水平的影響見表2。
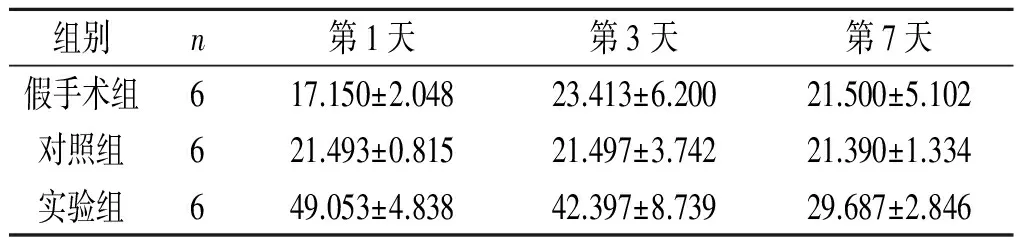
表2 3組大鼠腦血腫周圍組織中TGF-β1的表達 ng/L
F組間=43.121,P<0.001;F時間=8.532,P=0.001;F交互=57.957,P<0.001
3 討論
ICH是嚴重的腦卒中亞型,具有發病率、病死率、復發率和致殘率“四高”的特點[3,5]。研究[11]表明急性ICH可激活免疫系統釋放大量的炎癥介質,引起腦內炎癥反應,在ICH后的繼發性腦損傷中起著重要的作用。急性腦血管病患者病情嚴重程度與其免疫功能存在一定聯系,隨著病情加重,機體免疫功能處于低下或抑制狀態[12]。研究[13]顯示,干細胞移植可減輕炎癥反應、減少神經元的死亡、減輕瘢痕形成和促進腦白質的功能再塑,成為ICH模型治療中有應用前景的選擇之一。本研究中實驗組腦立體定向注射iPSC-NSCs后第14和28天神經功能評分均優于對照組,從行為學上表明iPSC-NSCs移植在ICH大鼠中可產生腦保護作用,促進神經功能恢復,但其作用機制尚不明確。
ICH急性期血腫周圍組織迅速發生炎癥反應并表達多種細胞因子,其中比較重要的炎癥介質有IL-6和TGF-β1。有學者[14]已證實這些炎性因子的濃度與ICH的嚴重程度及預后有密切關系。
IL-6 是一種多功能細胞因子,具有多種生物效應。目前關于IL-6與缺血性腦損傷的研究較多,但有關IL-6與ICH的研究較少。本實驗結果顯示,ICH后大鼠腦血腫周圍組織中IL-6的表達大量增加,與對照組相比,實驗組在腦立體定向注射iPSC-NSCs后,IL-6的表達下降,同時大鼠神經功能也得到改善,表明IL-6 參與ICH的炎癥反應過程,腦組織中IL-6 濃度升高可能與ICH預后不良有關。
TGF-β1可以促進小膠質細胞的發育和穩態,調節小膠質細胞表型,延緩神經元死亡,誘導巨噬細胞通過SMAD2和SMAD3信號通路促進傷口愈合,維持免疫耐受,是最有可能的免疫“調解員”[11]。研究[15]表明,在小鼠腦缺血模型中,TGF-β1能夠抑制神經細胞死亡,從而發揮神經保護作用,可顯著增強腦梗死后小鼠神經功能的恢復,但TGF-β1在ICH中的作用尚不明確。本研究結果表明,與對照組大鼠相比,實驗組大鼠在iPSC-NSCs腦立體定向注射后腦組織中TGF-β1的表達顯著上升,且大鼠神經功能得到改善,表明TGF-β1可以抑制ICH后的炎癥反應進而保護神經元。研究[11]表明急性ICH患者血清中 TGF-β1水平明顯降低,但未明確原因。本研究結果表明有大量的TGF-β1在腦血腫周圍組織中富集, 可能是血清中水平降低的原因之一。
綜上所述,腦立體定向注射iPSC-NSCs可明顯改善ICH模型大鼠的神經功能,其機制可能為iPSC-NSCs可調節大鼠腦內主要促炎因子IL-6及抑炎因子TGF-β1的表達,繼而下調炎癥反應誘發的急性ICH后繼發性腦損傷。
[1] KIM JY,BAE HJ.Spontaneous intracerebral hemorrhage: management[J].J Stroke,2017,19(1):28
[2] 孟凡祥.某醫院腦卒中患者發病影響因素調查[J].解放軍預防醫學雜志,2016,34(2):272
[3] KLEBE D,MCBRIDE D,FLORES JJ,et al.Modulating the immune response towards a neuroregenerative peri-injury milieu after cerebral hemorrhage[J].J Neuroimmune Pharmacol,2015,10(4):576
[4] GUAN J,HAWRYLUK GW.Targeting secondary hematoma expansion in spontaneous intracerebral hemorrhage:state of the art[J].Front Neurol,2016,7:187
[5] CORDEIRO MF,HORN AP.Stem cell therapy in intracerebral hemorrhage rat model[J].World J Stem Cells,2015,7(3):618
[6] ZHOU Y,WANG Y,WANG J,et al.Inflammation in intracerebral hemorrhage: from mechanisms to clinical translation[J].Prog Neurobiol,2014,115:25
[7] QIN J,MA X,QI HY,et al.Transplantation of induced pluripotent stem cells alleviates cerebral inflammation and neural damage in hemorrhagic stroke[J].PLoS One,2015,10(6):e129881
[8] MA X,QIN J,SONG B,et al.Stem cell-based therapies for intracerebral hemorrhage in animal model: a meta-analysis[J].Neurol Sci,2015,36(8):1311
[9] GAO L,LU Q,HUANG LJ,et al.Transplanted neural stem cells modulate regulatory T, gamma delta T cells and corresponding cytokines after intracerebral hemorrhage in rats[J].Int J Mol Sci,2014,15(3):4431
[10]MARTINEZ FO,GORDON S.The M1 and M2 paradigm of macrophage activation: time for reassessment[J].F1000Prime Rep,2014,6:13
[11]TAYLOR RA,CHANG CF,GOODS BA,et al.TGF-β1 modulates microglial phenotype and promotes recovery after intracerebral hemorrhage[J].J Clin Invest,2017,127(1):280
[12]WANG H,YAN FL,CUNNINGHAM M,et al.Potential specific immunological indicators for stroke associated infection are partly modulated by sympathetic pathway activation[J].Oncotarget,2016,7(32):52404
[13]OTTOBONI L,MERLINI A,MARTINO G.Neural stem cell plasticity:advantages in therapy for the injured central nervous system[J].Front Cell Dev Biol,2017,5:52
[14]張弢.血清炎性因子水平在急性腦出血惡化的預測價值[J].中國實驗診斷學,2014,18(7):1077
[15]CEKANAVICIUTE E,FATHALI N,DOYLE KP,et al.Astrocytic transforming growth factor-beta signaling reduces subacute neuroinflammation after stroke in mice[J].Glia,2014,62(8):1227