鼠傷寒沙門菌質(zhì)粒毒力基因?qū)δ退幈硇偷挠绊?/h1>
2018-04-02 08:32:01朱春暉王文杏陳慶法吳春雪劉曉艷賴華毅余曉君
鄭州大學(xué)學(xué)報(醫(yī)學(xué)版) 2018年2期 關(guān)鍵詞:耐藥
朱春暉,王文杏,陳 強(qiáng),陳慶法,吳春雪,劉曉艷,賴華毅,余曉君
1)江西省兒童醫(yī)院感染科 南昌 330006 2)江西省兒童醫(yī)院內(nèi)科 南昌 330006 3)江西省兒童醫(yī)院檢驗(yàn)科 南昌 330006
沙門菌是一組寄生于人類和動物腸道內(nèi)生化反應(yīng)和抗原構(gòu)造相似的革蘭陰性桿菌,除可以引起傷寒、副傷寒外,也是人類細(xì)菌性食物中毒、腹瀉、菌血癥和敗血癥的主要病原體。菌血癥和敗血癥嚴(yán)重威脅著人類健康,在免疫功能未發(fā)育完善的兒童中病死率極高。據(jù)不完全統(tǒng)計,沙門菌每年造成全球約750萬兒童感染病例,在非洲地區(qū)沙門菌感染在兒童中的死亡率甚至高達(dá)24%[1]。本課題組前期研究[2]結(jié)果表明,江西地區(qū)腹瀉兒童大便中沙門菌分離率高,其中鼠傷寒沙門菌為主要血清型,耐藥現(xiàn)象嚴(yán)重。2013世界經(jīng)濟(jì)論壇全球風(fēng)險報告將抗生素耐藥細(xì)菌列為人類健康最大危害之一。因此,沙門菌耐藥機(jī)制的研究顯得尤為重要。據(jù)此,本課題組構(gòu)建穩(wěn)定的沙門菌表達(dá)載體,并在前期使用同源重組法制備鼠傷寒沙門菌質(zhì)粒毒力基因(Salmonellaplasmid virulence genes,spv)基因缺陷株[3-5]基礎(chǔ)上構(gòu)建鼠傷寒沙門菌spv回補(bǔ)株,分析菌株間耐藥表型的差異,并探討其可能機(jī)制,為逆轉(zhuǎn)鼠傷寒沙門菌耐藥提供新的分子靶標(biāo)。
1 材料與方法
1.1質(zhì)粒、菌株、酶類和主要試劑野生型鼠傷寒沙門菌株STM.211為前期從臨床腹瀉患者糞便中分離并由江西省兒童醫(yī)院微生物室保存的臨床分離株(藥敏試驗(yàn)提示對阿莫西林克拉維酸鉀、頭孢噻肟、頭孢他啶、頭孢吡肟、頭孢唑啉、慶大霉素、環(huán)丙沙星耐藥);spvB基因缺陷株STM.211-△-spvB、spvC基因缺陷株STM.211-△-spvC和spvB及spvC基因共同缺陷株STM.211-△-spvBC(課題組前期研究構(gòu)建,并保存);大腸埃希菌Top10購自天根生化科技(北京)有限公司;pMD19-T克隆載體購自大連TaKaRa公司;pACYC184克隆載體購自南通麥杰生物科技有限公司;pAZ44-H質(zhì)粒由華中農(nóng)業(yè)大學(xué)農(nóng)業(yè)微生物學(xué)國家重點(diǎn)實(shí)驗(yàn)室郭愛珍教授惠贈。限制性內(nèi)切酶SalⅠ、SphⅠ、T4 DNA連接酶、EcoRⅠ、EcoRⅤ、DMEM培養(yǎng)基及胎牛血清購自Hyclone公司,質(zhì)粒提取試劑盒、DNA 膠 回收試劑盒、RT-PCR試劑盒購自Promega 公司,細(xì)菌基因組 DNA 提取試劑盒(離心柱)購自天根生化科技(北京)有限公司,DNA 聚合酶試劑盒購自Qiagen 公司,脂質(zhì)體Lipofectamine及總RNA提取試劑購自Invitrogen公司,PCR引物由TaKaRa合成,DNA 分子質(zhì)量標(biāo)準(zhǔn)Marker 購自生工生物工程(上海)股份有限公司。
1.2eGFP基因的合成及克隆根據(jù)GenBank中的增強(qiáng)綠色熒光蛋白(enhanced green fluroscent protein,eGFP)基因序列,在上游增加Trc Promoter啟動子序列,下游增加rrnB ribosomal終止子序列,位點(diǎn)上游增加XhoⅠ和XbaⅠ酶切位點(diǎn),下游增加NheⅠ酶切位點(diǎn)。設(shè)計引物序列,由生工生物工程(上海)股份有限公司完成合成。以設(shè)計合成的引物E1至E26各10 μL混合物為模板,進(jìn)行PCR預(yù)擴(kuò)增。取PCR產(chǎn)物為模板,用E1和E26進(jìn)行PCR擴(kuò)增,獲得含啟動子和終止子的eGFP基因,割膠純化產(chǎn)物,用XhoⅠ、NheⅠ和SalⅠ、XbaⅠ對PCR產(chǎn)物和pACYC184載體進(jìn)行雙酶切,電泳分離目的基因,對目的條帶割膠純化后用T4連接酶進(jìn)行定向連接以構(gòu)建pACYC184-eGFP,轉(zhuǎn)至Top10感受態(tài)細(xì)菌,氯霉素篩選陽性克隆,PCR檢測并測序鑒定。
1.3hok/sok-parDE(HOK)基因的調(diào)取及克隆以pAZ44-H質(zhì)粒為模板,用HOK正反義引物進(jìn)行PCR擴(kuò)增獲取aphA-hok-parDE基因,割膠純化產(chǎn)物后用NheⅠ和XbaⅠ對產(chǎn)物和pACYC184-eGFP載體進(jìn)行酶切,電泳分離目的基因后,割膠純化,用T4連接酶進(jìn)行定向連接構(gòu)建pACYC184-eGFP-HOK載體,轉(zhuǎn)化至E.coli Top10感受態(tài)細(xì)菌,氯霉素、卡那霉素雙抗篩選陽性克隆,PCR檢測并測序鑒定證實(shí)載體構(gòu)建的正確性。
1.4spvB及spvC基因的調(diào)取及克隆根據(jù)GenBank中公布的鼠傷寒沙門菌spvB、spvC基因的上、下游核苷酸序列,以沙門菌基因組DNA為模板進(jìn)行PCR擴(kuò)增,獲取spvB、spvC基因,割膠純化產(chǎn)物,分別克隆至pMD19-T獲得pMD-spvB和 pMD-spvC質(zhì)粒,轉(zhuǎn)至Top10感受態(tài)細(xì)菌,篩選陽性克隆后用BglⅡ、NotⅠ和SalⅠ、NotⅠ進(jìn)行雙酶切驗(yàn)證并測序鑒定。
使用限制性內(nèi)切酶對質(zhì)粒pMD-spvB、pMD-spvC及pACYC184-eGFP-HOK進(jìn)行酶切,電泳分離目的基因后進(jìn)行割膠純化,用T4連接酶進(jìn)行定向連接,構(gòu)建pACYC184-spvB-eGFP-HOK和pACYC184-spvC-eGFP-HOK載體,轉(zhuǎn)至Top10感受態(tài)細(xì)菌,氯霉素、卡那霉素雙抗篩選陽性克隆,PCR檢測并測序鑒定。
1.5spvB及spvC回補(bǔ)株STM.211-c-spvBC的構(gòu)建及鑒定將pACYC184-eGFP、pACYC184-spvB-eGFP-HOK、pACYC184-spvC-eGFP-HOK質(zhì)粒DNA與電感受態(tài)STM.211-△-spvBC輕吸混勻制備混合物,加入預(yù)冷的電擊杯中,排除氣泡,使用2 100 V電擊混合物,然后迅速加入無抗LB培養(yǎng)液中,吹吸混勻并轉(zhuǎn)移到1.5 mL離心管中,取重懸菌液均勻涂布于含50 mg/L卡那霉素和氯霉素的LB固體培養(yǎng)基平板上,倒置平板,37 ℃ 20 h。重組菌經(jīng)PCR測序鑒定后命名為STM.211-c-spvBC、STM.211-c-spvBC-HOK。
1.6質(zhì)粒穩(wěn)定性評價分別挑取STM.211-c-spvBC、STM.211-c-spvBC-HOK單菌落接種于含有100 mg/L卡那霉素的LB液體培養(yǎng)基,37 ℃ 200 r/ min振搖培養(yǎng),使菌液的A600 nm達(dá)到0.1~0 .3,取10 μL菌液轉(zhuǎn)接到10 mL無抗性LB的液體培養(yǎng)基中,37 ℃振蕩培養(yǎng)。每12 h傳代1次,連續(xù)培養(yǎng)6 d,轉(zhuǎn)接的同時將菌液進(jìn)行倍比稀釋。取適當(dāng)稀釋度的菌液分別涂布在LB固體平板和卡那霉素/氯霉素雙抗瓊脂平板后統(tǒng)計菌落數(shù),每個平板涂10 μL菌液,每個稀釋度重復(fù)3次,計數(shù)LB平板菌落數(shù),計數(shù)雙抗平板帶質(zhì)粒的菌落數(shù),二者比值為抗性菌落百分?jǐn)?shù),用以評價質(zhì)粒穩(wěn)定性。實(shí)驗(yàn)重復(fù)3 次。采用標(biāo)準(zhǔn)堿裂解法抽提質(zhì)粒確定質(zhì)粒存在。
1.7藥物敏感性實(shí)驗(yàn)根據(jù)美國臨床實(shí)驗(yàn)室標(biāo)準(zhǔn)委員會(NCCLS)標(biāo)準(zhǔn)應(yīng)用瓊脂平板稀釋法檢測菌株(STM.211、STM.211-△-spvB、STM.211-△-spvC、STM.211-△-spvBC、STM.211-c-spvBC)對臨床常用抗生素的最小抑菌濃度(minimal inhibit concentration,MIC),參照NCCLS2004年標(biāo)準(zhǔn)判斷結(jié)果。質(zhì)控菌為大腸埃希菌ATCC25922。
1.8外排泵相關(guān)蛋白AcrA和AcrB的Westernblot檢測待毒力基因spv缺陷株、毒力基因spv回補(bǔ)株及野生菌株的菌液生長至A600 nm=0.6~0.8,離心收集細(xì)胞,沉淀用離解液[20 nmol/L Tri-鹽酸(pH=8.0),100 mmol/L氯化鈉,30%甘油,AEBSF, 1 mmol/L依地酸(EDTA,pH=8.0)]懸浮,超聲破細(xì)胞。用Bradford法測定總蛋白濃度,小牛血清白蛋白定標(biāo),行SDS-PAGE,將蛋白在25 V 電壓下電轉(zhuǎn)移30 min(檢測AcrB時,采用電壓20 V,20 min),然后移至硝酸纖維素膜上,再先后與抗AcrA抗體或抗AcrB抗體(1200)及HRP標(biāo)記的抗兔 IgG 二抗雜交,化學(xué)發(fā)光試劑顯色。
2 結(jié)果
2.1eGFP基因的合成、克隆及鑒定含啟動子及終止子的eGFP基因PCR結(jié)果見圖1。XhoⅠ及NheⅠ對eGFP基因片段進(jìn)行雙酶切,SalⅠ及XbaⅠ對pACYC184載體進(jìn)行雙酶切。切膠純化回收后T4連接酶鏈接eGFP片段和pACYC184線性載體合成重組質(zhì)粒pACYC184-eGFP,轉(zhuǎn)化入Top10感受態(tài)大腸埃希菌。挑斑于含有35 mg/L氯霉素的LB液體培養(yǎng)基中搖菌培養(yǎng),設(shè)計測序引物,PCR擴(kuò)增產(chǎn)物測序鑒定,結(jié)果正確。
2.2hok/sok-parDE(HOK)基因的調(diào)取及克隆以pAZ44-H質(zhì)粒為模板,PCR擴(kuò)增獲得HOK基因片段(圖2),重組入pACYC184-eGFP質(zhì)粒并轉(zhuǎn)化入感受態(tài)大腸埃希菌。挑取陽性克隆進(jìn)行抗性培養(yǎng)并PCR擴(kuò)增,產(chǎn)物送測序,結(jié)果正確。
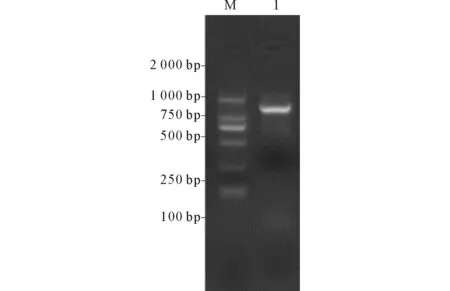
M:Marker;1:多重PCR得到的eGFP基因片段圖1 eGFP基因(含啟動子終止子)PCR擴(kuò)增結(jié)果
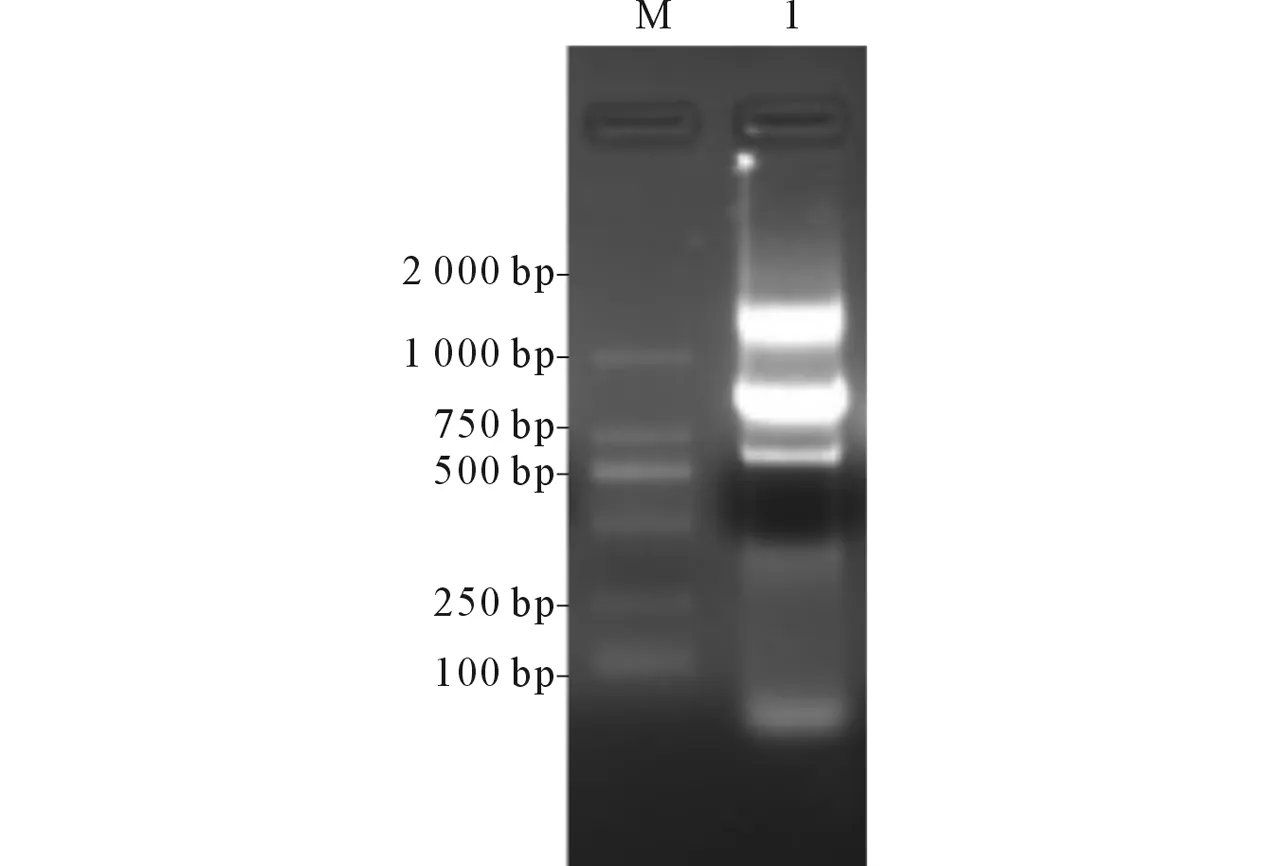
M:Marker;1:HOK基因片段圖2 HOK基因PCR擴(kuò)增結(jié)果
2.3spvB及spvC基因的調(diào)取及克隆以沙門菌基因組DNA為模板,PCR擴(kuò)增獲得spvB和spvC基因片段(圖3)。切膠純化回收PCR產(chǎn)物。T4連接酶鏈接spvB、spvC與pMD19-T載體得到pMD-spvB及pMD-spvC,分別轉(zhuǎn)化入感受態(tài)大腸埃希菌,挑斑于含氨芐青霉素抗性的LB培養(yǎng)基中培養(yǎng)。挑取陽性克隆提取重組質(zhì)粒,NotⅠ單酶切產(chǎn)生一條環(huán)狀條帶,一條略大些的線性DNA,NotⅠ/BglⅡ雙酶切pMD-spvB產(chǎn)生大約1.8 kb的條帶,SalⅠ/NotⅠ雙酶切pMD-spvC產(chǎn)生大約0.72 kb的條帶(見圖4)。切膠純化回收spvB、spvC基因片段及質(zhì)粒進(jìn)行測序鑒定,鑒定正確后,將回收的spvB、spvC基因片段分別和pACYC-eGFP-HOK線性載體重新連接,合成重組質(zhì)粒后轉(zhuǎn)化入感受態(tài)細(xì)菌。挑取陽性克隆于含氯霉素抗性的LB培養(yǎng)基搖菌培養(yǎng),設(shè)計測序引物,PCR擴(kuò)增產(chǎn)物測序鑒定。
2.4平板計數(shù)法測量質(zhì)粒穩(wěn)定性結(jié)果見圖5、6。攜帶質(zhì)粒的細(xì)菌STM.211-c-spvBC培養(yǎng)第2到3代質(zhì)粒開始丟失,第9到10代完全丟失。而攜帶質(zhì)粒STM.211-c-spvBC-eGFP-HOK的細(xì)菌均無明顯的質(zhì)粒丟失。實(shí)驗(yàn)結(jié)果提示,重組質(zhì)粒pACYC184-spvBC-eGFP-HOK因攜帶hok/sok-parD/E質(zhì)粒從而可穩(wěn)定保留,穩(wěn)定性高于重組質(zhì)粒pACYC184-spvBC-eGFP。
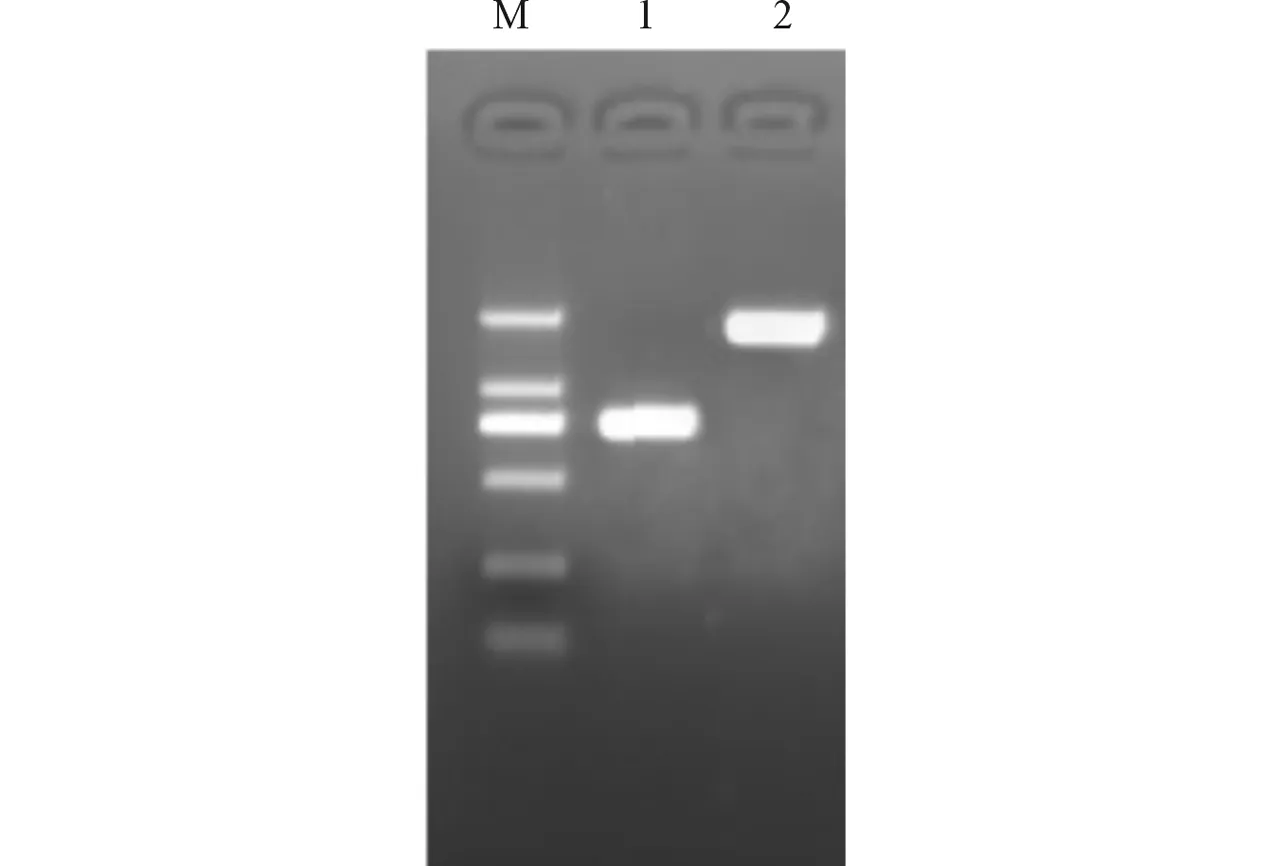
M:Marker;1:spvC基因片段;2:spvB基因片段圖3 spvB、spvC基因PCR擴(kuò)增結(jié)果
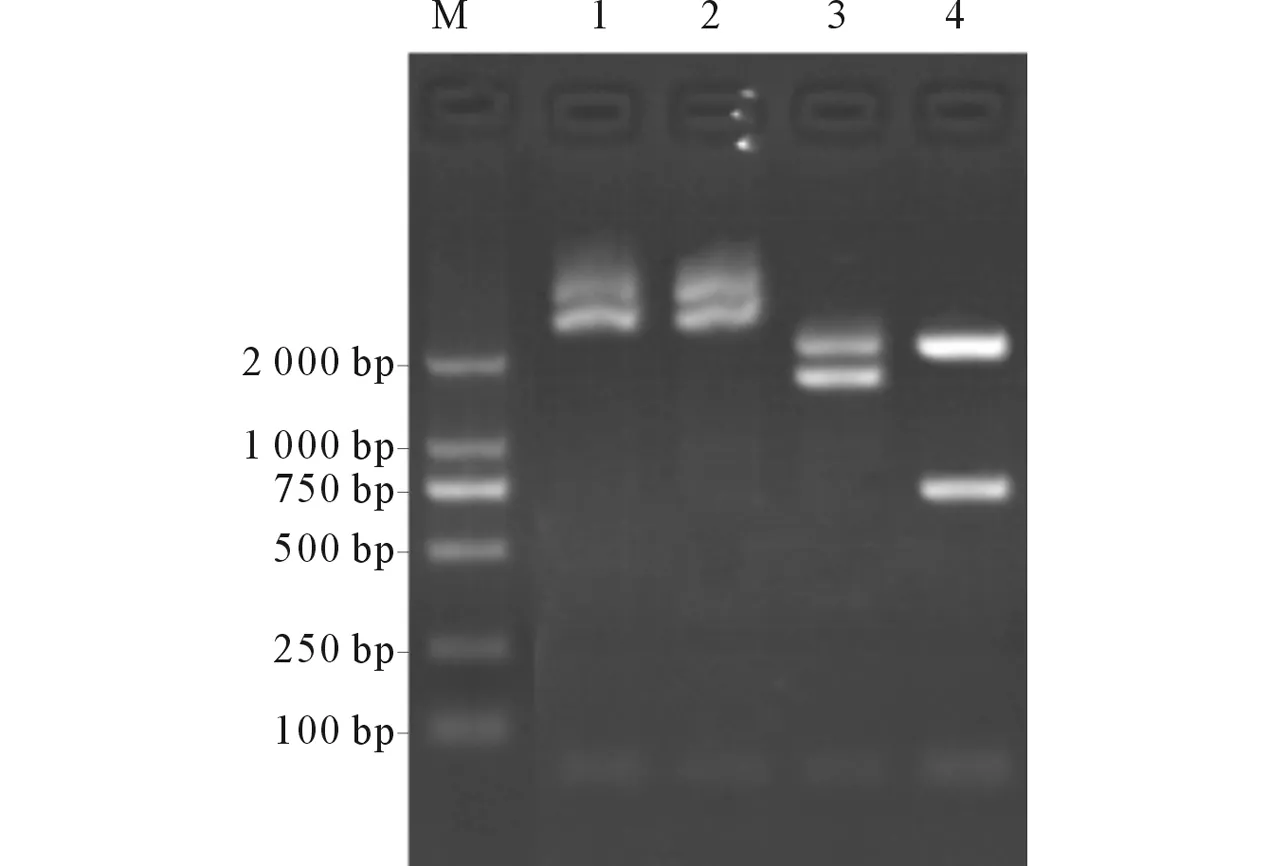
M:Marker;1:單酶切pMD-spvB產(chǎn)物;2:單酶切pMD-spvC產(chǎn)物;3:雙酶切pMD-spvB產(chǎn)物;4: 雙酶切pMD-spvC產(chǎn)物圖4 重組質(zhì)粒pMD-spvB及pMD-spvC的酶切結(jié)果
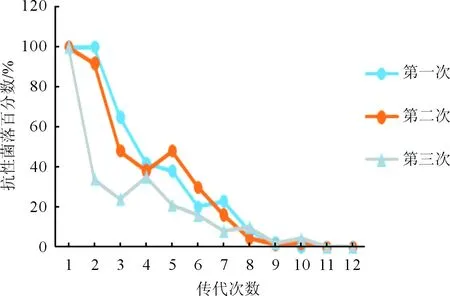
圖5 STM.211-c-spvB培養(yǎng)6 d抗性菌落百分比
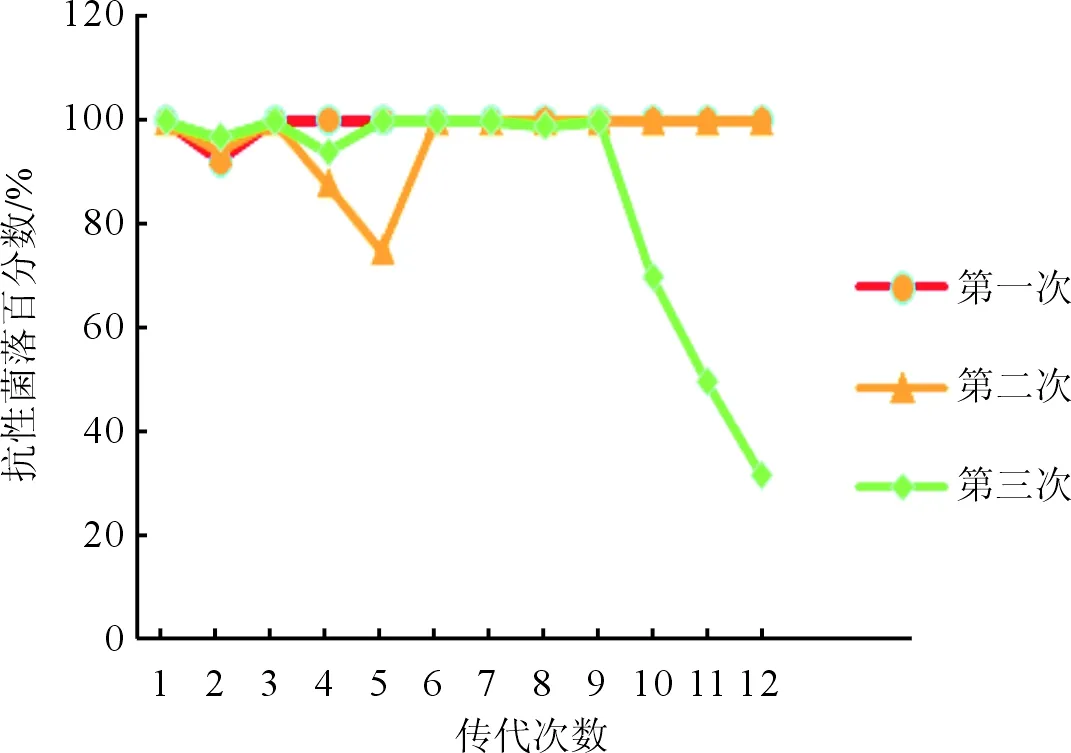
圖6 STM.211-c-spvBC-eGFP-HOK培養(yǎng)6 d抗性菌落百分比
2.5藥物敏感性檢測結(jié)果見表1。STM.211-△-spvBC對阿莫西林克拉維酸鉀、頭孢噻肟、頭孢他啶、頭孢吡肟、頭孢唑啉、慶大霉素及環(huán)丙沙星敏感性優(yōu)于STM.211。所有菌株均對亞胺培南敏感。
2.6外排泵相關(guān)蛋白AcrA、AcrB的表達(dá)見圖7和表2。STM.211-△-spvBC的AcrA蛋白水平低于STM.211及STM.211-c-spvBC(P<0.05);STM.211-△-spvB、STM.211-△-spvC與STM.211-△-spvBC間差異無統(tǒng)計學(xué)意義(P>0.05)。STM.211、STM.211-△-spvB、STM.211-△-spvC、STM.211-△-spvBC、STM.211-c-spvBC間AcrB的表達(dá)差異無統(tǒng)計學(xué)意義(P>0.05)。
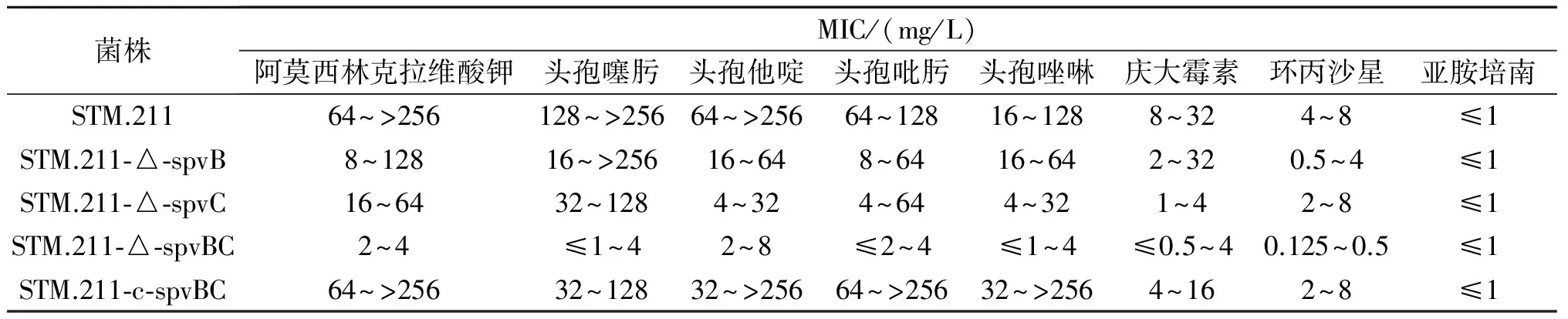
表1 不同抗生素對菌株的MIC值
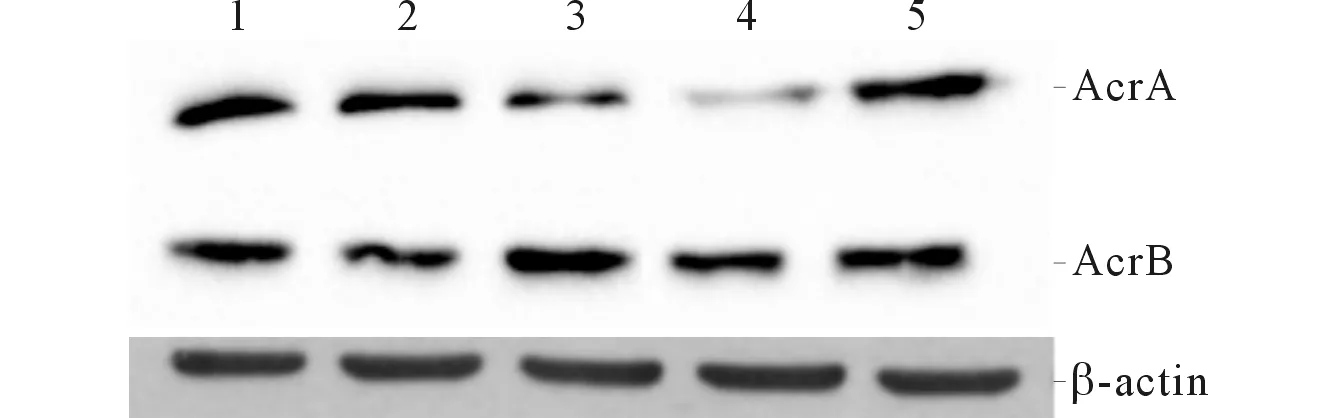
1:STM.211;2:STM.211-△-spvB;3:STM.211-△-spvC;4:STM.211-△-spvBC;5:STM.211-c-spvBC圖7 菌株外排泵相關(guān)蛋白AcrA、AcrB的表達(dá)
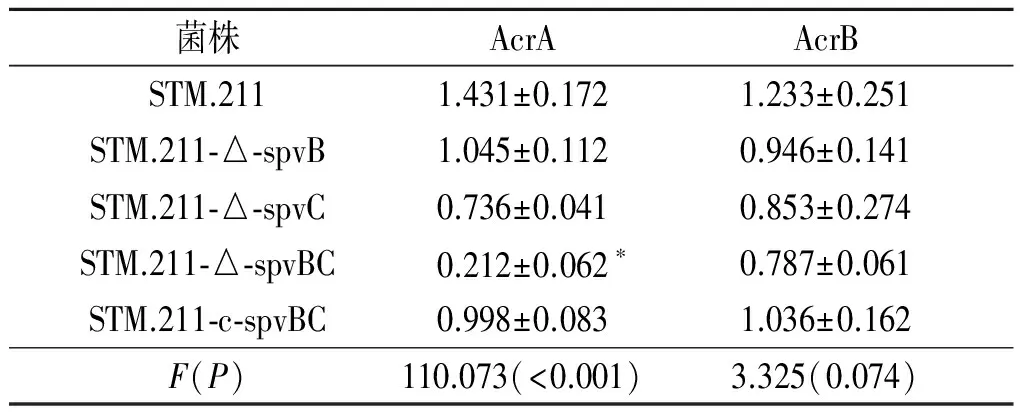
表2 菌株外排泵相關(guān)蛋白AcrA、AcrB表達(dá)量的比較(n=6)
*:與STM.211、STM.211-c-spvBC相比,P<0.05
3 討論
沙門菌作為一種革蘭陰性桿菌,感染人類和動物后常常引起菌血癥、傷寒熱和腸炎等臨床表現(xiàn),據(jù)報道,歐洲每年至少約350 000例感染患者[6],而在美國每年約200 000例,而實(shí)際上,感染的真正人群則高出這個數(shù)字3倍[7]。沙門菌的耐藥現(xiàn)象日益嚴(yán)峻,增加了臨床治療的難度。既往研究集中在研究細(xì)菌耐藥機(jī)制上,近年來,在人類微生物群日益受到關(guān)注的大背景下,科學(xué)家們重拾用噬菌體來治療細(xì)菌感染的興趣,但通過改變細(xì)菌毒力來逆轉(zhuǎn)細(xì)菌耐藥表型目前尚未見報道。課題組前期以從腹瀉兒童糞便中分離的耐藥鼠傷寒沙門菌為研究對象,利用自殺質(zhì)粒構(gòu)建沙門菌spvBC缺陷菌株并測序鑒定,體內(nèi)外實(shí)驗(yàn)表明spvBC缺陷后鼠傷寒沙門菌毒力下降。本研究中作者使用電轉(zhuǎn)化技術(shù)構(gòu)建spvBC回補(bǔ)株并比較菌株間耐藥性差異及耐藥相關(guān)蛋白表達(dá)的異同。
在重組細(xì)菌中,高拷貝質(zhì)粒因?yàn)橥粗亟M后復(fù)制擴(kuò)增導(dǎo)致“二聚體災(zāi)難”形成質(zhì)粒二聚體,代謝符合增加導(dǎo)致穩(wěn)定性下降[8]。低拷貝質(zhì)粒能穩(wěn)定表達(dá)目的基因組,但拷貝數(shù)低,分離過程不能穩(wěn)定持有。啟動子轉(zhuǎn)錄翻譯過程中啟動子功能可能受到抑制[9],在轉(zhuǎn)錄下游增加轉(zhuǎn)錄終止子可以增加mRNA的穩(wěn)定性,因此,本課題組采用Trp及Lac啟動子雜合拼接成的Trc啟動子和高效表達(dá)目的基因所必需的rrnB ribosomal 終止子人工合成eGFP以獲得更高轉(zhuǎn)錄效率。構(gòu)建重組質(zhì)粒過程中,往往因編碼基因增加宿主細(xì)胞的代謝負(fù)荷導(dǎo)致質(zhì)粒易于丟失穩(wěn)定性差,目前可使用以下3種途徑來增加質(zhì)粒穩(wěn)定性:以抗生素作為選擇壓力的質(zhì)粒載體系統(tǒng)(人、動物體內(nèi)無法實(shí)現(xiàn)且有導(dǎo)致抗藥菌擴(kuò)散的風(fēng)險);染色體-質(zhì)粒平衡致死系統(tǒng)(對培養(yǎng)基、細(xì)菌種屬、基因型有所要求而限制其使用);質(zhì)粒解離后致死系統(tǒng)(post segregational killing system,PSK )。本實(shí)驗(yàn)使用的hok/sok-parDE質(zhì)粒穩(wěn)定系統(tǒng)即是PSK中的經(jīng)典之作,hok/sok和parD/E分屬兩個獨(dú)立的平衡致死系統(tǒng),hok基因和parE基因分別編碼兩種毒力蛋白,sok和parD能拮抗他們的毒性作用。在含質(zhì)粒的細(xì)胞中,sok RNA通過與hok mRNA結(jié)合抑制hok mRNA的表達(dá),parD能抑制parE的轉(zhuǎn)錄、翻譯及其毒力效應(yīng),細(xì)胞維持了穩(wěn)態(tài)。當(dāng)細(xì)胞質(zhì)粒丟失,sok RNA及parD逐漸降解,Hok和ParE在細(xì)胞中聚集,產(chǎn)生毒力蛋白使細(xì)胞裂解死亡。hok/sok和parDE組合系統(tǒng)比hok/sok或parDE單一系統(tǒng)具有更強(qiáng)的質(zhì)粒穩(wěn)定作用[10]。本研究使用hok/sok-parDE質(zhì)粒穩(wěn)定系統(tǒng)將融合基因插入編碼eGFP蛋白的質(zhì)粒中得到重組質(zhì)粒pACYC184-eGFP-HOK,然后向預(yù)留的酶切位點(diǎn)中插入目的基因spvBC,重組質(zhì)粒pACYC184-spvB-eGFP-HOK 和pACYC184-spvC-eGFP-HOK成功構(gòu)建后將其電轉(zhuǎn)化入感受態(tài)細(xì)菌構(gòu)建回補(bǔ)株,對重組質(zhì)粒穩(wěn)定性研究表明,含hok/sok-parDE質(zhì)粒的菌株所攜帶的質(zhì)粒穩(wěn)定持有,質(zhì)粒無明顯丟失,而不含該系統(tǒng)的質(zhì)粒在傳2至3代后出現(xiàn)質(zhì)粒丟失的現(xiàn)象。經(jīng)基因測序證實(shí)鼠傷寒沙門菌熒光表達(dá)載體pACYC184-eGFP-HOK、pACYC184-spvB-eGFP-HOK、pACYC184-spvC-eGFP-HOK及spvBC缺陷株的回補(bǔ)株均成功構(gòu)建。
解決重組細(xì)菌的技術(shù)難題后,構(gòu)建菌株及野生菌株的藥敏試驗(yàn)顯示,鼠傷寒沙門菌spvBC缺陷后菌株對β-內(nèi)酰胺類、氟喹諾酮類、氨基糖甙類的代表藥物敏感性均明顯增強(qiáng)。既往研究[11]發(fā)現(xiàn)宿主抗性因子Nramp1能上調(diào)致病島-2毒力基因的表達(dá),而AcrD的滅活導(dǎo)致與基礎(chǔ)代謝、毒力和應(yīng)激應(yīng)答在內(nèi)的基本過程相關(guān)的403種基因表達(dá)的改變[12]:細(xì)菌的耐藥與毒力間并非“各行其道”而是相互影響,細(xì)菌的耐藥機(jī)制中主要的外排泵除能將抗生素泵出外也能將機(jī)體遭受細(xì)菌感染后分泌的膽汁、激素及宿主防御因子泵出以利于細(xì)菌對宿主細(xì)胞的侵襲[13],故宿主抗性因子及外排泵的存在有助于細(xì)菌在宿主體內(nèi)的存活、侵襲、運(yùn)動等生物特性。本研究結(jié)果顯示:spv的缺陷能改變鼠傷寒沙門菌的耐藥表型,非傷寒沙門菌中普遍存在質(zhì)粒spv,大小約50~90 kb,與細(xì)菌黏附、運(yùn)動、血清抗性及定居有關(guān)[14]。黃瑞等[15]研究表明,分離自傷寒沙門菌的耐藥質(zhì)粒pRsT98上的spvR和spvB與鼠傷寒沙門菌的spv有大于99%的同源性。spv作為細(xì)菌某些耐藥機(jī)制的上游發(fā)揮作用抑或spv與耐藥相關(guān)因子有相同的作用位點(diǎn)目前尚未明了。本研究隨后對導(dǎo)致細(xì)菌耐藥外排泵中研究得最多的AcrA/B蛋白進(jìn)行檢測,結(jié)果發(fā)現(xiàn)spvBC基因缺陷菌株的AcrA蛋白水平低于野生菌株及spvBC缺陷回補(bǔ)株,這表明spvBC的缺陷能下調(diào)AcrA蛋白的表達(dá),而spvBC的回補(bǔ)能解除對AcrA蛋白的表達(dá)的抑制。
眾所周知,作為一種典型的外流泵系統(tǒng),AcrA/B-TolC外排泵系統(tǒng)能將代謝產(chǎn)物或抗生素等有毒物質(zhì)泵出細(xì)胞外并抑制孔蛋白表達(dá),使抗生素?zé)o法進(jìn)入細(xì)菌內(nèi)發(fā)揮作用以應(yīng)對環(huán)境壓力適者生存[16]。spv作為一種毒力基因是通過何種途徑來影響AcrA蛋白的表達(dá)?與此同時,spv表達(dá)的改變在影響AcrA蛋白的表達(dá)的同時AcrB蛋白的表達(dá)卻未受到影響等均有待進(jìn)一步的研究。下一步課題組將檢測AcrAB的外流通道外膜蛋白TolC及調(diào)控基因acrR、ramA、marA等的表達(dá)情況,以進(jìn)一步探討毒力基因spv改變耐藥表型的機(jī)制,為將spv作為逆轉(zhuǎn)鼠傷寒沙門菌耐藥的分子靶標(biāo)打下實(shí)驗(yàn)基礎(chǔ)。
[1] BRENT AJ,OUNDO JO,MWANGI I,et al.Salmonellabacteremia in Kenyan children[J].Pediatr Infect Dis,2006,25(3):230
[2] 陳強(qiáng),余曉君,李俏俏,等.引起兒童腹瀉的沙門菌屬臨床分離株的耐藥特點(diǎn)及分子流行病學(xué)研究[J].中華檢驗(yàn)醫(yī)學(xué)雜志,2011,34(3):249
[3] 吳春雪,陳強(qiáng),李紅,等.鼠傷寒沙門菌spvB基因缺陷變異株的制備及其抗酸能力檢測[J].華中科技大學(xué)學(xué)報(醫(yī)學(xué)版),2014,43(4):399
[4] 陳強(qiáng),吳春雪,余曉君,等.鼠傷寒沙門菌spvC基因缺陷變異株的制備[J].江蘇大學(xué)學(xué)報(醫(yī)學(xué)版),2014,24(3):235
[5] 劉曉艷,陳強(qiáng),李紅,等.spvB/spvC基因?qū)ι抽T菌毒力及宿主免疫功能的影響[J].南方醫(yī)科大學(xué)學(xué)報,2015,35(11):1649
[6] FISHER IST.International trends inSalmonellaserotypes 1998-2003: a surveillance report from the enter-net internationalsurveillance network[J].Euro Surveill 2004,9(11):9
[7] HARVEY RR,FRIEDMAN CR,CRIM SM,et al.Epidemiology ofSalmonellaenterica serotype dublin infections among Humans, United States, 1968-2013[J].Emerg Infect Dis,2017,23(9):1493
[8] FIELD CM,SUMMERS DK.Multicopy plasmid stability:revisiting the dimer catastrophe[J].J Theor Biol,2011,291:119
[9] LOBATO-MRQUEZ D,MOLINA-GARCA L,MORENO-CRDOBA I,et al.Stabilization of the virulence plasmid pSLT ofSalmonellatyphimuriumby three maintenance systems and its evaluation by using a new stability test[J].Front Mol Biosci,2016,17(3):66
[10]GONG CC,KLUMPP S.MODELING sRNA-regulated plasmid maintenance[J].PLoS One,2017,12(1):e0169703
[11]ZAHARIK ML,VALLANCE BA,PUENTE JL,et al.Host-pathogen interactions:host resistance factor Nramp1 up-regulates the expression ofSalmonellapathogenicity island-2 virulence genes[J].Proc Natl Acad Sci USA,2002,99(24):15705
[12]BUCKNER MM,BLAIR JM,LA RAGIONE RM,et al.Beyond antimicrobial resistance:evidence for a distinct role of the AcrD efflux pump inSalmonellabiology[J].MBio,2016,7(6):16
[13]CHEN Y,HU DX,ZHANG QJ,et al.Efflux pump overexpression contributes to tigecycline heteroresistance inSalmonellaenterica serovar Typhimurium[J].Front Cell Infect Microbiol,2017,7:37
[14]WU SY,WANG LD,LI JL,et al.Salmonellaspv locus suppresses host innate immune responses to bacterial infection[J].Fish Shellfish Immunol,2016,58:387
[15]黃瑞,吳淑燕,張學(xué)光.傷寒桿菌耐藥質(zhì)粒pRsags毒力基因的研究[J].中華微生物學(xué)和免疫學(xué)雜志,2003,23(5):393
[16]WESTON N,SHARMA P,RICCI V,et al.Regulation of the AcrAB-TolC efflux pump inEnterobacteriaceae[J].Res Microbiol,2017.doi:10.1016/j.resmic.2017.10.005
猜你喜歡
如何判斷靶向治療耐藥保健醫(yī)苑(2022年5期)2022-06-10 07:46:38 Ibalizumab治療成人多耐藥HIV-1感染的研究進(jìn)展現(xiàn)代臨床醫(yī)學(xué)(2022年3期)2022-06-06 07:59:40 miR-181a在卵巢癌細(xì)胞中對順鉑的耐藥作用昆明醫(yī)科大學(xué)學(xué)報(2022年1期)2022-02-28 07:43:40 鉑耐藥復(fù)發(fā)性卵巢癌的治療進(jìn)展天津醫(yī)科大學(xué)學(xué)報(2021年3期)2021-07-21 09:04:02 超級耐藥菌威脅全球,到底是誰惹的禍?科學(xué)大眾(2020年12期)2020-08-13 03:22:22 嬰幼兒感染中的耐藥菌分布及耐藥性分析云南醫(yī)藥(2019年3期)2019-07-25 07:25:10 念珠菌耐藥機(jī)制研究進(jìn)展現(xiàn)代檢驗(yàn)醫(yī)學(xué)雜志(2016年1期)2016-11-12 13:19:40 耐藥基因新聞國外醫(yī)藥(抗生素分冊)(2016年6期)2016-07-10 11:34:45 無縫隙管理模式對ICU多重耐藥菌發(fā)生率的影響中國衛(wèi)生標(biāo)準(zhǔn)管理(2015年14期)2016-01-15 02:58:37 PDCA循環(huán)法在多重耐藥菌感染監(jiān)控中的應(yīng)用中國當(dāng)代醫(yī)藥(2015年17期)2015-03-01 02:03:58
朱春暉,王文杏,陳 強(qiáng),陳慶法,吳春雪,劉曉艷,賴華毅,余曉君
1)江西省兒童醫(yī)院感染科 南昌 330006 2)江西省兒童醫(yī)院內(nèi)科 南昌 330006 3)江西省兒童醫(yī)院檢驗(yàn)科 南昌 330006
沙門菌是一組寄生于人類和動物腸道內(nèi)生化反應(yīng)和抗原構(gòu)造相似的革蘭陰性桿菌,除可以引起傷寒、副傷寒外,也是人類細(xì)菌性食物中毒、腹瀉、菌血癥和敗血癥的主要病原體。菌血癥和敗血癥嚴(yán)重威脅著人類健康,在免疫功能未發(fā)育完善的兒童中病死率極高。據(jù)不完全統(tǒng)計,沙門菌每年造成全球約750萬兒童感染病例,在非洲地區(qū)沙門菌感染在兒童中的死亡率甚至高達(dá)24%[1]。本課題組前期研究[2]結(jié)果表明,江西地區(qū)腹瀉兒童大便中沙門菌分離率高,其中鼠傷寒沙門菌為主要血清型,耐藥現(xiàn)象嚴(yán)重。2013世界經(jīng)濟(jì)論壇全球風(fēng)險報告將抗生素耐藥細(xì)菌列為人類健康最大危害之一。因此,沙門菌耐藥機(jī)制的研究顯得尤為重要。據(jù)此,本課題組構(gòu)建穩(wěn)定的沙門菌表達(dá)載體,并在前期使用同源重組法制備鼠傷寒沙門菌質(zhì)粒毒力基因(Salmonellaplasmid virulence genes,spv)基因缺陷株[3-5]基礎(chǔ)上構(gòu)建鼠傷寒沙門菌spv回補(bǔ)株,分析菌株間耐藥表型的差異,并探討其可能機(jī)制,為逆轉(zhuǎn)鼠傷寒沙門菌耐藥提供新的分子靶標(biāo)。
1 材料與方法
1.1質(zhì)粒、菌株、酶類和主要試劑野生型鼠傷寒沙門菌株STM.211為前期從臨床腹瀉患者糞便中分離并由江西省兒童醫(yī)院微生物室保存的臨床分離株(藥敏試驗(yàn)提示對阿莫西林克拉維酸鉀、頭孢噻肟、頭孢他啶、頭孢吡肟、頭孢唑啉、慶大霉素、環(huán)丙沙星耐藥);spvB基因缺陷株STM.211-△-spvB、spvC基因缺陷株STM.211-△-spvC和spvB及spvC基因共同缺陷株STM.211-△-spvBC(課題組前期研究構(gòu)建,并保存);大腸埃希菌Top10購自天根生化科技(北京)有限公司;pMD19-T克隆載體購自大連TaKaRa公司;pACYC184克隆載體購自南通麥杰生物科技有限公司;pAZ44-H質(zhì)粒由華中農(nóng)業(yè)大學(xué)農(nóng)業(yè)微生物學(xué)國家重點(diǎn)實(shí)驗(yàn)室郭愛珍教授惠贈。限制性內(nèi)切酶SalⅠ、SphⅠ、T4 DNA連接酶、EcoRⅠ、EcoRⅤ、DMEM培養(yǎng)基及胎牛血清購自Hyclone公司,質(zhì)粒提取試劑盒、DNA 膠 回收試劑盒、RT-PCR試劑盒購自Promega 公司,細(xì)菌基因組 DNA 提取試劑盒(離心柱)購自天根生化科技(北京)有限公司,DNA 聚合酶試劑盒購自Qiagen 公司,脂質(zhì)體Lipofectamine及總RNA提取試劑購自Invitrogen公司,PCR引物由TaKaRa合成,DNA 分子質(zhì)量標(biāo)準(zhǔn)Marker 購自生工生物工程(上海)股份有限公司。
1.2eGFP基因的合成及克隆根據(jù)GenBank中的增強(qiáng)綠色熒光蛋白(enhanced green fluroscent protein,eGFP)基因序列,在上游增加Trc Promoter啟動子序列,下游增加rrnB ribosomal終止子序列,位點(diǎn)上游增加XhoⅠ和XbaⅠ酶切位點(diǎn),下游增加NheⅠ酶切位點(diǎn)。設(shè)計引物序列,由生工生物工程(上海)股份有限公司完成合成。以設(shè)計合成的引物E1至E26各10 μL混合物為模板,進(jìn)行PCR預(yù)擴(kuò)增。取PCR產(chǎn)物為模板,用E1和E26進(jìn)行PCR擴(kuò)增,獲得含啟動子和終止子的eGFP基因,割膠純化產(chǎn)物,用XhoⅠ、NheⅠ和SalⅠ、XbaⅠ對PCR產(chǎn)物和pACYC184載體進(jìn)行雙酶切,電泳分離目的基因,對目的條帶割膠純化后用T4連接酶進(jìn)行定向連接以構(gòu)建pACYC184-eGFP,轉(zhuǎn)至Top10感受態(tài)細(xì)菌,氯霉素篩選陽性克隆,PCR檢測并測序鑒定。
1.3hok/sok-parDE(HOK)基因的調(diào)取及克隆以pAZ44-H質(zhì)粒為模板,用HOK正反義引物進(jìn)行PCR擴(kuò)增獲取aphA-hok-parDE基因,割膠純化產(chǎn)物后用NheⅠ和XbaⅠ對產(chǎn)物和pACYC184-eGFP載體進(jìn)行酶切,電泳分離目的基因后,割膠純化,用T4連接酶進(jìn)行定向連接構(gòu)建pACYC184-eGFP-HOK載體,轉(zhuǎn)化至E.coli Top10感受態(tài)細(xì)菌,氯霉素、卡那霉素雙抗篩選陽性克隆,PCR檢測并測序鑒定證實(shí)載體構(gòu)建的正確性。
1.4spvB及spvC基因的調(diào)取及克隆根據(jù)GenBank中公布的鼠傷寒沙門菌spvB、spvC基因的上、下游核苷酸序列,以沙門菌基因組DNA為模板進(jìn)行PCR擴(kuò)增,獲取spvB、spvC基因,割膠純化產(chǎn)物,分別克隆至pMD19-T獲得pMD-spvB和 pMD-spvC質(zhì)粒,轉(zhuǎn)至Top10感受態(tài)細(xì)菌,篩選陽性克隆后用BglⅡ、NotⅠ和SalⅠ、NotⅠ進(jìn)行雙酶切驗(yàn)證并測序鑒定。
使用限制性內(nèi)切酶對質(zhì)粒pMD-spvB、pMD-spvC及pACYC184-eGFP-HOK進(jìn)行酶切,電泳分離目的基因后進(jìn)行割膠純化,用T4連接酶進(jìn)行定向連接,構(gòu)建pACYC184-spvB-eGFP-HOK和pACYC184-spvC-eGFP-HOK載體,轉(zhuǎn)至Top10感受態(tài)細(xì)菌,氯霉素、卡那霉素雙抗篩選陽性克隆,PCR檢測并測序鑒定。
1.5spvB及spvC回補(bǔ)株STM.211-c-spvBC的構(gòu)建及鑒定將pACYC184-eGFP、pACYC184-spvB-eGFP-HOK、pACYC184-spvC-eGFP-HOK質(zhì)粒DNA與電感受態(tài)STM.211-△-spvBC輕吸混勻制備混合物,加入預(yù)冷的電擊杯中,排除氣泡,使用2 100 V電擊混合物,然后迅速加入無抗LB培養(yǎng)液中,吹吸混勻并轉(zhuǎn)移到1.5 mL離心管中,取重懸菌液均勻涂布于含50 mg/L卡那霉素和氯霉素的LB固體培養(yǎng)基平板上,倒置平板,37 ℃ 20 h。重組菌經(jīng)PCR測序鑒定后命名為STM.211-c-spvBC、STM.211-c-spvBC-HOK。
1.6質(zhì)粒穩(wěn)定性評價分別挑取STM.211-c-spvBC、STM.211-c-spvBC-HOK單菌落接種于含有100 mg/L卡那霉素的LB液體培養(yǎng)基,37 ℃ 200 r/ min振搖培養(yǎng),使菌液的A600 nm達(dá)到0.1~0 .3,取10 μL菌液轉(zhuǎn)接到10 mL無抗性LB的液體培養(yǎng)基中,37 ℃振蕩培養(yǎng)。每12 h傳代1次,連續(xù)培養(yǎng)6 d,轉(zhuǎn)接的同時將菌液進(jìn)行倍比稀釋。取適當(dāng)稀釋度的菌液分別涂布在LB固體平板和卡那霉素/氯霉素雙抗瓊脂平板后統(tǒng)計菌落數(shù),每個平板涂10 μL菌液,每個稀釋度重復(fù)3次,計數(shù)LB平板菌落數(shù),計數(shù)雙抗平板帶質(zhì)粒的菌落數(shù),二者比值為抗性菌落百分?jǐn)?shù),用以評價質(zhì)粒穩(wěn)定性。實(shí)驗(yàn)重復(fù)3 次。采用標(biāo)準(zhǔn)堿裂解法抽提質(zhì)粒確定質(zhì)粒存在。
1.7藥物敏感性實(shí)驗(yàn)根據(jù)美國臨床實(shí)驗(yàn)室標(biāo)準(zhǔn)委員會(NCCLS)標(biāo)準(zhǔn)應(yīng)用瓊脂平板稀釋法檢測菌株(STM.211、STM.211-△-spvB、STM.211-△-spvC、STM.211-△-spvBC、STM.211-c-spvBC)對臨床常用抗生素的最小抑菌濃度(minimal inhibit concentration,MIC),參照NCCLS2004年標(biāo)準(zhǔn)判斷結(jié)果。質(zhì)控菌為大腸埃希菌ATCC25922。
1.8外排泵相關(guān)蛋白AcrA和AcrB的Westernblot檢測待毒力基因spv缺陷株、毒力基因spv回補(bǔ)株及野生菌株的菌液生長至A600 nm=0.6~0.8,離心收集細(xì)胞,沉淀用離解液[20 nmol/L Tri-鹽酸(pH=8.0),100 mmol/L氯化鈉,30%甘油,AEBSF, 1 mmol/L依地酸(EDTA,pH=8.0)]懸浮,超聲破細(xì)胞。用Bradford法測定總蛋白濃度,小牛血清白蛋白定標(biāo),行SDS-PAGE,將蛋白在25 V 電壓下電轉(zhuǎn)移30 min(檢測AcrB時,采用電壓20 V,20 min),然后移至硝酸纖維素膜上,再先后與抗AcrA抗體或抗AcrB抗體(1200)及HRP標(biāo)記的抗兔 IgG 二抗雜交,化學(xué)發(fā)光試劑顯色。
2 結(jié)果
2.1eGFP基因的合成、克隆及鑒定含啟動子及終止子的eGFP基因PCR結(jié)果見圖1。XhoⅠ及NheⅠ對eGFP基因片段進(jìn)行雙酶切,SalⅠ及XbaⅠ對pACYC184載體進(jìn)行雙酶切。切膠純化回收后T4連接酶鏈接eGFP片段和pACYC184線性載體合成重組質(zhì)粒pACYC184-eGFP,轉(zhuǎn)化入Top10感受態(tài)大腸埃希菌。挑斑于含有35 mg/L氯霉素的LB液體培養(yǎng)基中搖菌培養(yǎng),設(shè)計測序引物,PCR擴(kuò)增產(chǎn)物測序鑒定,結(jié)果正確。
2.2hok/sok-parDE(HOK)基因的調(diào)取及克隆以pAZ44-H質(zhì)粒為模板,PCR擴(kuò)增獲得HOK基因片段(圖2),重組入pACYC184-eGFP質(zhì)粒并轉(zhuǎn)化入感受態(tài)大腸埃希菌。挑取陽性克隆進(jìn)行抗性培養(yǎng)并PCR擴(kuò)增,產(chǎn)物送測序,結(jié)果正確。

M:Marker;1:多重PCR得到的eGFP基因片段圖1 eGFP基因(含啟動子終止子)PCR擴(kuò)增結(jié)果

M:Marker;1:HOK基因片段圖2 HOK基因PCR擴(kuò)增結(jié)果
2.3spvB及spvC基因的調(diào)取及克隆以沙門菌基因組DNA為模板,PCR擴(kuò)增獲得spvB和spvC基因片段(圖3)。切膠純化回收PCR產(chǎn)物。T4連接酶鏈接spvB、spvC與pMD19-T載體得到pMD-spvB及pMD-spvC,分別轉(zhuǎn)化入感受態(tài)大腸埃希菌,挑斑于含氨芐青霉素抗性的LB培養(yǎng)基中培養(yǎng)。挑取陽性克隆提取重組質(zhì)粒,NotⅠ單酶切產(chǎn)生一條環(huán)狀條帶,一條略大些的線性DNA,NotⅠ/BglⅡ雙酶切pMD-spvB產(chǎn)生大約1.8 kb的條帶,SalⅠ/NotⅠ雙酶切pMD-spvC產(chǎn)生大約0.72 kb的條帶(見圖4)。切膠純化回收spvB、spvC基因片段及質(zhì)粒進(jìn)行測序鑒定,鑒定正確后,將回收的spvB、spvC基因片段分別和pACYC-eGFP-HOK線性載體重新連接,合成重組質(zhì)粒后轉(zhuǎn)化入感受態(tài)細(xì)菌。挑取陽性克隆于含氯霉素抗性的LB培養(yǎng)基搖菌培養(yǎng),設(shè)計測序引物,PCR擴(kuò)增產(chǎn)物測序鑒定。
2.4平板計數(shù)法測量質(zhì)粒穩(wěn)定性結(jié)果見圖5、6。攜帶質(zhì)粒的細(xì)菌STM.211-c-spvBC培養(yǎng)第2到3代質(zhì)粒開始丟失,第9到10代完全丟失。而攜帶質(zhì)粒STM.211-c-spvBC-eGFP-HOK的細(xì)菌均無明顯的質(zhì)粒丟失。實(shí)驗(yàn)結(jié)果提示,重組質(zhì)粒pACYC184-spvBC-eGFP-HOK因攜帶hok/sok-parD/E質(zhì)粒從而可穩(wěn)定保留,穩(wěn)定性高于重組質(zhì)粒pACYC184-spvBC-eGFP。

M:Marker;1:spvC基因片段;2:spvB基因片段圖3 spvB、spvC基因PCR擴(kuò)增結(jié)果

M:Marker;1:單酶切pMD-spvB產(chǎn)物;2:單酶切pMD-spvC產(chǎn)物;3:雙酶切pMD-spvB產(chǎn)物;4: 雙酶切pMD-spvC產(chǎn)物圖4 重組質(zhì)粒pMD-spvB及pMD-spvC的酶切結(jié)果

圖5 STM.211-c-spvB培養(yǎng)6 d抗性菌落百分比

圖6 STM.211-c-spvBC-eGFP-HOK培養(yǎng)6 d抗性菌落百分比
2.5藥物敏感性檢測結(jié)果見表1。STM.211-△-spvBC對阿莫西林克拉維酸鉀、頭孢噻肟、頭孢他啶、頭孢吡肟、頭孢唑啉、慶大霉素及環(huán)丙沙星敏感性優(yōu)于STM.211。所有菌株均對亞胺培南敏感。
2.6外排泵相關(guān)蛋白AcrA、AcrB的表達(dá)見圖7和表2。STM.211-△-spvBC的AcrA蛋白水平低于STM.211及STM.211-c-spvBC(P<0.05);STM.211-△-spvB、STM.211-△-spvC與STM.211-△-spvBC間差異無統(tǒng)計學(xué)意義(P>0.05)。STM.211、STM.211-△-spvB、STM.211-△-spvC、STM.211-△-spvBC、STM.211-c-spvBC間AcrB的表達(dá)差異無統(tǒng)計學(xué)意義(P>0.05)。

表1 不同抗生素對菌株的MIC值

1:STM.211;2:STM.211-△-spvB;3:STM.211-△-spvC;4:STM.211-△-spvBC;5:STM.211-c-spvBC圖7 菌株外排泵相關(guān)蛋白AcrA、AcrB的表達(dá)

表2 菌株外排泵相關(guān)蛋白AcrA、AcrB表達(dá)量的比較(n=6)
*:與STM.211、STM.211-c-spvBC相比,P<0.05
3 討論
沙門菌作為一種革蘭陰性桿菌,感染人類和動物后常常引起菌血癥、傷寒熱和腸炎等臨床表現(xiàn),據(jù)報道,歐洲每年至少約350 000例感染患者[6],而在美國每年約200 000例,而實(shí)際上,感染的真正人群則高出這個數(shù)字3倍[7]。沙門菌的耐藥現(xiàn)象日益嚴(yán)峻,增加了臨床治療的難度。既往研究集中在研究細(xì)菌耐藥機(jī)制上,近年來,在人類微生物群日益受到關(guān)注的大背景下,科學(xué)家們重拾用噬菌體來治療細(xì)菌感染的興趣,但通過改變細(xì)菌毒力來逆轉(zhuǎn)細(xì)菌耐藥表型目前尚未見報道。課題組前期以從腹瀉兒童糞便中分離的耐藥鼠傷寒沙門菌為研究對象,利用自殺質(zhì)粒構(gòu)建沙門菌spvBC缺陷菌株并測序鑒定,體內(nèi)外實(shí)驗(yàn)表明spvBC缺陷后鼠傷寒沙門菌毒力下降。本研究中作者使用電轉(zhuǎn)化技術(shù)構(gòu)建spvBC回補(bǔ)株并比較菌株間耐藥性差異及耐藥相關(guān)蛋白表達(dá)的異同。
在重組細(xì)菌中,高拷貝質(zhì)粒因?yàn)橥粗亟M后復(fù)制擴(kuò)增導(dǎo)致“二聚體災(zāi)難”形成質(zhì)粒二聚體,代謝符合增加導(dǎo)致穩(wěn)定性下降[8]。低拷貝質(zhì)粒能穩(wěn)定表達(dá)目的基因組,但拷貝數(shù)低,分離過程不能穩(wěn)定持有。啟動子轉(zhuǎn)錄翻譯過程中啟動子功能可能受到抑制[9],在轉(zhuǎn)錄下游增加轉(zhuǎn)錄終止子可以增加mRNA的穩(wěn)定性,因此,本課題組采用Trp及Lac啟動子雜合拼接成的Trc啟動子和高效表達(dá)目的基因所必需的rrnB ribosomal 終止子人工合成eGFP以獲得更高轉(zhuǎn)錄效率。構(gòu)建重組質(zhì)粒過程中,往往因編碼基因增加宿主細(xì)胞的代謝負(fù)荷導(dǎo)致質(zhì)粒易于丟失穩(wěn)定性差,目前可使用以下3種途徑來增加質(zhì)粒穩(wěn)定性:以抗生素作為選擇壓力的質(zhì)粒載體系統(tǒng)(人、動物體內(nèi)無法實(shí)現(xiàn)且有導(dǎo)致抗藥菌擴(kuò)散的風(fēng)險);染色體-質(zhì)粒平衡致死系統(tǒng)(對培養(yǎng)基、細(xì)菌種屬、基因型有所要求而限制其使用);質(zhì)粒解離后致死系統(tǒng)(post segregational killing system,PSK )。本實(shí)驗(yàn)使用的hok/sok-parDE質(zhì)粒穩(wěn)定系統(tǒng)即是PSK中的經(jīng)典之作,hok/sok和parD/E分屬兩個獨(dú)立的平衡致死系統(tǒng),hok基因和parE基因分別編碼兩種毒力蛋白,sok和parD能拮抗他們的毒性作用。在含質(zhì)粒的細(xì)胞中,sok RNA通過與hok mRNA結(jié)合抑制hok mRNA的表達(dá),parD能抑制parE的轉(zhuǎn)錄、翻譯及其毒力效應(yīng),細(xì)胞維持了穩(wěn)態(tài)。當(dāng)細(xì)胞質(zhì)粒丟失,sok RNA及parD逐漸降解,Hok和ParE在細(xì)胞中聚集,產(chǎn)生毒力蛋白使細(xì)胞裂解死亡。hok/sok和parDE組合系統(tǒng)比hok/sok或parDE單一系統(tǒng)具有更強(qiáng)的質(zhì)粒穩(wěn)定作用[10]。本研究使用hok/sok-parDE質(zhì)粒穩(wěn)定系統(tǒng)將融合基因插入編碼eGFP蛋白的質(zhì)粒中得到重組質(zhì)粒pACYC184-eGFP-HOK,然后向預(yù)留的酶切位點(diǎn)中插入目的基因spvBC,重組質(zhì)粒pACYC184-spvB-eGFP-HOK 和pACYC184-spvC-eGFP-HOK成功構(gòu)建后將其電轉(zhuǎn)化入感受態(tài)細(xì)菌構(gòu)建回補(bǔ)株,對重組質(zhì)粒穩(wěn)定性研究表明,含hok/sok-parDE質(zhì)粒的菌株所攜帶的質(zhì)粒穩(wěn)定持有,質(zhì)粒無明顯丟失,而不含該系統(tǒng)的質(zhì)粒在傳2至3代后出現(xiàn)質(zhì)粒丟失的現(xiàn)象。經(jīng)基因測序證實(shí)鼠傷寒沙門菌熒光表達(dá)載體pACYC184-eGFP-HOK、pACYC184-spvB-eGFP-HOK、pACYC184-spvC-eGFP-HOK及spvBC缺陷株的回補(bǔ)株均成功構(gòu)建。
解決重組細(xì)菌的技術(shù)難題后,構(gòu)建菌株及野生菌株的藥敏試驗(yàn)顯示,鼠傷寒沙門菌spvBC缺陷后菌株對β-內(nèi)酰胺類、氟喹諾酮類、氨基糖甙類的代表藥物敏感性均明顯增強(qiáng)。既往研究[11]發(fā)現(xiàn)宿主抗性因子Nramp1能上調(diào)致病島-2毒力基因的表達(dá),而AcrD的滅活導(dǎo)致與基礎(chǔ)代謝、毒力和應(yīng)激應(yīng)答在內(nèi)的基本過程相關(guān)的403種基因表達(dá)的改變[12]:細(xì)菌的耐藥與毒力間并非“各行其道”而是相互影響,細(xì)菌的耐藥機(jī)制中主要的外排泵除能將抗生素泵出外也能將機(jī)體遭受細(xì)菌感染后分泌的膽汁、激素及宿主防御因子泵出以利于細(xì)菌對宿主細(xì)胞的侵襲[13],故宿主抗性因子及外排泵的存在有助于細(xì)菌在宿主體內(nèi)的存活、侵襲、運(yùn)動等生物特性。本研究結(jié)果顯示:spv的缺陷能改變鼠傷寒沙門菌的耐藥表型,非傷寒沙門菌中普遍存在質(zhì)粒spv,大小約50~90 kb,與細(xì)菌黏附、運(yùn)動、血清抗性及定居有關(guān)[14]。黃瑞等[15]研究表明,分離自傷寒沙門菌的耐藥質(zhì)粒pRsT98上的spvR和spvB與鼠傷寒沙門菌的spv有大于99%的同源性。spv作為細(xì)菌某些耐藥機(jī)制的上游發(fā)揮作用抑或spv與耐藥相關(guān)因子有相同的作用位點(diǎn)目前尚未明了。本研究隨后對導(dǎo)致細(xì)菌耐藥外排泵中研究得最多的AcrA/B蛋白進(jìn)行檢測,結(jié)果發(fā)現(xiàn)spvBC基因缺陷菌株的AcrA蛋白水平低于野生菌株及spvBC缺陷回補(bǔ)株,這表明spvBC的缺陷能下調(diào)AcrA蛋白的表達(dá),而spvBC的回補(bǔ)能解除對AcrA蛋白的表達(dá)的抑制。
眾所周知,作為一種典型的外流泵系統(tǒng),AcrA/B-TolC外排泵系統(tǒng)能將代謝產(chǎn)物或抗生素等有毒物質(zhì)泵出細(xì)胞外并抑制孔蛋白表達(dá),使抗生素?zé)o法進(jìn)入細(xì)菌內(nèi)發(fā)揮作用以應(yīng)對環(huán)境壓力適者生存[16]。spv作為一種毒力基因是通過何種途徑來影響AcrA蛋白的表達(dá)?與此同時,spv表達(dá)的改變在影響AcrA蛋白的表達(dá)的同時AcrB蛋白的表達(dá)卻未受到影響等均有待進(jìn)一步的研究。下一步課題組將檢測AcrAB的外流通道外膜蛋白TolC及調(diào)控基因acrR、ramA、marA等的表達(dá)情況,以進(jìn)一步探討毒力基因spv改變耐藥表型的機(jī)制,為將spv作為逆轉(zhuǎn)鼠傷寒沙門菌耐藥的分子靶標(biāo)打下實(shí)驗(yàn)基礎(chǔ)。
[1] BRENT AJ,OUNDO JO,MWANGI I,et al.Salmonellabacteremia in Kenyan children[J].Pediatr Infect Dis,2006,25(3):230
[2] 陳強(qiáng),余曉君,李俏俏,等.引起兒童腹瀉的沙門菌屬臨床分離株的耐藥特點(diǎn)及分子流行病學(xué)研究[J].中華檢驗(yàn)醫(yī)學(xué)雜志,2011,34(3):249
[3] 吳春雪,陳強(qiáng),李紅,等.鼠傷寒沙門菌spvB基因缺陷變異株的制備及其抗酸能力檢測[J].華中科技大學(xué)學(xué)報(醫(yī)學(xué)版),2014,43(4):399
[4] 陳強(qiáng),吳春雪,余曉君,等.鼠傷寒沙門菌spvC基因缺陷變異株的制備[J].江蘇大學(xué)學(xué)報(醫(yī)學(xué)版),2014,24(3):235
[5] 劉曉艷,陳強(qiáng),李紅,等.spvB/spvC基因?qū)ι抽T菌毒力及宿主免疫功能的影響[J].南方醫(yī)科大學(xué)學(xué)報,2015,35(11):1649
[6] FISHER IST.International trends inSalmonellaserotypes 1998-2003: a surveillance report from the enter-net internationalsurveillance network[J].Euro Surveill 2004,9(11):9
[7] HARVEY RR,FRIEDMAN CR,CRIM SM,et al.Epidemiology ofSalmonellaenterica serotype dublin infections among Humans, United States, 1968-2013[J].Emerg Infect Dis,2017,23(9):1493
[8] FIELD CM,SUMMERS DK.Multicopy plasmid stability:revisiting the dimer catastrophe[J].J Theor Biol,2011,291:119
[9] LOBATO-MRQUEZ D,MOLINA-GARCA L,MORENO-CRDOBA I,et al.Stabilization of the virulence plasmid pSLT ofSalmonellatyphimuriumby three maintenance systems and its evaluation by using a new stability test[J].Front Mol Biosci,2016,17(3):66
[10]GONG CC,KLUMPP S.MODELING sRNA-regulated plasmid maintenance[J].PLoS One,2017,12(1):e0169703
[11]ZAHARIK ML,VALLANCE BA,PUENTE JL,et al.Host-pathogen interactions:host resistance factor Nramp1 up-regulates the expression ofSalmonellapathogenicity island-2 virulence genes[J].Proc Natl Acad Sci USA,2002,99(24):15705
[12]BUCKNER MM,BLAIR JM,LA RAGIONE RM,et al.Beyond antimicrobial resistance:evidence for a distinct role of the AcrD efflux pump inSalmonellabiology[J].MBio,2016,7(6):16
[13]CHEN Y,HU DX,ZHANG QJ,et al.Efflux pump overexpression contributes to tigecycline heteroresistance inSalmonellaenterica serovar Typhimurium[J].Front Cell Infect Microbiol,2017,7:37
[14]WU SY,WANG LD,LI JL,et al.Salmonellaspv locus suppresses host innate immune responses to bacterial infection[J].Fish Shellfish Immunol,2016,58:387
[15]黃瑞,吳淑燕,張學(xué)光.傷寒桿菌耐藥質(zhì)粒pRsags毒力基因的研究[J].中華微生物學(xué)和免疫學(xué)雜志,2003,23(5):393
[16]WESTON N,SHARMA P,RICCI V,et al.Regulation of the AcrAB-TolC efflux pump inEnterobacteriaceae[J].Res Microbiol,2017.doi:10.1016/j.resmic.2017.10.005