抑制Akt信號通路對病理性瘢痕成纖維細胞生長、細胞周期及凋亡的影響
潘學洪,王曉東
濰坊市益都中心醫院醫學美容科 山東濰坊 262500
皮膚對創傷的修復方式分為2種,依次為簡單的表皮修復和深層真皮修復,而真皮及皮下組織修復常常出現病理性瘢痕[1]。增生的病理性瘢痕一般高于周圍的正常皮膚組織,其表面充血呈現紅色,不僅嚴重影響美觀,還常常出現疼痛、瘙癢等現象[2]。病理性瘢痕以成纖維細胞過度增殖為主要病理學表現,抑制病理性瘢痕成纖維細胞增殖、促進細胞凋亡是病理性瘢痕治療的重要途徑[3]。蛋白激酶B(protein kinase B,Akt)信號通路具有調控細胞增殖、凋亡等作用,其磷酸化后生成磷酸化的Akt(p-Akt),激活Akt信號通路,抑制細胞凋亡,促進細胞增殖[4]。有研究[5]顯示,Akt信號通路在病理性瘢痕組織中過度激活。本研究用Akt信號通路抑制劑處理病理性瘢痕成纖維細胞,探討其對病理性瘢痕成纖維細胞增殖、凋亡及細胞周期的影響,以期為病理性瘢痕的治療提供理論基礎。
1 材料與方法
1.1標本及試劑收集2013年1月至2016年12月濰坊市益都中心醫院手術切除的病理性瘢痕組織50例,患者中男26例,女24例,年齡6~28歲,病程6~12個月。組織標本采集均經過患者及家屬知情同意。青鏈霉素、DMEM、胰蛋白酶為美國Sigma公司產品;胎牛血清為杭州四季青公司產品;Akt信號通路抑制劑LY294002為美國MCE公司產品;Annexin V-FITC/PI細胞凋亡檢測試劑盒為上海Bogoo公司產品;活化的含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved cysteinyl aspartate specific proteinase 3,Cleaved Caspase-3)抗體、活化的含半胱氨酸的天冬氨酸蛋白水解酶9(cleaved cysteinyl aspartate specific proteinase 9,Cleaved Caspase-9)抗體為美國CTS公司產品;Akt抗體、p-Akt抗體為美國Santa Cruz公司產品。
1.2細胞培養病理性瘢痕成纖維細胞分離培養方法參考文獻[6]。病理性瘢痕組織用生理鹽水洗滌3次后,將表皮以及皮下組織去除,用體積分數75%的乙醇洗滌2次后,用含有青鏈霉素的PBS溶液洗滌3次,再用含有青鏈霉素的DMEM洗滌2次。將組織剪碎成大小約為1 mm3的組織塊,把組織塊涂在培養瓶的下壁,在組織塊上滴加2滴胎牛血清后,翻轉培養瓶,放在37 ℃、體積分數5% CO2培養箱中培養2 h。將培養瓶再次翻轉至組織塊的貼壁面朝下,加入2 mL含有體積分數20%胎牛血清的DMEM。每隔3 d更換1次培養液,培養14 d后,在組織塊周圍觀察有成纖維細胞出現后,將細胞培養液更換成含體積分數15%胎牛血清的DMEM。當細胞達到90%融合時,進行傳代培養。用2.5 g/L的胰蛋白酶于37 ℃消化1 min。1 000 r/min離心10 min后,加入細胞培養液(含體積分數15%胎牛血清),以12的比例接種培養。實驗用細胞均為第3代病理性瘢痕成纖維細胞。
1.3MTT法檢測細胞增殖病理性瘢痕成纖維細胞以每孔1 000個細胞接種到96孔細胞培養板中,觀察細胞貼壁后,在細胞培養液中加入適量的Akt信號通路抑制劑LY294002,使其終濃度為0、10、20、40、80 mg/L。培養48 h后,在每孔中加入20 μL的MTT溶液,37 ℃孵育4 h。將上清吸除后,加入150 μL的二甲基亞砜,觀察結晶物溶解后,酶標儀檢測570 nm波長處每孔的吸光度值(A值),計算IC50。實驗重復3次,取均值。
1.4流式細胞術檢測細胞周期用IC50濃度的Akt信號通路抑制劑LY294002處理病理性瘢痕成纖維細胞48 h后,加入2.5 g/L的胰蛋白酶消化細胞,1 000 r/min離心10 min,棄上清,加入PBS洗滌2次,1 000 r/min離心10 min,棄上清,加入冰預冷的體積分數70%的乙醇,4 ℃孵育1 h。1 000 r/min離心10 min后,棄上清,PBS 2 mL重懸細胞。再加入50 mg/L的PI 300 μL,4 ℃避光條件下染色30 min。流式細胞儀分析細胞周期。實驗重復3次,取均值。
1.5流式細胞術檢測細胞凋亡用IC50濃度的Akt信號通路抑制劑LY294002處理病理性瘢痕成纖維細胞48 h后,加入2.5 g/L的胰蛋白酶消化細胞,1 000 r/min離心10 min,棄上清,用冰預冷的PBS洗滌細胞2次,將細胞密度調整為106mL-1,1 000 r/min離心10 min,棄上清,加入300 μL的緩沖液,再加入5 μL的Annexin V-FITC和PI,流式細胞儀檢測細胞凋亡水平。實驗重復3次,取均值。
1.6Westernblot檢測細胞中CleavedCaspase-3、CleavedCaspase-9、Akt、p-Akt水平用IC50濃度的Akt信號通路抑制劑LY294002處理病理性瘢痕成纖維細胞48 h后,將上清液吸除,加入RIPA裂解液,4 ℃裂解完全后,14 000 r/min離心15 min,吸取蛋白上清,與5×上樣緩沖液以體積比41的比例混勻后,煮沸變性。70 V電壓電泳至溴酚藍進入到分離膠和濃縮膠交界處時,把電壓調整為110 V。2 h后,觀察溴酚藍進入分離膠的底部時,關閉電源。200 mA冰浴轉膜90 min,將蛋白轉移至硝酸纖維素膜上,牛血清白蛋白在室溫封閉2 h。與一抗4 ℃過夜反應后,與辣根過氧化物標記的二抗在室溫孵育2 h。顯色后,用Image J圖像處理軟件分析目的蛋白與GAPDH蛋白灰度值的比值,以此表示目的蛋白的表達水平。實驗重復3次,取均值。
1.7統計學處理采用SPSS 21.0進行統計學處理。不同組間細胞A值的比較采用單因素方差分析,組間兩兩比較采用LSD-t檢驗;2組間細胞周期、凋亡率及Cleaved Caspase-3、Cleaved Caspase-9、Akt、p-Akt蛋白表達水平的比較均采用兩獨立樣本的t檢驗。檢驗水準α=0.05。
2 結果
2.1細胞增殖檢測結果見表1。10、20、40、80 mg/L的Akt信號通路抑制劑作用后病理性瘢痕成纖維細胞的增殖活性逐漸降低,與0 mg/L作用組相比,差異均有統計學意義。計算其IC50為32.58 mg/L,后續用30 mg/L的Akt信號通路抑制劑處理病理性瘢痕成纖維細胞。

表1 不同質量濃度Akt信號通路抑制劑作用后病理性瘢痕成纖維細胞A值的變化(n=3)
F=99.308,P<0.001;*:組間兩兩比較,P均<0.05
2.2細胞周期檢測結果見表2。30 mg/L的Akt信號通路抑制劑作用后病理性瘢痕成纖維細胞被阻滯在G0/G1期。
2.3細胞凋亡檢測結果見表2。30 mg/L的Akt信號通路抑制劑作用后病理性瘢痕成纖維細胞凋亡率明顯高于0 mg/L作用組,差異有統計學意義。
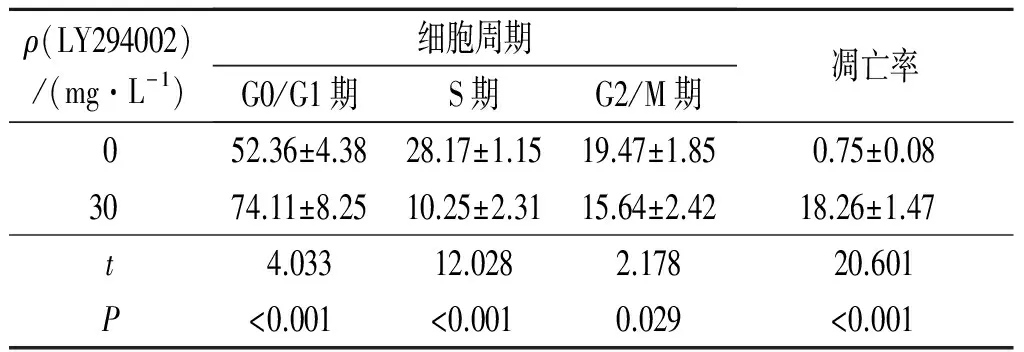
表2 Akt信號通路抑制劑作用后病理性瘢痕成纖維細胞周期及凋亡率的比較(n=3) %
2.4CleavedCaspase-3、CleavedCaspase-9、Akt、p-Akt表達水平檢測結果見圖1和表3。30 mg/L的Akt信號通路抑制劑作用后病理性瘢痕成纖維細胞中Cleaved Caspase-3、Cleaved Caspase-9表達水平明顯高于0 mg/L作用組,而p-Akt表達水平明顯低于0 mg/L作用組,差異有統計學意義。
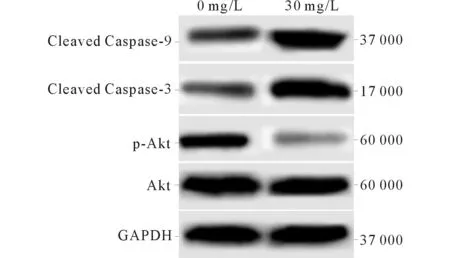
圖1 0、30 mg/L的Akt信號通路抑制劑作用后病理性瘢痕成纖維細胞中Cleaved Caspase-3、Cleaved Caspase-9、Akt、p-Akt表達水平
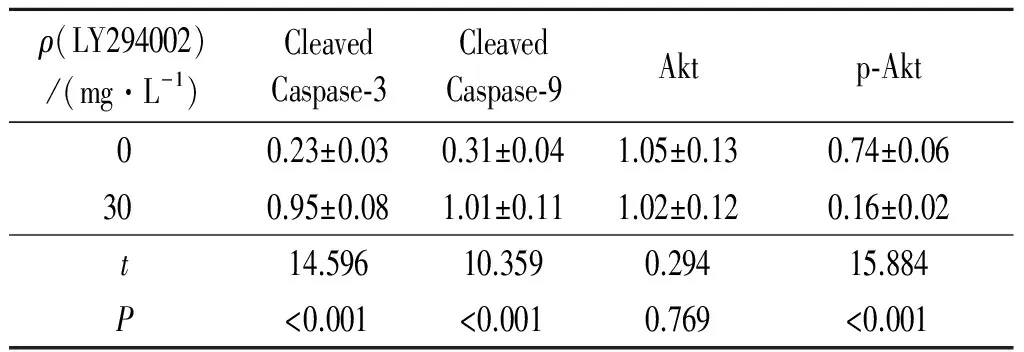
表3 Akt信號通路抑制劑作用后病理性瘢痕成纖維細胞中Cleaved Caspase-3、Cleaved Caspase-9、Akt、p-Akt表達水平的比較(n=3)
3 討論
病理性瘢痕的形態較為多樣,常常高于正常的皮膚組織,表現為彈性差、質脆等現象,在病變的早期,其表面呈現紫色或者是鮮紅色,在病變的晚期則呈現灰白色和蒼白色,同時常出現色素沉著的現象[7-9]。病理性瘢痕不僅嚴重影響美觀,還會損害正常組織的生理功能。目前對于病理性瘢痕的發病機制仍不清楚,燒傷、動物咬傷以及手術等醫療過程均能夠導致病理性瘢痕的產生,其產生的原因與成纖維細胞過度生長有關,是一種病理性的纖維化過程[10]。成纖維細胞是皮膚創傷愈合的關鍵效應細胞,其過度增殖也是瘢痕形成的主要原因[11]。
Akt信號通路在心肌組織、腦組織、消化道等中均有廣泛表達,并且在細胞生長、器官形成、胚胎發育過程中均有重要作用[12]。郭亮等[13]的研究顯示,運用Western blot、PCR和免疫組化等實驗技術檢測瘢痕組織和正常皮膚組織中Akt磷酸化水平發現,瘢痕組織中Akt磷酸化水平高于正常皮膚組織。本研究首先體外分離培養了人病理性瘢痕成纖維細胞,用Akt信號通路特異性抑制劑作用后發現,病理性瘢痕成纖維細胞的增殖活性降低,細胞生長受到抑制,細胞凋亡率升高,G0/G1期細胞增加。說明抑制Akt信號通路可以抑制病理性瘢痕成纖維細胞增殖,促進細胞凋亡,阻滯細胞周期。
細胞增殖、凋亡等生物學特性的發揮與細胞內多種基因調控有關,是一系列復雜過程的最終結果,Caspase蛋白家族是目前研究較多的與細胞凋亡發生有關的半胱氨酸蛋白酶。目前發現的Caspase蛋白家族成員至少有11種,根據其在凋亡信號轉導中的作用可以分為凋亡起始因子、凋亡執行因子,其中Caspase-3是凋亡執行因子,Caspase-9是凋亡起始因子[14-16]。正常情況下,細胞中的Caspase蛋白成員以無活性的酶原形式存在,當受到外界信號刺激后活化發揮其生物學功能[17-18]。本研究結果顯示,Akt信號通路抑制劑作用后病理性瘢痕成纖維細胞中Cleaved Caspase-3、Cleaved Caspase-9表達水平升高。Caspase-3、Caspase-9活化水平升高,說明病理性瘢痕成纖維細胞凋亡增多,這與細胞凋亡檢測結果相一致。
綜上所述,抑制Akt信號通路激活可以促進病理性瘢痕成纖維細胞凋亡,阻滯細胞周期,抑制細胞生長,提高Caspase-3、Caspase-9活化水平,其作用機制需要在后續實驗中進行探討。本研究結果為探討Akt信號通路在病理性瘢痕中的作用奠定了基礎,為治療病理性瘢痕提供了理論依據。本研究存在一定的局限性,沒有探討Akt在體內對瘢痕組織的作用,后續實驗中會對這一部分進行完善和補充。
[1] ZHAI XX,DING JC,TANG ZM.Resveratrol inhibits proliferation and induces apoptosis of pathological scar fibroblasts through the mechanism involving TGF-β1/Smads signaling pathway[J].Cell Biochem Biophys,2015,71(3):1267
[2] REN Y,DENG CL,WAN WD,et al.Suppressive effects of induced pluripotent stem cell-conditioned medium oninvitrohypertrophic scarring fibroblast activation[J].Mol Med Rep,2015,11(4):2471
[3] HUANG C,OGAWA R.The link between hypertension and pathological scarring: does hypertension cause or promote keloid and hypertrophic scar pathogenesis?[J].Wound Repair Regen,2014,22(4):462
[4] SHI J,WANG H,GUAN H,et al.IL10 inhibits starvation-induced autophagy in hypertrophic scar fibroblasts via cross talk between the IL10-IL10R-STAT3 and IL10-AKT-mTOR pathways[J].Cell Death Dis,2016,7(3):e2133
[5] PATERNO J,VIAL IN,WONG VW,et al.Akt-mediated mechanotransduction in murine fibroblasts during hypertrophic scar formation[J].Wound Repair Regen,2011,19(1):49
[6] ZHANG ZF,ZHANG YG,HU DH,et al.Smad interacting protein 1 as a regulator of skin fibrosis in pathological scars[J].Burns,2011,37(4):665
[7] 付晉鳳,譚加.病理性瘢痕的發生機制與修復[J].中華損傷與修復雜志:電子版,2013,8(4):347
[8] MCFARLAND KL,GLASER K,HAHN JM,et al.Culture medium and cell density impact gene expression in normal skin and abnormal scar-derived fibroblasts[J].J Burn Care Res,2011,32(4):498
[9] WANG CJ,HUANG HJ,CHAO A,et al.Challenges in the transvaginal management of abnormal uterine bleeding secondary to cesarean section scar defect[J].Eur J Obstet Gynecol Reprod Biol,2011,154(2):218
[10]廖立新,潘登,陳剛泉,等.羥基喜樹堿與人病理性瘢痕成纖維細胞的增殖[J].中國組織工程研究與臨床康復,2010,14(33):6159
[11]唐志銘,丁繼存,翟曉翔,等.白藜蘆醇對病理性瘢痕成纖維細胞 mTOR 信號通路相關分子表達的影響[J].中國中西醫結合皮膚性病學雜志,2017,16(2):103
[12]周博,郭秦樂,李會霞,等.成纖維細胞生長因子21通過抑制肥胖小鼠肝臟氧化應激改善胰島素抵抗[J].西安交通大學學報(醫學版),2017,38(2):161
[13]郭亮,徐凱,章鑫,等.PTEN、Akt、TGF-β1蛋白在瘢痕疙瘩中的表達[J].中國美容整形外科雜志,2013,24(8):505
[14]陳靜,閆振宇,劉志勇,等.力達霉素抑制K562細胞增殖和誘導凋亡作用及其機制[J].吉林大學學報(醫學版),2016,42(3):467
[15]WAGENER FA,SCHARSTUHL A,TYRRELL RM,et al.The heme-heme oxygenase system in wound healing; implications for scar formation[J].Curr Drug Targets,2010,11(12):1571
[16]韓雪娜,冷玉芳.右美托咪啶對慢性神經病理性疼痛大鼠鎮痛作用機制的研究[J].蘭州大學學報(醫學版),2016,42(1):1
[17]玄承敏,薛天陽,許偉.苦參堿對人橫紋肌肉瘤RD細胞增殖及凋亡的影響及其作用機制[J].中華實用兒科臨床雜志,2015,30(3):233
[18]李銘,郭志輝,謝義德,等.口服普萘洛爾對嬰幼兒血管瘤相關生長因子及凋亡因子表達水平的影響[J].解放軍醫學雜志,2015,40(2):121