Th1/Th2/Th17細胞因子在慢性乙型肝炎患者恩替卡韋停藥后維持病毒學應答中的作用
邱源旺 甘建和 楊文龍 戴亞萍 王俊 張波 汪錚 蘇婷婷 李燚光 周紅燕 徐微 黃利華
214005 無錫市第五人民醫院(邱源旺、戴亞萍、王俊、張波、汪錚、李燚光、蘇婷婷、周紅燕、徐微、黃利華);215006 蘇州大學附屬第一醫院(甘建和);330006南昌大學第二附屬醫院(楊文龍)
目前國內外慢性乙型肝炎防治指南均將恩替卡韋(entecavir, ETV)作為慢性乙型肝炎(CHB)患者臨床抗病毒治療的首選藥物之一,但因其療程的長期性,造成臨床上部分患者服藥的依從性差,自行停藥以及不規范停藥的現象時有發生。因此,如何實現ETV安全停藥是目前研究的熱點及難點問題。近期研究報道ETV除了直接抑制HBV復制外,通過調節Th1/Th2/Th17細胞因子水平對控制病毒及維持病毒學應答產生影響[1],推測ETV停藥后是否復發可能與Th1/Th2/Th17細胞因子表達水平相關,這些細胞因子的變化以及其在維持持久應答中的作用目前不清楚,仍待進一步闡明。
本研究旨在接受ETV治療并達到我國2010年發布的慢性乙型肝炎防治指南停藥標準、HBeAg陽性的CHB患者中,研究ETV停藥后Th1/Th2/Th17細胞因子表達水平的動態變化特點及其在ETV停藥后維持持久病毒學應答中的作用。
1 對象與方法
1.1研究對象入選2009年1月至2011年12月在無錫市第五人民醫院、南昌大學第二附屬醫院、蘇州大學附屬第一醫院門診或住院的HBeAg陽性的CHB接受ETV治療患者。
1.2入選標準(1)接受ETV治療至少2年以上,并符合2010年我國發布的慢性乙型肝炎防治指南的停藥標準[2];(2)愿意簽署醫院倫理委員會通過的知情同意書,依從性好、資料完整、能接受隨訪的CHB患者。
1.3排除標準(1)接受ETV治療前或停藥時,經影像學、肝活檢或Fibrotouch提示明顯肝纖維化或肝硬化的患者;(2)既往出現過對任何一種核苷(酸)類似物耐藥的患者;(3)既往有停藥后復發史的患者;(4)合并丙型肝炎、自身免疫性或膽汁淤積性肝病、或伴有惡性腫瘤、嚴重全身性疾病;(5)孕婦;(6)近6月內使用過免疫調節劑的患者。
1.4停藥標準[2]HBeAg 陽性患者在達到了HBV DNA檢測下限以下(HBV DNA<100拷貝/ml)以及ALT復常和HBeAg血清學轉換之后,再經過1年以上的鞏固治療仍保持不變,并且具有2年以上總療程的患者。
1.5病毒學應答定義[3]病毒學應答是指經抗病毒治療血清HBV DNA降至低于檢測值下限。持續病毒學應答具體指的是停止抗病毒治療后隨訪52周仍能保持血清HBV DNA持續低于檢測值下限。
1.6復發(Relapse)定義[3]病毒學復發即獲得病毒學應答的患者在停藥之后,每隔1個月檢測兩次HBV DNA都超過104拷貝/ml。
1.7復發的處理對于病毒學復發的患者再次予以恩替卡韋抗病毒治療,同時結束本停藥研究的隨訪,納入普通CHB的抗病毒隨訪中。
1.8觀察指標和檢測方法分別在停藥0、12、24、52周檢測肝功能、HBV DNA、HBV標志物(HBV-M)、Th1/Th2/Thl7細胞因子。肝功能采用日立7600全自動生化分析儀及配套試劑檢測;HBV DNA及HBV基因分型由lightcycle基因熒光定量分析儀檢測,HBV DNA檢測采用PCR-熒光探針法,嚴格按照試劑盒說明書進行操作,檢測下限為100拷貝/ml;HBV基因分型采用實時熒光PCR法,使用上海復星科技發展有限公司生產的試劑盒檢測,嚴格按照試劑盒說明書進行操作;ETV相關耐藥位點檢測由美國貝克曼庫爾特公司CEQ-8000基因測序儀采用HBV聚合酶區基因序列分析法檢測,引物由上海
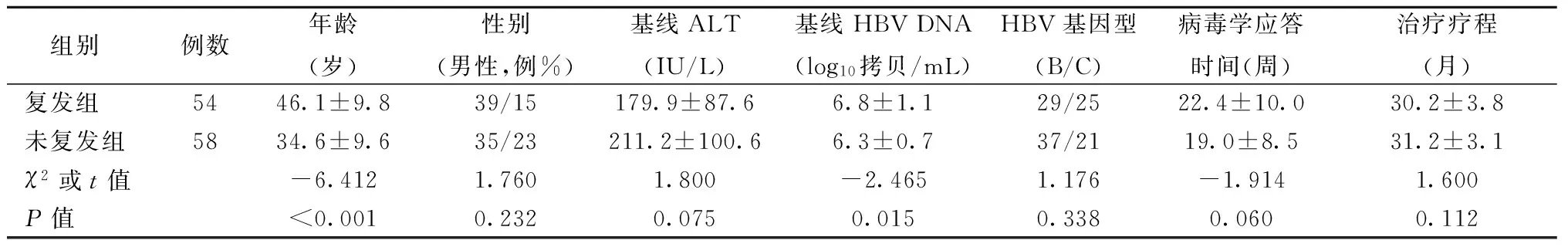
表1 復發組與持續病毒學應答組基線特征比較
生工生物工程公司合成。HBeAb、HBeAg采用1235時間分辨熒光免疫分析儀檢測。HBsAg的定量檢測采用i2000化學發光免疫分析儀及采用Abbott試劑檢測;Th1/Th2/Th17細胞因子采用微量樣本多重蛋白定量(CBA)法,使用美國BD公司生產的人Th1/Th2/Thl7細胞因子試劑盒檢測單個樣本中多種蛋白的含量,包括Th1(IL-2、IFN-γ、TNF-α)、Th2(IL-4、IL-6、IL-10)和Thl7(IL-17A)。停藥觀察時間均為52周。
1.9統計學方法計量資料以均數±標準差(mean±SD)或中位數±四分位間距(M±QR)表示,采用t檢驗、或秩和檢驗Mann-WhitneyU檢驗;組間率的比較用R x C表的χ2檢驗。HBV DNA在檢測水平以下的患者按照2.0 log10拷貝/mL進行數據統計分析,復發患者將復發時的檢測數據計入隨后的各隨訪時間點的檢測結果。所有數據采用SPSS16.0統計軟件分析。所有統計分析基于雙側假設檢驗,以α=0.05為檢驗水準,P<0.05差異有統計學意義。
2 結果
2.1研究對象基本臨床資料本研究根據停藥標準入組停藥患者共136例,HBV聚合酶區基因序列分析均未發現ETV耐藥位點耐藥,剔除肝硬化及隨訪<24周的患者各12例,納入滿足本研究方案的CHB患者112例,其中男74例,女38例,年齡22~63歲(40.1±11.2),抗病毒治療總療程26~40個月,平均(30.7±3.5)個月;停藥后52周病毒學復發率為48.2% (54/112)。根據患者停藥52周是否發生病毒學復發,將患者分復發組(Viral relapse,VR)和持續病毒學應答組(Sustained off-treatment virological response,SVR),SVR組患者年齡、基線HBV DNA水平均低于VR組,VR組經HBV聚合酶區基因序列分析均未發現恩替卡韋耐藥位點耐藥,2組間比較均有統計學意義(均P<0.001),性別、基線ALT水平、基因型、病毒學應答時間及治療療程比較均無統計學意義(均P>0.05)。見表1。
2.2SVR組與VR組停藥后HBsAg(log10IU/mL)、HBVDNA、HBeAg及ALT水平的變化SVR組與VR組停藥后12周、24周、52周間HBsAg水平、HBV DNA水平、HBeAg水平及ALT水平比較均有統計學差異(均P<0.05),見表2。
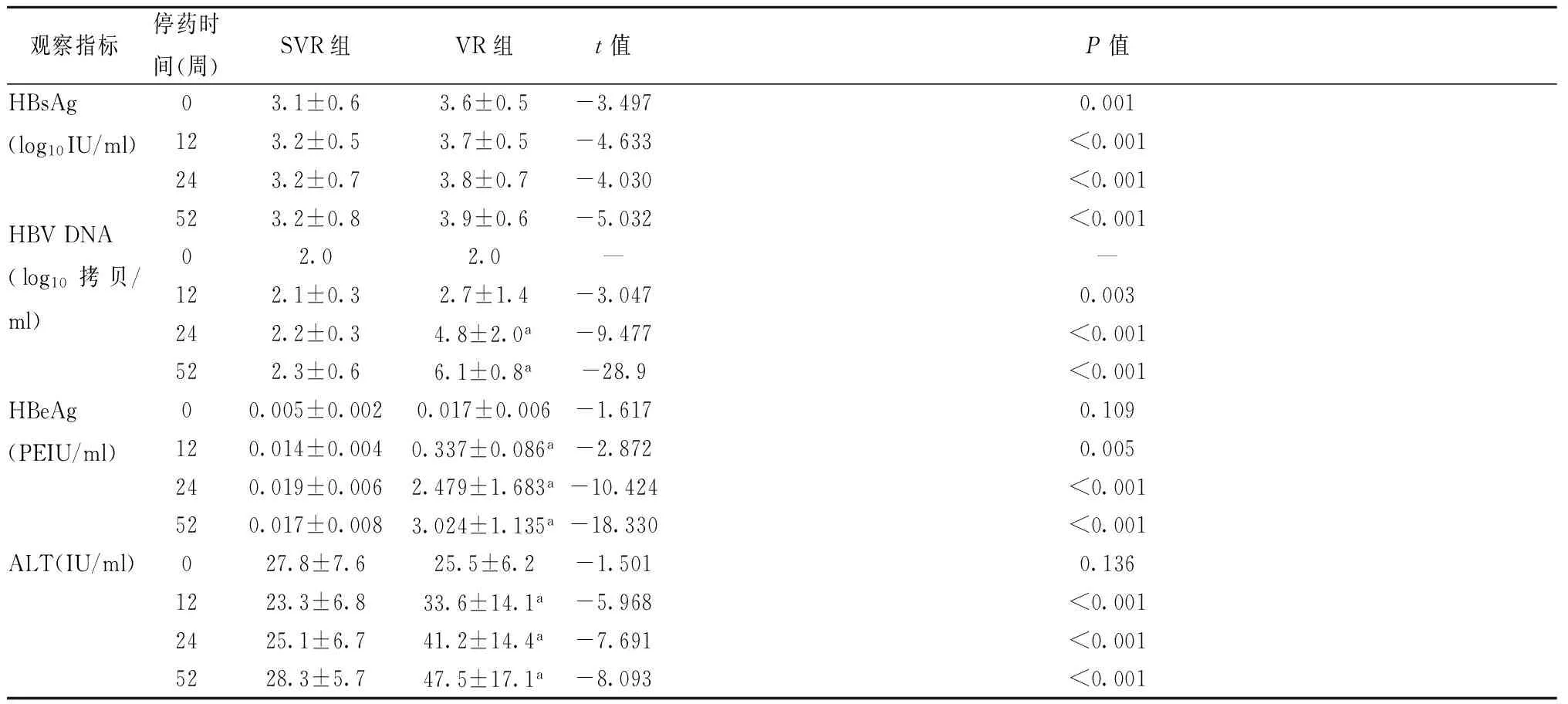
表2 VR組與SVR組停藥后HBsAg、HBV DNA、HBeAg及ALT水平的變化
注:a與同組停藥基線(0周)比較,P<0.05.
Note:aP<0.05 compared with the baseline of entecavir discontinuation of the same group.
2.3SVR組與VR組患者停藥時Th1/Th2/Th17細胞因子表達水平比較SVR組和VR組患者在停藥時血清Th1(IFN-γ、IL-2、TNF-α)水平比較,IFN-γ水平差異有統計學意義(P=0.004,表3),IL-2、TNF-α水平差異無統計學意義(均P>0.05,表3)。SVR患者血清Th2(IL-4、IL-6、IL-10)水平均低于VR,組間比較只有IL-10水平結果差異有統計學意義(P=0.001,表3)。停藥時Th17(IL-17A)SVR組高于VR組,但兩組間結果比較差異無統計學意義(P=0.609,表3)。
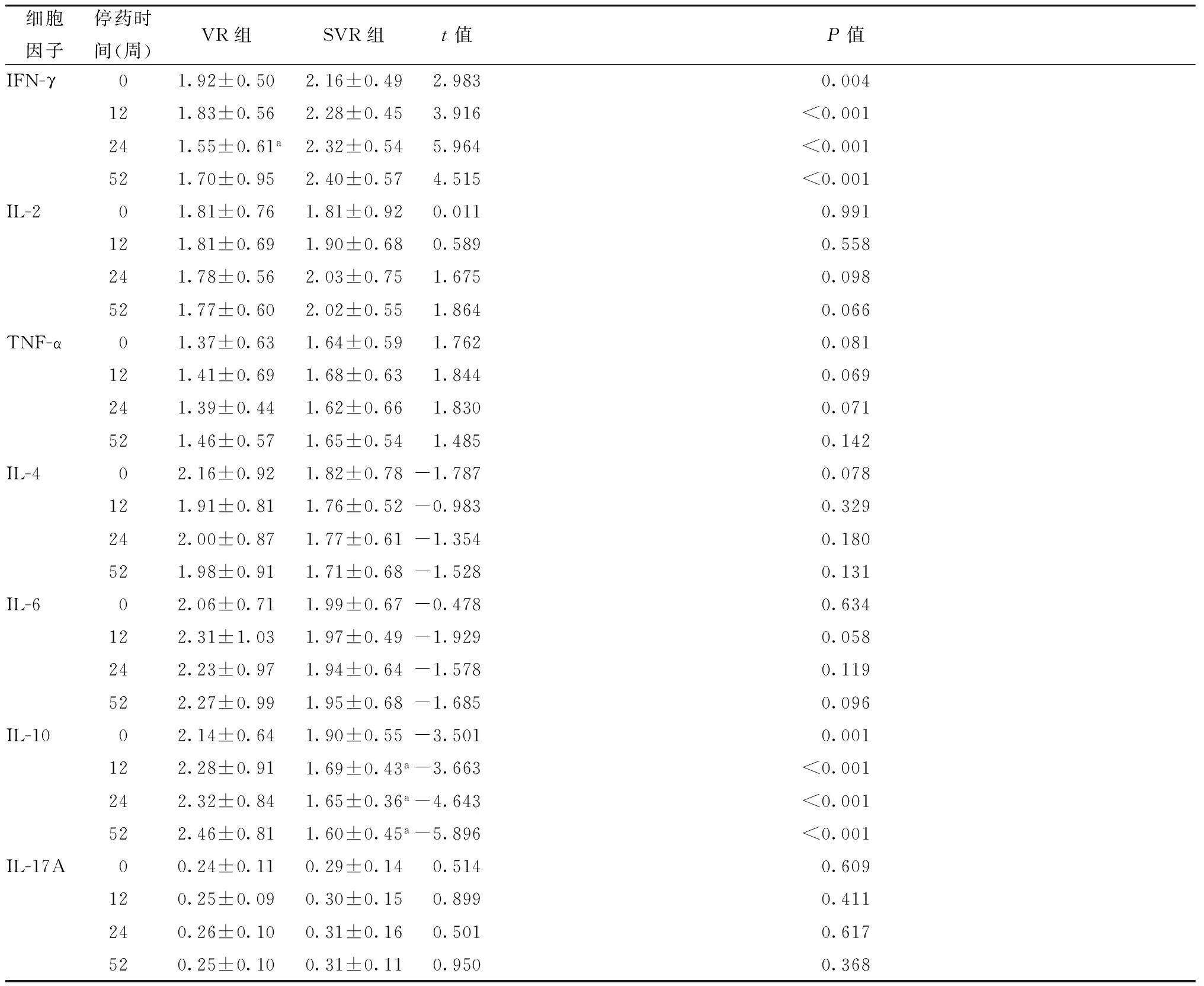
表3 VR組與SVR組停藥后Th1(IFN-γ、IL-2、TNF-α)/Th2(IL-4、IL-6、IL-10)/Th17(IL-17A)細胞因子表達水平(ng/ml)比較
注:a與同組停藥基線(0周)比較,P<0.05.
Note:aP<0.05 compared with the baseline (0 week) of entecavir discontinuation of the same group.
2.4Th1/Th2/Th17細胞因子表達水平在ETV停藥后維持病毒學應答中的作用SVR組停藥后Th1型細胞因子中TNF-α、IL-2、IFN-γ水平出現波動,但無顯著性差異(均P>0.05,表3)。Th2類細胞因子IL-10水平呈顯著下降趨勢,各隨訪時間點與停藥基線結果比較差異均有統計學意義(t=2.092,2.368,2.726,均P<0.05,表3)。SVR組患者在各隨訪時間點IFN-γ水平保持在較高水平,均顯著高于VR組(均P<0.05,表3)。
VR組患者停藥后Th1細胞因子IFN-γ水平前24周呈下降趨勢,24周后呈上升趨勢,停藥24周IFN-γ水平與停藥基線結果比較差異有統計學意義(t=2.984,P<0.05,表3),Th2類細胞因子中在隨訪52周過程中IL-4、IL-6及IL-10水平出現波動無顯著性差異(均P>0.05,表3)。VR組患者在停藥0、12、24、52周IL-10水平均顯著高于SVR組患者(P<0.05,表3)。
SVR組患者停藥后IL-17A水平略有升高,各隨訪時間點高于復發組,但組間結果比較差異均無統計學意義(均P>0.05, 表3)。
3 討論
HBV感染的臨床轉歸一般是由感染之后人體的免疫系統和病毒之間相互作用所決定。正常的免疫狀態下,Th1/Th2兩類細胞因子相互制約,處于動態平衡,對機體抵抗病原體感染、控制及清除病毒均具有重要意義,一旦這種動態平衡被打破將導致疾病的發生與發展,影響疾病的預后轉歸[4]。既往研究發現,在ETV抗病毒治療中,第4周時患者血清IFN-γ水平顯著低于基線水平,其后又緩慢上升,但在48周時仍低于基線點,因此認為應用ETV治療后患者IFN-γ水平的下降一方面降低體內的炎癥反應,減輕肝臟的纖維化反應,延緩疾病的進展;另一方面ETV治療過程中體內Th1類免疫反應下降而Th2類免疫反應不足,機體清除病毒的能力被削弱而不利用病毒的清除與控制,當停止用藥或出現耐藥時仍會出現病毒學復發。也有研究報道ETV在抗病毒治療過程中,可促進IFN-γ水平升高,使Th1/Th2細胞因子平衡的變化向Th1方向傾斜,從而發揮控制HBV復制、促進HBeAg的血清轉換作用[5]。本研究結果顯示ETV停藥后SVR組在停藥后52周Th1細胞因子雖然沒有發現顯著升高,但這些患者IFN-γ、IL-2、TNF-α水平均穩定在較高水平,而且IFN-γ水平在各隨訪時間點均顯著高于VR組,說明Th1細胞因子IFN-γ水平在ETV停藥后維持病毒學應答中發揮一定的作用。其機制可能是一方面停藥后機體仍能通過自身的T細胞、自然殺傷細胞等分泌一定水平的IFN-γ,調節T淋巴細胞的增殖、分化,參與細胞免疫,從而抑制HBV DNA復制[6-7];另一方面IFN-γ可以抑制Th2型細胞因子表達,使患者體內IL-10表達水平降低,Th1/Th2細胞因子平衡的變化趨勢向Th1方向傾斜,患者體內細胞免疫功能得到了維持或加強,有利于控制病毒和減少停藥后病毒學復發[8]。VR組患者停藥后52周隨訪過程中Th2類細胞因子穩定在較高水平,Th1細胞因子中IFN-γ水平呈下降趨勢,而且停藥24周IFN-γ水平較停藥基線水平顯著下降。患者在停藥24周后IFN-γ水平出現上升,可能原因為部分患者停藥后出現HBV DNA反彈,誘發機體免疫反應,通過自然殺傷細胞或T細胞產生IFN-γ,進一步調節T淋巴細胞的分化、增殖,參與肝臟炎癥反應及抗病毒[9]。VR組患者IL-10水平在停藥后呈上升趨勢,顯著高于SVR組,說明Th2細胞因子IL-10水平的高表達可能與病毒學復發有關。其機制可能是IL-10能促使慢性HBV感染的T細胞耗竭,抑制病毒特異性T細胞免疫應答[10],同時在抗原呈遞細胞作用下,抑制T淋巴細胞等分泌細胞因子,下調IFN-γ等Th1型細胞因子的表達,使Th1/Th2細胞因子平衡的變化總趨勢向Th2方向傾斜,HBV DNA不能被有效清除,從而導致CHB患者ETV停藥后易復發[11-12],但其確切機制尚需進一步深入研究。上述研究結果表明Th1/Th2細胞因子的平衡狀態與ETV停藥后復發密切相關。
近期研究發現Thl7參與肝臟炎癥反應及清除病毒過程,與CHB的發生、發展密切相關[13]。Yu等[14]報道ETV抗病毒治療過程中隨著HBV DNA的水平下降,伴有Th17細胞數量升高。本研究結果顯示,雖然ETV停藥后各隨訪時間點SVR組IL-17A水平高于VR組,但結果比較均無顯著性差異,提示Th17細胞因子IL-17A與ETV停藥后復發無顯著相關性。
綜上所述,Th1細胞因子IFN-γ水平穩定在較高水平表達有利于ETV停藥后維持病毒學應答,Th2細胞因子IL-10水平的高表達可能與病毒學復發有關,CHB患者ETV停藥后可能通過Th1/Th2細胞因子平衡機制在維持持久的病毒學應答中發揮一定的作用。由于本研究入組病例數相對少,停藥后觀察時間短,對于長期ETV停藥后復發與Th1/Th2/Th17細胞因子水平的關系有待擴大樣本及長期觀察研究。
利益沖突無
[1]Tian ZF,You ZL,Yi H, et al. Effect of entecavir on CD4+ T-cell subpopulations in patients with chronic hepatitis B[J]. Ann Hepatol, 2016, 15(2):174-182. DOI:10.5604/16652681. 1193705.
[2]中華醫學會肝病學分會,中華醫學會感染病學分會.慢性乙型肝炎防治指南(2010年版)[J].中華臨床感染病雜志,2011,4(1):1-13. DOI:10.3760/cma.j.issn.1674-2397.2011.01.001.
[3]中華醫學會肝病學分會,中華醫學會感染病學分會.慢性乙型肝炎防治指南(2015更新版)[J]. 中華肝臟病雜志, 2015, 23(12):888-905. DOI:10.3760/cma.j.issn.1007-3418. 2015. 12.002.
[4]Li MH, Zhang D, Zhang L, et al. Ratios of T-helper 2 cells to T-helper 1 cells and cytokine levels in patients with hepatitis B[J]. Chin Med J (Engl), 2017, 130(15):1810-1815. DOI: 10.4103/0366-6999.211541.
[5]Doganci A, Birkholz J, Gehring S, et al. In the presence of IL-21 human cord blood T cells differentiate to IL-10-producing Th1 but not Th17 or Th2 cells[J]. Int Immunol, 2013, 25(3):157-169. DOI:10.1093/intimm/dxs097.
[6]Wu JF, Hsu HY, Ni YH, et al.Suppression of furin by interferon-gamma and the impact on hepatitis B virus antigen biosynthesis in human hepatocytes[J]. Am J Pathol, 2012, 181(1): 19-25. DOI:10.1016/j.ajpath.2012.03.036.
[7]Wang K, Yang H, He W, et al. Association between extranodal natural killer/T-cell lymphoma and hepatitis B viral infection:a case-control study[J]. J Cancer, 2017, 8(14):2676-2683. DOI:10.7150/jca.19665.eCollection 2017.
[8]李鈴敬,楊彬,劉嬌,等. 恩替卡韋對慢性乙型肝炎患者外周血Th1/Th2型細胞因子表達水平的影響[J]. 中華肝臟病雜志,2017, 25(8):606-611. DOI:10.3760/cma.j.issn.1007-3418.2017.08.010.
[9]Wang Y, Yu W, Shen C, et al. Predictive value of serum IFN-γ inducible Protein-10 and IFN-γ/IL-4 ratio for liver fibrosis progression in CHB patients[J]. Sci Rep, 2017, 7:40404. DOI:10.1038/srep40404.
[10]Das A, Ellis G, Pallant C, et al. IL-10-producing regulatory B cells in the pathogenesis of chronic hepatitis B virus infection[J]. J Immunol, 2012, 189(8):3925-3935. DOI:10.4049/jimmunol.1103139.
[11]Gong Y, Zhao C, Zhao P, et al. Role of IL-10-producing regulatory B cells in chronic hepatitis B virus infection[J]. Dig Dis Sci, 2015, 60(5):1308-1314. DOI:10.1007/s10620-014-3358-1.
[12]Xu L, Yin W, Sun R, et al. Kupffer cell-derived IL-10 plays a key role in maintaining humoral immune tolerance in hepatitis B virus-persistent mice[J]. Hepatology, 2014, 59(2):443-452. DOI:10.1002/hep.26668.
[13]姚思敏, 劉映霞, 李曉鶴, 等. 慢性乙型肝炎患者外周血Th17細胞及相關轉錄因子表達的檢測[J].中華實驗和臨床病毒學雜志, 2015, 29(1):2-4. DOI:10.3760/cma.j.issn.1003-9279.2015.01.002.
[14]Yu XP, Guo RY, Su ML, et al. Dynamic changes of Treg and Th17 cells and related cytokines closely correlate with the virological and biochemical response in chronic hepatitis B patients undergoing nucleos(t)ide analogues treatment [J]. Hepat Mon, 2013, 13(12): e15332. DOI:10.5812/hepatmon.15332.

