人表皮生長因子受體2與wnt/β-catenin信號相互作用促進卵巢癌細胞轉移
劉芬芬,高 倩,程 民,徐婷娟,任薈蓉,沈國棟
卵巢癌(ovarian cancer, OC)在婦科腫瘤中死亡率排在首位,早期缺乏特異性癥狀,當出現明顯癥狀或原發腫瘤發生轉移時,大多數病例才被發現。約2/3的高級別卵巢癌患者存在惡性進展,從而引起腫瘤復發和化療耐藥。分子靶向治療策略有助于改善卵巢癌患者的預后,從而提高其生存率[1]。不同信號通路之間的交互作用常常存在于在正常的胚胎器官發育中,其異常調節會促進腫瘤的發生[2-3]。人表皮生長因子受體2(human epidermal growth factor receptor 2, HER2)[4]和wnt/β-catenin信號通路[5]已被證實在卵巢癌中存在異常表達及其相關信號通路過度激活的現象。研究[6]表明HER2與wnt/β-catenin信號通路之間可能存在相互作用而共同促進下游信號的持續活化,對促進腫瘤細胞自我更新及轉移起到重要作用,并推測可能與卵巢癌的耐藥機制相關。該研究主要檢測HER2與wnt/β-catenin信號通路之間的相互作用,為了解卵巢癌的發病及耐藥機制提供實驗證據。
1 材料與方法
1.1材料和試劑人卵巢癌細胞株SKOV3獲贈于中國醫學科學院腫瘤研究所。胎牛血清(FBS)、RPMI1640培養基購自美國HyClone公司;RIPA裂解液、胰酶消化液、5×蛋白上樣緩沖液購自上海碧云天生物技術有限公司;蛋白磷酸酶抑制劑、蛋白酶抑制劑購自瑞士Roche公司;BCA試劑盒、化學發光顯影液購自美國Thermo公司;β-actin、β-鏈蛋白(β-catenin)兔抗人單克隆抗體、T細胞因子4 (T cell factor 4, TCF4)兔抗人單克隆抗體、HER2兔抗人單克隆抗體、辣根過氧化物酶(horseradish peroxidase, HRP)標記的羊抗兔IgG購自美國Cell Signaling Technology公司;人表皮生長因子(epidermal growth factor, EGF)購自美國Peprotech公司;人重組wnt3a蛋白購自美國R&D Systems公司;小分子抑制劑iCRT14(inhibitor of β-catenin responsive transcription 14, iCRT14)購自英國Tocris公司;HER2、TCF4慢病毒購自上海漢恒生物科技有限公司。
1.2方法
1.2.1細胞培養 于37 ℃、5% CO2飽和濕度條件下培養,含10% FBS的RPMI1640培養基的解凍復蘇后的人卵巢癌細胞株SKOV3。
1.2.2Western blot檢測 提取生長狀態良好的SKOV3細胞總蛋白,BCA法測定各組蛋白濃度并用PBS調成一致濃度,加入蛋白上樣緩沖液后于水浴鍋中煮沸8 min,經SDS-PAGE電泳分離后濕轉至PVDF膜上,用5% 脫脂牛奶室溫條件下封閉1 h。一抗以兔抗人β-actin為內參, 兔抗人β-catenin、TCF4、HER2為目的蛋白,4 ℃孵育過夜。二抗為HRP標記的羊抗兔IgG。滴加顯影液后使用化學發光成像儀成像并運用Chemi Analysis 分析軟件對蛋白電泳條帶灰度值進行定量分析。蛋白相對定量=目的蛋白灰度值 /同標本 β-actin 內參灰度值,同時將對照的蛋白相對定量設為1。每項實驗重復 3 次。
1.2.3慢病毒感染 提前24 h在6孔板中接種適量密度的SKOV3細胞(約2×105/ml),待細胞生長達50%~80%面積時即可用于感染。靶向HER2或TCF4不同位點的shRNA-1及shRNA-2包入慢病毒中(漢恒生物科技有限公司),用作感染。感染當天,將細胞換至無血清培養基中,每孔加入10 μl(2×106TU)慢病毒溶液并放回培養箱。6 h后,將細胞換液至含10% FBS的新鮮培養基。48 h后,在熒光顯微鏡下查看轉染效率。用適量嘌呤霉素對其進行篩選,然后提取適量細胞檢測HER2或TCF4蛋白量。
1.2.4細胞遷移檢測 收集經胰酶消化后生長狀態良好的SKOV3細胞,離心后用無血清培養基重懸計數,分為對照組,iCRT14組(5 μg/ml),shHER2組,shTCF4組,shHER2+EGF組(10 μg/ml), shHER2+wnt3a組(10 μg/ml),shTCF4+EGF組(10 μg/ml)和shTCF4+wnt3a組(10 μg/ml)。加入刺激劑混勻后,分別將100 μl含5×103細胞數的各組細胞懸液加入96孔板中Transwell小室上室,每組3個平行孔;下室均加入200 μl含有EGF生長因子的完全培養基,在37 ℃培養箱孵育,12 h后取出小室,用4%中性福爾馬林固定,棉簽小心擦去上室細胞,結晶紫染色,蒸餾水洗后用鑷子劃下小室底膜,50%甘油封片。使用10×物鏡明場拍照,隨機選取每個樣本的10個視野進行計數分析。
1.2.5劃痕實驗 將SKOV3細胞株分別接種到6孔板中,待細胞貼壁生長至融合度約為80%時,用無菌移液器槍頭沿孔中軸線輕輕劃過,然后用PBS洗滌細胞2次,以除去漂浮細胞,并加入含有不同刺激劑的新鮮培養基;放入37 ℃、5% CO2培養箱培養。分別于0、20 h后拍照,觀察劃痕愈合情況并測量。
1.3統計學處理采用SPSS 22.0 軟件進行分析,多組樣本的比較運用單因素方差分析,方差齊者采用LSD-t檢驗,方差不齊者采用Games-Howell 檢驗。P<0.05表示差異有統計學意義。
2 結果
2.1在卵巢癌SKOV3細胞中檢測HER2和TCF4的表達量實驗結果顯示人卵巢癌SKOV3細胞株高表達HER2和TCF4,使用兩種慢病毒獲得敲低HER2的SKOV3-shHER2和敲低TCF4的SKOV3-shTCF4細胞,Western blot驗證敲低效果(P<0.05),其中shHER2#2敲低HER2效果更好,shTCF4#2敲低TCF4效果更好,后續實驗均選擇這兩種慢病毒敲低的SKOV3-shHER2和SKOV3-shTCF4。同時,Western blot結果還顯示,敲低了HER2的SKOV3細胞,其TCF4和β-catenin的表達也會降低;敲低了TCF4,SKOV3細胞中HER2和β-catenin的表達也同樣降低。結果表明卵巢癌SKOV3細胞中,HER2和TCF4的表達量呈正相關性(HER2蛋白:F=54.843;TCF4蛋白:F=109.502;β-catenin蛋白:F=33.146;P<0.05)。Transwell實驗(F=122.423,P<0.05)和劃痕實驗(F=164.466,P<0.05)表明,敲低HER2和TCF4后,SKOV3細胞的轉移能力明顯減弱,差異均有統計學意義(P<0.05)。見圖1~3。
2.2在卵巢癌SKOV3細胞中HER2和wnt/β-catenin信號通路的活化為了進一步探討卵巢癌中EGFR和wnt信號通路是否存在相互作用,通過加入不同時間梯度的EGF、wnt3a和iCRT14刺激,利用Western blot法檢測HER2、β-catenin和TCF4的變化。結果顯示加入EGF后,隨著時間的延長,HER2表達量上升(P<0.05),同時β-catenin和TCF4的表達也明顯增強(P<0.05);加入wnt3a后,β-catenin和TCF4表達量上升(P<0.05),同時HER2的表達也明顯增強(P<0.05);加入iCRT14后,β-catenin和TCF4表達量降低(P<0.05),同時HER2的表達也明顯減弱(P<0.05)(HER2蛋白:FEGF=15.603,Fwnt3a=104.057,FiCRT14=32.034;TCF4蛋白:FEGF=42.557,Fwnt3a=26.138,FiCRT14=95.082;β-catenin蛋白:FEGF=11.967,Fwnt3a=65.840,FiCRT14=103.599)。結果表明在卵巢癌中,HER2與wnt/β-catenin信號通路存在相互作用。見圖4。
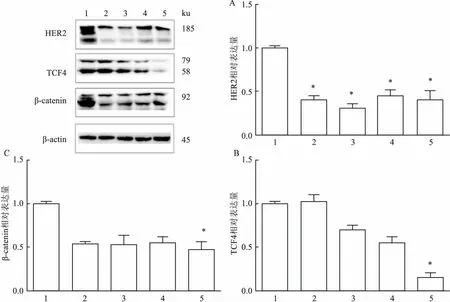
圖1 Western blot法檢測SKOV3細胞中HER2、β-catenin和TCF4的表達

圖2 Transwell實驗檢測敲低HER2和TCF4的SKOV3細胞遷移能力 ×100
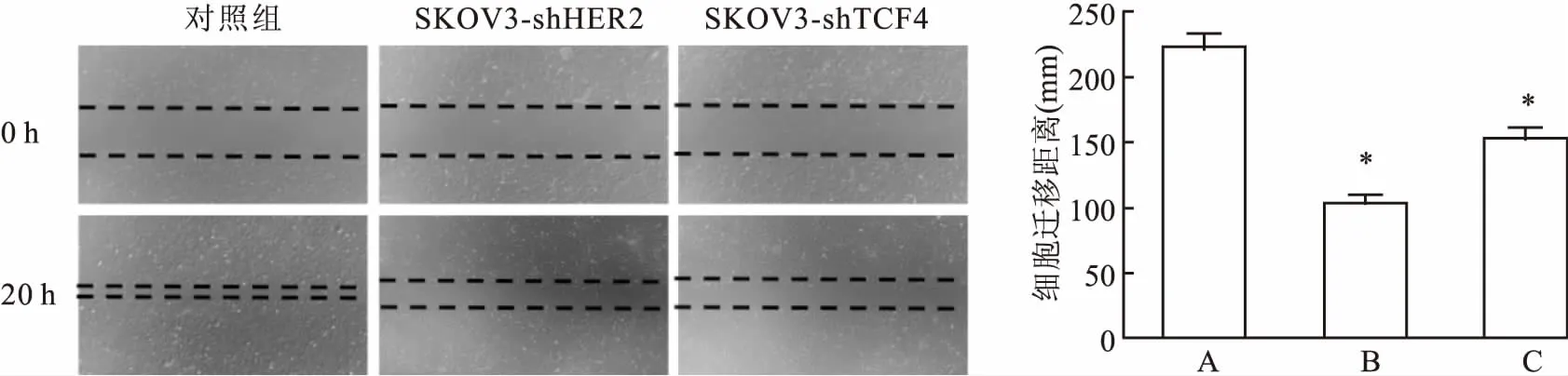
圖3 劃痕實驗檢測敲低HER2和TCF4的SKOV3細胞遷移能力 ×40
2.3Transwell實驗和劃痕實驗檢測卵巢癌SKOV3細胞的遷移能力為了驗證卵巢癌中,HER2與wnt/β-catenin信號通路存在相互作用,通過加入不同時間梯度的EGF、wnt3a和iCRT14刺激,采用Transwell實驗和劃痕實驗檢測SKOV3-shHER2和SKOV3-shTCF4細胞遷移能力的變化。Transwell實驗結果(SKOV3-shHER2:F=535.616;SKOV3-shTCF4:F=587.493)顯示加入EGF(10 μg/ml)后,SKOV3-shHER2和SKOV3-shTCF4細胞遷移能力增強(P<0.05);加入wnt3a(10 μg/ml)后,SKOV3-shHER2和SKOV3-shTCF4細胞遷移能力增強(P<0.05);加入iCRT14(25 nmol/L)后,SKOV3細胞遷移能力明顯減弱(P<0.05)。劃痕實驗(SKOV3-shHER2:F=367.572;SKOV3-shTCF4:F=435.443)和Transwell實驗結果一致。見圖5、6。
3 討論
近年來,針對腫瘤細胞表面受體的小分子抑制劑和抗體藥物在腫瘤治療領域取得了重要進展。目前已有多種EGFR或HER2抗體和抑制劑被批準用于乳腺癌、胃癌等腫瘤的臨床治療[7-8];而多種wnt信號抑制藥物目前正處于腫瘤治療的不同臨床試驗階段。然而,這類藥物單獨用于臨床腫瘤治療的效果一般都不理想,推測原因可能是一方面臨床腫瘤異質性很強,靶標表達有強有弱,造成藥物敏感性不足;另一方面一種藥物長期使用易導致腫瘤耐藥。其中,耐藥是卵巢癌復發和治療失敗的重要原因,因此,研究卵巢癌細胞HER2和wnt/β-catenin信號通路之間的相互作用,闡明其發生相互作用的分子機制,將為揭示卵巢癌耐藥性的產生原因及靶向治療藥物的聯合使用提供依據,具有重要的理論與現實意義。
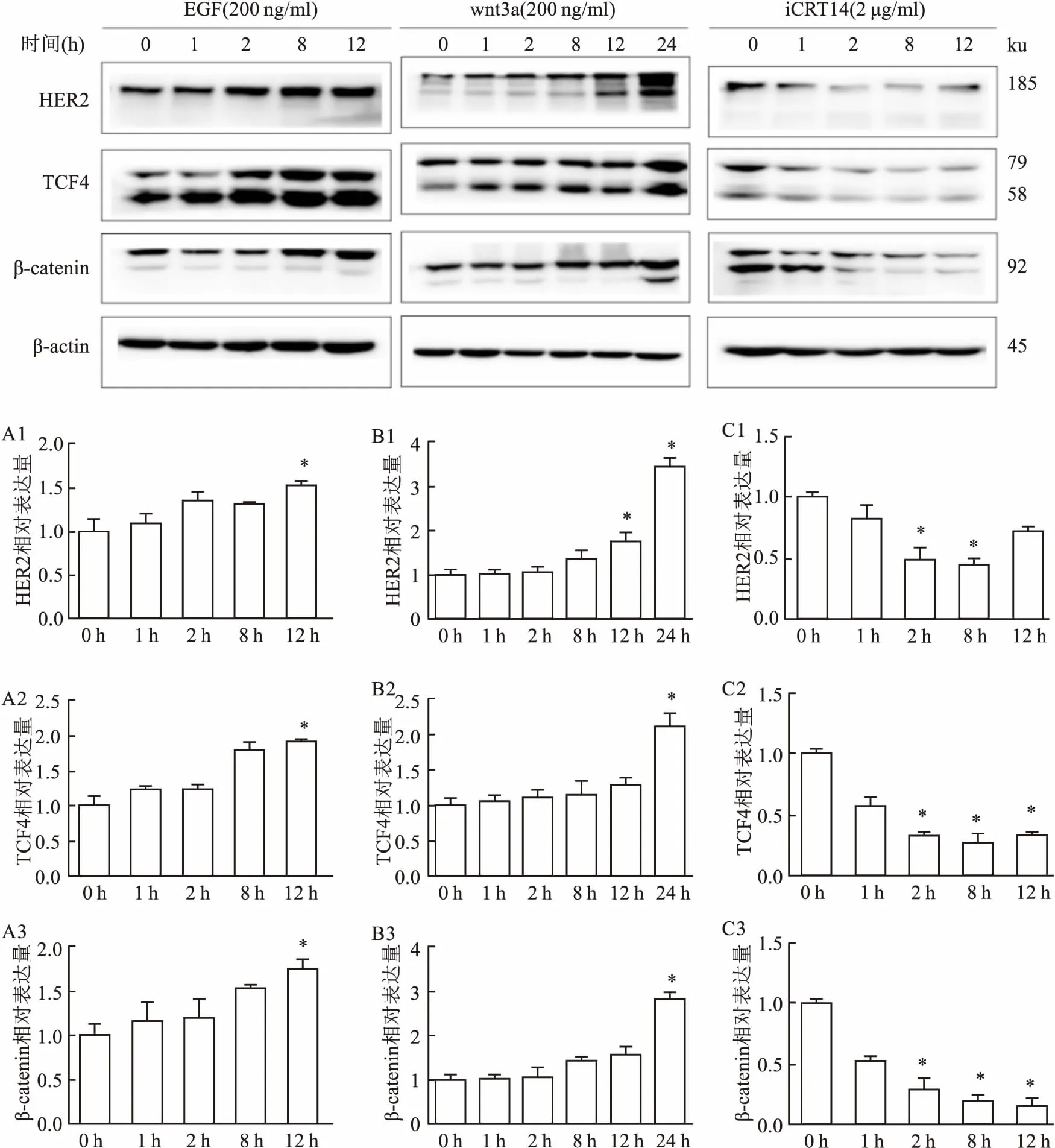
圖4 Western blot法檢測加入信號刺激劑或抑制劑對SKOV3細胞中HER2、β-catenin和TCF4表達的影響
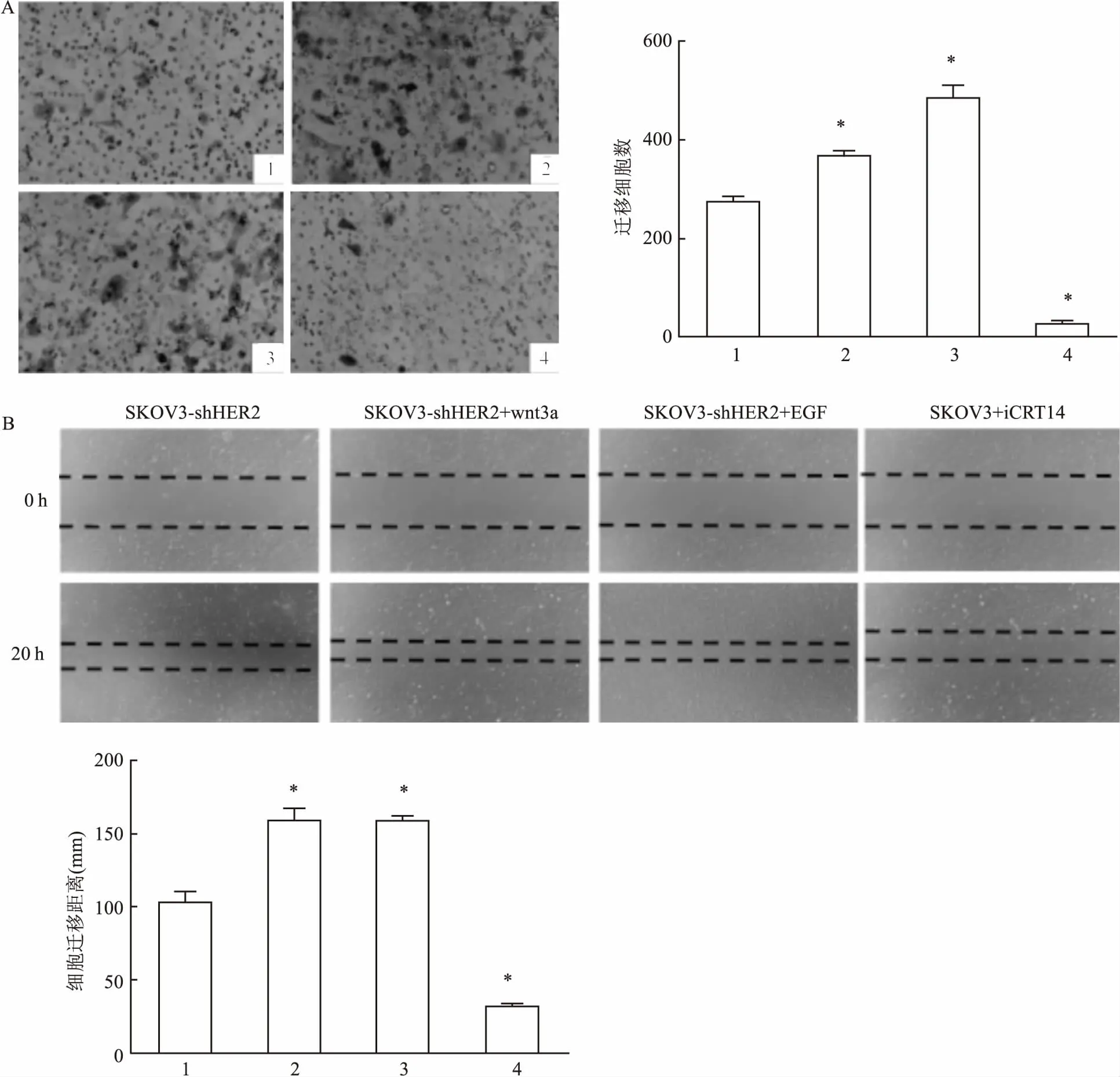
圖5Transwell實驗(×100)、劃痕實驗(×40)檢測信號刺激劑或抑制劑對SKOV3-shHER2細胞遷移能力的影響
A:Transwell實驗;B:劃痕實驗;1:SKOV3-shHER2;2: SKOV3-shHER2+wnt3a;3:SKOV3-shHER2+EGF; 4:SKOV3+iCRT14;與SKOV3-shHER2比較:*P<0.05
EGFR家族包括HER1/EGFR/ErbB1、HER2/ErbB2/Neu、HER3/ErbB3與HER4/ErbB4,其中HER2對EGFR的活化起著至關重要的作用,盡管配體在誘導EGFR家族受體二聚化過程中既可以形成同二聚體也可以形成異二聚體,但是,這些受體在HER2存在的條件下都傾向于優先與HER2形成異二聚體,從而促進腫瘤的生長、轉移和放化療抗性[9]。wnt信號通路主要包括wnt/β-catenin、wnt/planar cell polarity和wnt/Ca2+信號通路。其中wnt/β-catenin是經典通路,在生物進化中極為保守,主要調控細胞的增殖和分化;已有研究[10]證實,wnt及其通路蛋白成分過度表達或者突變等原因引起該信號通路異常活化,使β-catenin不能被降解而在胞質中積累,一定程度時向細胞核轉移,并與轉錄因子TCF/LEF家族蛋白結合形成轉錄復合物,從而激活cyclin D1、c-myc、MMP-7、Axin2等原癌基因,進而導致細胞的過度增殖與凋亡減少,細胞發生癌變。很多腫瘤細胞共表達HER2與wnt蛋白受體,并自分泌EGF與wnt等多種生長因子或可溶性蛋白,進而形成配體/受體/MAPK、PI3K與wnt信號通路之間的自分泌性正反饋激活。同時,受體下游MAPK、PI3K與wnt信號通路也可以通過某些效應分子對自身或者對方信號通路產生負反饋抑制,例如MPKs、PTEN與分泌性的frizzled相關蛋白等[11-13]。同時在曲妥珠單抗(trastuzumab)抗性腫瘤細胞株中wnt3蛋白的高表達可以促進wnt/β-catenin信號通路激活[14]。
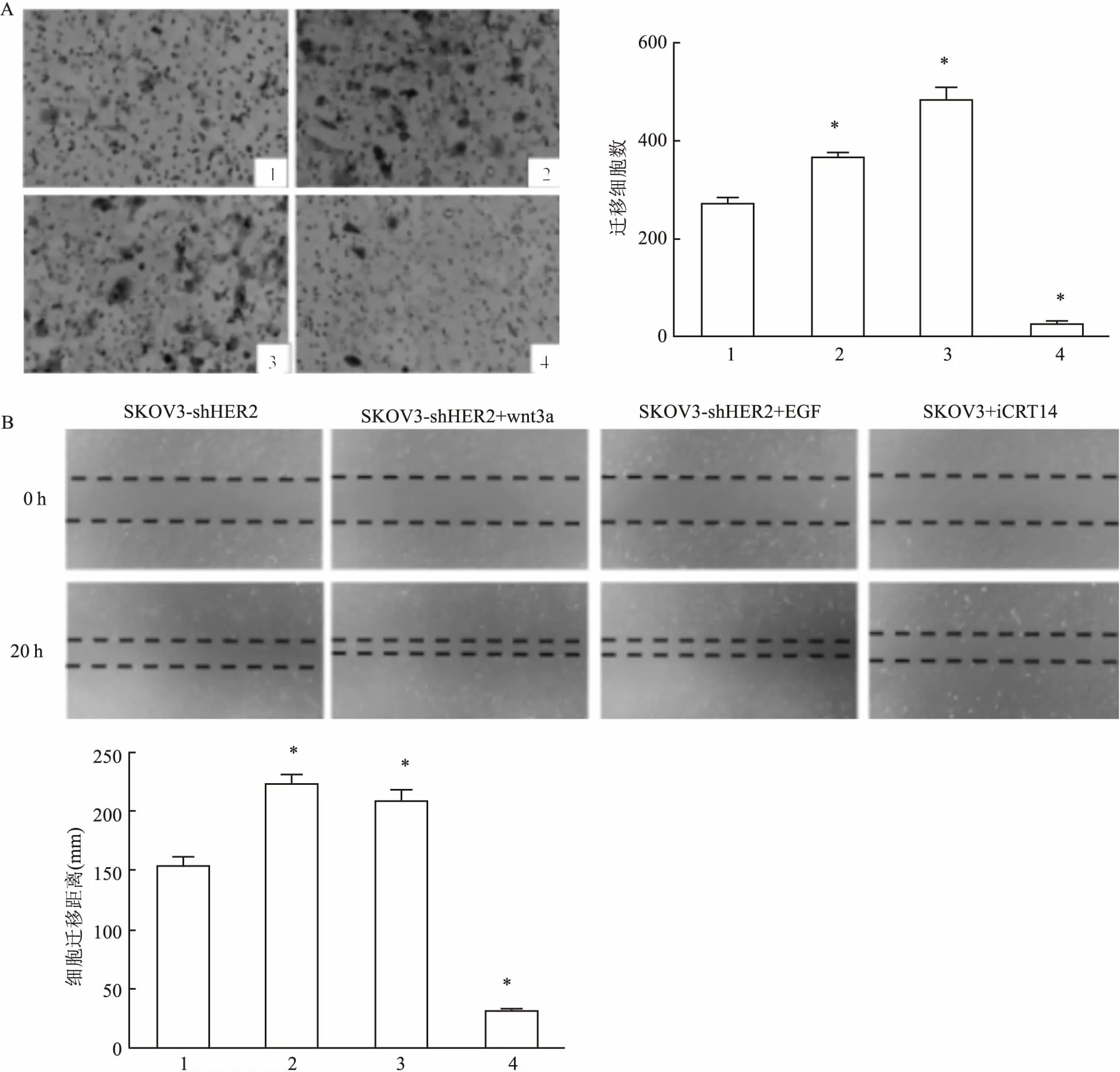
圖6Transwell實驗(×100)、劃痕實驗(×40)檢測信號刺激劑或抑制劑對SKOV3-shTCF4細胞遷移能力的影響
A:Transwell實驗;B:劃痕實驗;1:SKOV3-shTCF4;2:SKOV3-shTCF4+wnt3a;3:SKOV3- shTCF4+EGF;4:SKOV3+iCRT14;與SKOV3-shTCF4比較:*P<0.05
由于TCF4和β-catenin是wnt信號通路的兩個關鍵性節點分子,因此本實驗主要通過HER2、TCF4和β-catenin來研究HER2和wnt/β-catenin信號通路是否存在相互作用。首先構建了SKOV3-shHER2和SKOV3-shTCF4細胞株,使用Western blot驗證敲低效果,敲低成功后,同時采用Transwell實驗和劃痕實驗檢測敲低前后細胞遷移能力的變化,結果表明敲低HER2和TCF4后,均引起SKOV3細胞遷移能力的降低。同時Western blot實驗顯示敲低HER2,TCF4和β-catenin的表達會降低,而敲低TCF4,HER2的表達也同樣降低。結果提示HER2的表達和TCF4的表達相關。為了進一步研究HER2和TCF4之間的作用,分別使用了wnt3a和EGF以及wnt信號通路的小分子抑制劑iCRT14分別刺激SKOV3細胞,Western blot結果表明加入EGF后HER2的表達量會隨著刺激時間的延長而增高,同時TCF4和β-catenin的表達也隨之明顯增高;加入wnt3a后TCF4和β-catenin的表達量會隨著刺激時間的延長而增高,同時HER2的表達也隨之明顯增高;加入iCRT1后TCF4和β-catenin的表達量會隨著刺激時間的延長而減少,同時HER2的表達也明顯降低。在加入小分子抑制劑iCRT14 12 h后,HER2和TCF4的表達相比之前有所增加,考慮是iCRT14作用效果消失。Western blot的結果表明HER2和wnt/β-catenin信號通路存在相互作用。為了驗證這一結果,又采用Transwell和劃痕實驗檢測分別在SKOV3-shHER2和 SKOV3-shTCF4細胞加入EGF和wnt3a后,細胞遷移能力的變化。同時和在SKOV3加入iCRT14進行比較。結果表明,SKOV3-shHER2細胞在加入wnt3a后,細胞遷移能力明顯上升;SKOV3-shTCF4細胞在加入EGF后,細胞遷移能力明顯上升。在SKOV3加入iCRT14后,細胞遷移能力明顯降低,考慮是iCRT14濃度(25 nmol/L)過高。以上結果差異均有統計學意義。
綜上所述,在卵巢癌SKOV3細胞中,存在著HER2和wnt/β-catenin信號通路的相互作用,并促進了卵巢癌細胞的轉移,可以為卵巢癌耐藥性的產生原因及靶向治療藥物的聯合使用提供依據。但關于HER2和wnt/β-catenin信號通路進行相互作用的具體機制和作用靶點需要進一步研究。
[1] Jayson G C, Kohn E C, Kitchener H C, et al. Ovarian cancer[J]. Lancet, 2014, 384(9951):1376-88.
[2] Aval S F, Lotfi H, Sheervalilou R, et al. Tuning of major signaling networks (TGF-β, Wnt, Notch and Hedgehog) by miRNAs in human stem cells commitment to different lineages: possible clinical application[J]. Biomedicine & Pharmacotherapy, 2017, 91:849.
[3] Zhang Z, Lei A, Xu L, et al. Similarity in gene-regulatory networks suggests that cancer cells share characteristics of embryonic neural cells[J]. J Biol Chem, 2017,292(31):12842-59.
[4] Gui T, Shen K. The epidermal growth factor receptor as a therapeutic target in epithelial ovarian cancer[J]. Cancer Epidemiology, 2012, 36(5):490-6.
[5] 戴 朦, 沈國棟, 程 民,等. Wnt3a和TCF4在人卵巢癌中的表達及臨床意義[J]. 安徽醫科大學學報, 2016, 51(12):1794-8.
[6] Yamaguchi H, Chang S S, Hsu J L, et al. Signaling cross-talk in the resistance to HER family receptor targeted therapy[J]. Oncogene, 2014, 33(9):1073-81.
[7] 龔歡秀, 沈國棟, 胡世蓮,等. 乳腺癌HER-2靶向治療的現狀與發展前景[J]. 中國臨床保健雜志, 2016, 19(5):552-4.
[8] 毛必靜, 張志敏, 陳 川,等. HER2在胃癌靶向治療中的作用及意義[J]. 世界華人消化雜志, 2014,22(1):31-8.
[9] Li Y, Macdonald-Obermann J, Westfall C, et al. Quantitation of the effect of ErbB2 on epidermal growth factor receptor binding and dimerization[J]. J Biol Chem,2012,287(37):31116-25.
[10] Anastas J N, Moon R T. WNT signalling pathways as therapeutic targets in cancer.[J]. Nat Rev Cancer, 2013, 13(1):11-26.
[11] Timmermanssprang E P, Gracanin A, Mol J A. High basal Wnt signaling is further induced by PI3K/mTor inhibition but sensitive to cSRC inhibition in mammary carcinoma cell lines with HER2/3 overexpression.[J]. BMC Cancer, 2015, 15(1):1-12.
[12] Verdu M, Trias I, Roman R, et al. Cross-reactivity of EGFR Mutation-specific Immunohistochemistry Assay in HER2-positive Tumor[J]. Appl Immunohistochem Mol Morphol, 2015, 23(8):565-70.
[13] 金玲燕, 陳 琦. EGFR介導的下游信號通路與卵巢癌關系的研究進展[J]. 中國婦幼保健, 2015, 30(35):6403-6.
[14] Wu Y, Ginther C, Kim J, et al. Expression of Wnt3 activates Wnt/β-catenin pathway and promotes EMT-like phenotype in trastuzumab-resistant HER2-overexpressing breast cancer cells[J]. Mol Cancer Res, 2012, 10(12):1597-606.

