泛素特異性蛋白酶2a的原核表達純化及酶活性分析
張萬方,孫寅瑋,王孟慧,黃向瑜,樊松樂,徐 磊
USP2是一種去泛素化酶(deubiquitylating enzymes,DUB),位于11號染色體上(11q23.3)[1]。泛素化是蛋白質降解的一種重要方式[2]。DUB的作用主要是將泛素從目的蛋白上去掉,是維護機體泛素水平的一個重要機制[3],USP2基因經過5′末端的選擇性剪切可產生USP2a和USP2b兩個亞型。研究[4]表明USP2a與多種腫瘤的發生發展相關,沉默USP2a能誘導細胞凋亡。如在前列腺癌、乳腺癌、膀胱癌中USP2a能夠促進細胞的遷移和侵襲[5-7],抑制USP2a則誘導細胞凋亡[8]。另外,USP2a能穩定CyclinD1[9],參與細胞周期調控等。因此推測USP2a可能一種新的腫瘤標志基因[10]。該研究通過表達USP2a C末端重組蛋白,檢測重組USP2a蛋白的酶活性,并通過LC-MS/MS檢測USP2a對不同性質底物的酶活性情況,為進一步分析USP2a的催化機制,開發USP2a的功能型抑制劑提供重要的基礎。
1 材料與方法
1.1引物設計與合成以USP2a cDNA為模板,設計擴增其C末端結構域的特異引物,USP2a-1 F:5′-GGAATTCATGAATTCTAAGAGTGCCCAGG-3′(含有EcoR I酶切位點),USP2a-1 R:5′-CCGCTCGAGCTACATTCGGGAGGG-3′(含有Xho I酶切位點),引物由上海生工生物工程技術服務有限公司合成。
1.2目的片段的擴增與表達載體的構建采用25 μl PCR反應體系進行擴增;PCR反應條件:95 ℃預變性5 min;95 ℃、30 s,55 ℃、30 s,72 ℃、30 s,25個循環;72 ℃、8 min。產物進行電泳檢測并回收目的片段。PCR反應條件:95 ℃預變性5 min;95 ℃ 30 s、55 ℃ 30 s、72 ℃ 30 s,25個循環;72 ℃、 8 min。產物進行電泳檢測并回收目的片段。
1.3pET28-USP2a-C的表達與純化取單克隆菌落,接種于含有卡那霉素的LB培養基中,37 ℃、200 r/min過夜培養。第2天擴大培養到100 ml含有卡那霉素的LB液體培養基中,采用30 ℃、180 r/min繼續培養;檢測OD=0.6~0.8時進行IPTG誘導,IPTG濃度為0.8 mmol/L,誘導4 h后收集菌液;超聲裂解后,分別收集上清和沉淀,通過SDS-PAGE電泳分析蛋白表達情況。使用組氨酸標簽蛋白純化試劑盒,依照說明書進行蛋白純化。
1.4重組蛋白USP2a-C的酶活性分析使用SPEX Fluorolog-2 spectrofluorometer (激發光波長 λ, 380 nmol/L; 發射光波長 λ, 440 nmol/L) 檢測系統,分析重組蛋白的酶活性。根據米氏方程v=(Vmax×[S])/([S]+Km),對底物Ub-AMC進行梯度稀釋,分別測出每個濃度梯度的反應初始速率(v),以v對底物濃度[S]作圖,同時設立空白對照。
1.5LC-MS/MS分析蛋白USP2a-C的酶活性選取底物Ub-V77(肽鍵)和Di-Ub(異肽鍵)分別和USP2a-C進行反應,并分別在0、15、30、60、120 min時加入終止緩沖液(水 ∶乙腈 ∶乙酸=80 ∶20 ∶1)終止反應,反應結果在Agilent 1200 HPLC和Agilent Q6410上進行檢測[11],采用Mass Hunter workstation software進行數據處理,得到USP2a-C降解Ub-V77和Di-Ub的反應曲線圖。
1.6統計學處理由于USP2a-C蛋白催化分解底物的降解過程符合非線性關系,因此采用R Core Team,2015統計軟件,R語言中的nls函數進行非線性擬合,兩條非線性關系的顯著性檢驗采用Chen et al[12]提出的殘差平方和的F檢驗法。
2 結果
2.1USP2a的克隆以USP2a cDNA為模板,PCR擴增USP2a C末端催化結構域基因片段,產物經1%瓊脂糖凝膠電泳檢測,在1 000 bp左右處有特異性條帶,大小與預期相符。
連接載體pET28a(+),挑取單菌落經菌液PCR檢測和雙酶切鑒定,結果均能得到與預期大小一致的DNA條帶,見圖1。經過DNA測序證實USP2a C末端基因序列克隆成功,測序結果見圖2~5。
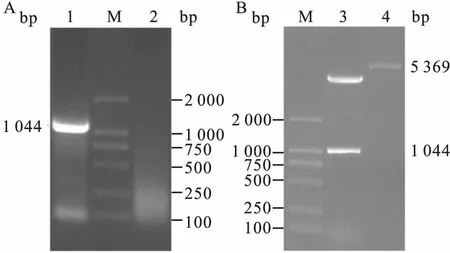
圖1 重組質粒pET28-USP2a-C的鑒定
A:PCR電泳圖;M:DNA Marker;1:USP2a-C;2:無模板空白對照;B:雙酶切電泳圖;3:重組質粒pET28-USP2a-C;4:空質粒pET28a

圖2 USP2a-C正向測序結果
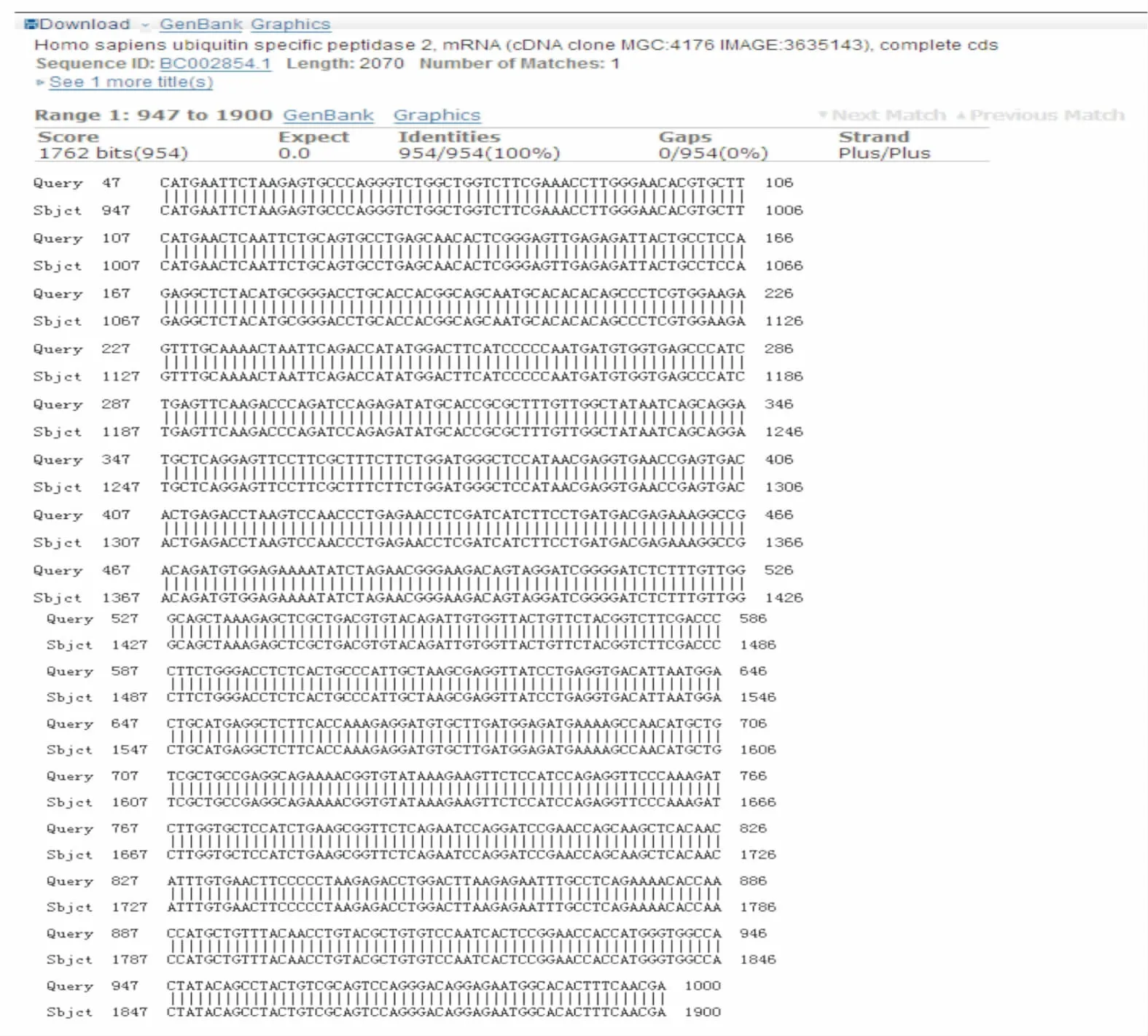
圖3 USP2a-C正向測序結果BLAST對比結果
圖4 USP2a-C反向測序結果
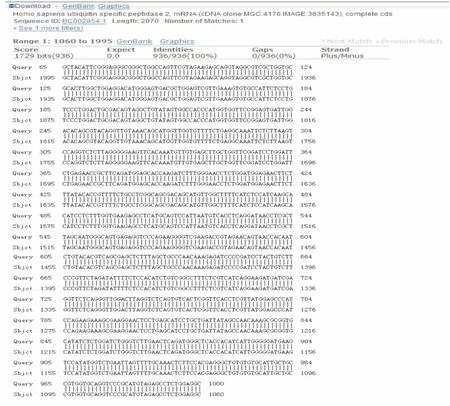
圖5 USP2a-C反向測序結果BLAST對比結果
2.2USP2a-C的表達與純化將測序正確的重組質粒pET28-USP2a-C進行表達與純化,SDS-PAGE電泳結果顯示,上清液中含有大量的目的蛋白,分子量41 ku,與預期大小相同,證明USP2a-C以可溶性蛋白的形式進行表達。確定表達條件后,大量表達純化USP2a-C蛋白,表達產物經Ni-NTA柱層析純化目的蛋白,收集樣品,得到純化的USP2a-C蛋白,見圖6 。
純化后SDS-PAGE電泳圖上只有目的蛋白一條帶,說明USP2a-C蛋白純化程度很高。使用LC-MS/MS分析純化的USP2a-C蛋白的純度和分子量。分析得到單一的主峰,檢測的分子量大小為41 361.8 ku與理論值(41 362.1 ku)一致,證明所純化得到的是USP2a-C目的蛋白,見圖7。
2.3USP2a-C蛋白的酶動力學分析根據米氏方程v=(Vmax×[S])/([S]+Km),得到USP2a-C分解Ub-AMC的最大反應速率Vmax=6.579 40×10-10mol/(L·s),米氏常數Km=1.085 68×10-6mol/L,催化常數Kcat=2.74×10-11/s,催化效率Kcat/Km=2.53×105mol/(L·s)。證實純化的USP2a-C蛋白具有良好的催化活性,見圖8。
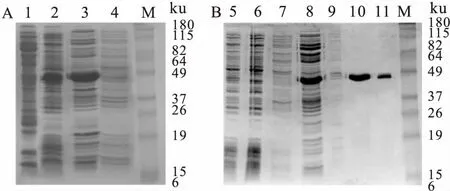
圖6 重組USP2a-C蛋白電泳圖
A:重組USP2a-C蛋白誘導表達圖;M: Marker(ku);1:空白對照;2:全菌液;3:超聲裂解后的上清液;4:超聲裂解后的沉淀;B:重組USP2a-C蛋白純化電泳圖;5~8:洗滌穿出液;9:Ni-NTA珠子;10~11:純化后的目的蛋白
2.4LC-MS/MS分析USP2a-C蛋白酶分解不同底物的酶活性分別選取了雙泛素Di-Ub(UbK48C-UbD77)和泛素的衍生物Ub-V77作為底物。其中Di-Ub中兩個乏素之間是正常的異肽鍵結構;底物Ub-V77的Ub和氨基酸殘疾V77之間是由肽鍵相連接。
從圖9可知,反應在加入酶后立即開始, 15 min時底物的Di-Ub被分解了45.83%,Ub-V77被分解了55.35%, 60 min時,底物Ub-V77的分解率已達到96.35%,Ub-V77的分解率也已達到90%左右,120 min時兩個反應均已檢測不到底物,反應結束。由此可以證明純化的USP2a-C蛋白具有完好的半胱氨酸蛋白酶活性,能有效地催化分解異肽鍵和肽鍵底物。
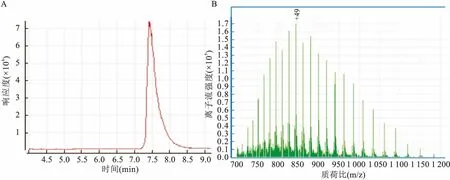
圖7 LC-MS/MS分析純化的USP2a-C的蛋白性質
A:USP2a-C催化水解梯度稀釋的Ub-AMC產物AMC的吸收值隨時間的變化圖;B:不同濃度梯度的Ub-AMC反應初速度對底物濃度的關系圖
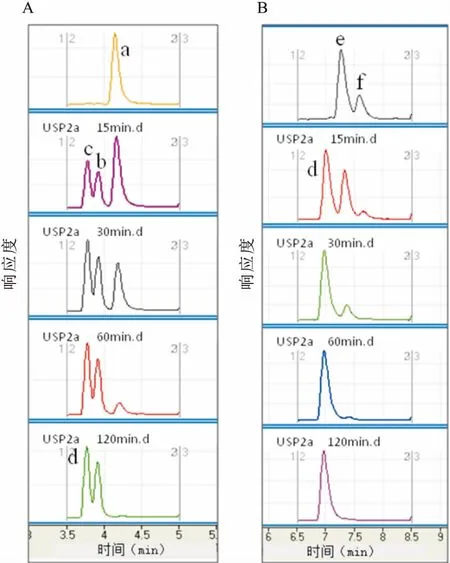
圖9 USP2a-C分解Di-Ub和Ub-V77的活性分析圖
a:Di-Ub;b:UbK48C;c:Ub-wt+Ub-D77;d:Ub-wt;e:Ub-V77;f:Ub-V77-SO2
2.5USP2a-C分解Di-Ub和Ub-V77酶活性的統計分析經過非線性擬合統計分析,顯示USP2a-C分解Di-Ub和Ub-V77兩種不同性質底物的反應進程的統計分析結果顯示差異無統計學意義,說明表達純化的USP2a-C蛋白半胱氨酸蛋白酶活性正常。見圖10。

圖10 USP2a-C催化分解底物的非線性擬合圖
3 討論
大腸桿菌原核表達系統具有操作簡單、成本低廉等優點,因此本研究選擇大腸桿菌表達系統。以USP2a cDNA為模板,用PCR法克隆了USP2a C末端催化結構域基因片段,成功構建了原核表達質粒pET28-USP2a-C,并獲得了可溶性表達的USP2a-C蛋白。為了檢測獲得的USP2a C末端片段的酶活性,本研究選用了DUB通用底物Ub-AMC檢測酶的活性,結果證明重組蛋白具有很高的酶活性,并且酶活性穩定,室溫放置3 h后酶活性依然不受影響。根據酶動力學原理,測定出了USP2a-C蛋白的酶動力學參數(米氏常數Km 、催化常數Kcat 以及催化效率Kcat/Km)與文獻[11]報道一致。
真核蛋白通過大腸桿菌進行表達多以包涵體的形式產生,通常沒有活性,需要通過體外復性使蛋白得以活化,復性過程對酶的量以及活性造成一定的損失,得到活性酶產量很少。因此對于原核表達的重組蛋白酶,獲得可溶性表達就顯得至關重要,本研究為了得到可溶性表達的USP2a-C重組蛋白,對誘導表達的條件進行了優化,通過20、25、30、37、42 ℃等一系列溫度的實驗,顯示在30 ℃條件下,誘導4 h可產生大量的可溶性表達的蛋白。
為了檢測表達的USP2a-C蛋白的半胱氨酸蛋白酶功能是否完整,本研究選用了兩種不同性質的底物Di-Ub和Ub-V77進行實驗。他們都不含熒光因子,不能通過熒光檢測分析酶活性,通常對于沒有熒光物質的底物在檢測酶活性時多使用SDS-PAGE的方法[13]。SDS-PAGE檢測方法通常是將反應體系配好后,按照反應條件的要求進行反應,等反應完成后,將整個反應體系進行SDS-PAGE電泳,通過電泳條帶的深淺以及有無判斷酶活性變化。但是SDS-PAGE不靈敏,而且只能觀察反應系統中底物或產物物質的量的最終變化結果,不能準確地對反應過程以及產物進行定性分析。本研究采用LC-MS/MS方法,不但能夠實時監測反應的進程情況,而且能對反應過程中底物或產物的變化進行定量檢測和定性測定。通過對LC-MS/MS檢測的USP2a-C降解兩種不同性質底物的反應進程進行非線性擬合統計分析后顯示,二者差異無統計學意義。說明表達純化的USP2a-C蛋白半胱氨酸蛋白酶具有完整的酶活性。
大量的研究[14-18]表明USP2a與多種腫瘤的發生發展具有重要關系,目前推測USP2a是一種新的腫瘤標志物。因此研究USP2a的活性功能以及底物特異性將對腫瘤的檢測與治療提供重要的理論依據。下一步將對USP2a的催化機制以及在細胞中的活性機制開展進一步的研究。
總之,本研究獲得了USP2a的可溶性表達并初步分析了USP2a活性情況,為今后研究USP2a催化機制以及開發USP2a抑制劑提供了重要基礎,對腫瘤的診斷和新藥的開發具有重要意義。
[1] Priolo C,Tang D,Brahamandan M,et al. The isopeptidase USP2a protects human prostate cancer from apoptosis [J]. Cancer Res,2006,66(17):8625-32.
[2] Daniel J A,Torok M S,Sun Z W,et al. Deubiquitination of histone H2B by a yeast acetyltransferase complex regulates transcription [J]. J Biol Chem,2004,279(3):1867-71.
[3] Nijman S M,Luna-Vargas M P,Velds A,et al. A genomic and functional inventory of deubiquitinating enzymes [J]. Cell,2005,123(5):773-86.
[4] Migita T,Ruiz S,Fornari A,et al. Fatty acid synthase:a metabolic enzyme and candidate oncogene in prostate cancer [J]. J Natl Cancer Inst,2009,101(7):519-32.
[5] Qu Q,Mao Y,Xiao G,et al. USP2 promotes cell migration and invasion in triple negative breast cancer cell lines [J]. Tumour Biol,2015,36(7):5415-23.
[6] Mahμl Mellier A,Datler C,Pazarentzos E,et al. De-ubiquitinating proteases USP2a and USP2c cause apoptosis by stabilising RIP1[J]. Biochim Biophys Acta,2012,1823(8):1353-65.
[7] Shan J,Zhao W,Gu W. Suppression of cancer cell growth by promoting cyclin D1 degradation[J]. Mol Cell,2009,36(3):469-76.
[8] Stevenson L F,Sparks A,Allende-Vega N,et al. The deubiquitinating enzyme USP2 are gulates the p53 pathway by targeting Mdm2 [J]. EMBO J,2007,26(4):976-86.
[9] Reglinski K,Keil M,Altendorf S,et al. Peroxisomal import reduces the proapoptotic activity of deubiquitinating enzyme USP2 [J]. PLoS One,2015,10(10):1-20.
[10] Shi D,Grossman S R. Ubiquitin becomes ubiquitous in cancer:emerging roles of ubiquitin ligases and deubiquitinases in tumorigenesis and as therapeutic targets [J]. Cancer Biol Ther,2010,10(8):737-47.
[11] Amerik A Y,Nowak J,Swaminathan S,et al. The Doa4 deubiquitinating enzyme is functionally linked to the vacuolar protein-sorting and endocytic pathways [J]. Mol Biol Cell,2000,11(10):3365-80.
[12] Chen Y,Jackson D A,Harvey H H. A comparison of von bertalanffy and polynomial functions in modeling fish growth data[J]. Can J Fish Aquatic Sci,1992,49(6):1228-35.
[13] Mcgouran J F,Gaertner S R,Altun M,et al. Deubiquitinating enzyme specificity for ubiquitin chain topology profiled by di-ubiquitin activity probes [J]. Chem Biol,2013,20(12):1447-55.
[14] Tong X,Buelow K,Guha A,et al. USP2a protein deubiquitinates and stabilizes the circadian protein CRY1 in response to in flammatory signals [J]. J Biol Chem,2012,287(30):25280-91.
[15] Shi Y,Solomon L R,Pereda-Lopez A,et al. Ubiquitin-specific cysteine protease 2a (USP2a) regulates the stability of aurora-a [J]. J Biol Chem,2011,286(45):38960-8.
[16] Benassi B,Marani M,Loda M,et al. USP2a alters chemotherapeutic response by modulating redox [J]. Cell Death Dis,2013,4:e812.
[17] Devine T,Dai M S. Targeting the ubiquitin-mediated proteasome degradation of p53 forcancer therapy [J]. Curr Pharm Des,2013,19:3248-62.
[18] Wei T,Biskup E,Gjerdrum L M,et al. Ubiquitin-specific protease 2 decreases p53-dependent apoptosis in cutaneous T-cell lymphoma [J]. Oncotarget,2016,7(30):48391-400.

