佛手柑內酯抑制p62/NF-κB信號軸增強順鉑對肝癌殺傷的影響
鄭志明,鄒海鵬,盧敏娟,林碧華,周克元
肝癌主要是臨床上最常見的惡性腫瘤之一[1]。2012年統計顯示,中國肝癌發生的病例數為394 770(占總癌癥發生病例的12.9%),死亡病例數為383 203(占總癌癥死亡病例的17.4%)[2],顯示出我國肝癌防治形勢的嚴峻。由于肝癌起病隱匿,進展迅速,患者確診時往往已有肝內轉移甚至肝外遠處轉移的發生[3],因此,化療在肝癌治療中起著重要作用。常用的肝癌的化療藥有順鉑、阿霉素、絲裂霉素和氟尿嘧啶等,但肝癌是化療藥物敏感性較低,且極易產生耐藥性,對肝癌患者的生存預后受益有限[4]。因此,揭示肝癌耐藥的分子機制并從中尋找到逆轉的方法,成為了近年來肝癌研究的熱點。在此,該文將觀察中藥有效成分佛手柑內酯在低濃度下對肝癌細胞順鉑誘導凋亡的影響,并著重分析佛手柑內酯對p62/NF-κB信號軸的影響。
1 材料與方法
1.1關鍵試劑及儀器RPMI-1640培養基、胎牛血清、青霉素-鏈霉素混合液及TRIzol購自美國Invitrogen公司;二甲基乙砜(DMSO, D119415)、佛手柑內酯(M101153)、Hoechst33258染料(B113844)及普通化學試劑購自上海阿拉丁試劑公司;CCK-8細胞增殖毒性檢測試劑盒購自日本同仁化學研究所;p62鼠單抗(66184-1-Ig)、p65兔多抗(10745-1-AP)、α-Tubulin(66031-1-lg)鼠單抗購自美國Proteintech公司;辣根過氧化物酶標記的山羊抗小鼠及山羊抗兔二抗購自美國Merck公司;PVDF膜、ECL發光液購自美國Millipore公司; Annexin V-FITC/PI凋亡檢測試劑盒、RIPA裂解液、5×蛋白上樣緩沖液、pNF-κB-TA-luc質粒、pGL6-TA-luc質粒、pRL-SV40-C質粒及雙螢光素酶報告基因檢測試劑盒購自上海碧云天生物研究所;反轉錄試劑盒及SYBR Green定量PCR試劑盒購自大連寶生物公司;實時定量PCR儀為CFX96、垂直電泳系統、槽式轉膜系統及冷凝CCD成像系統購自美國Bio-Rad公司;多功能酶標儀為Synergy2購自美國BioTek公司;流式細胞分析儀為FACSCanto II購自美國BD公司。
1.2細胞傳代培養及分組人肝細胞癌細胞HepG2和Bel-7402為廣東醫學院生物化學與分子生物學教研室長期傳代培養及規范凍存。HepG2和Bel-7402的培養條件為,含10% 胎牛血清、100 U/ml 青霉素、100 mg/L 鏈霉素的RPMI-1640培養基,37 ℃、5% CO2飽和濕度培養箱中培養。根據預實驗,確定1 μmol/L順鉑對兩肝癌細胞的48 h抑制率<50%,1 μmol/L佛手柑內酯對兩肝癌細胞的48 h抑制率<10%,上述兩濃度可以用于觀察佛手柑內酯對順鉑的增敏作用。因此,實驗組分三組,單用1 μmol/L順鉑(順鉑組),單用1 μmol/L佛手柑內酯(佛手柑內酯組),1 μmol/L順鉑與1 μmol/L佛手柑內酯聯用處理(聯合組),對照組為1% DMSO處理,各組處理時間均為48 h。
1.3CCK-8測定細胞活性參考文獻[5],將細胞接種于96孔培養板中,加入終濃度分別在0.1 μmol/L~1 mmol/L間的含順鉑或佛手柑內酯培養液正常培養48 h,當培養時間結束時,棄去原培養液,每孔加入含10 % CCK-8的培養液,5% CO2、37 ℃孵育2 h,酶標儀檢測各孔吸光度,扣除背景值后以未加藥孔為基準求算各藥物濃度的抑制率,利用兩點法求算半數抑制濃度。
1.4凋亡核形態計數分析參考文獻[6],按實驗分組處理后,棄除培養液,用PBS緩沖液洗滌細胞,加入0.5 mg/L Hoechest 33258染液避光染色20 min,利用倒置熒光顯微鏡觀察拍照,每組細胞在200×視野中隨機選取5個視野,計數典型的凋亡細胞形態:熒光增強,細胞核縮小碎裂,呈大小不等的圓形、花瓣狀或不規則塊狀。
1.5AnnexinV-FITC/PI凋亡率檢測參考文獻[5],按實驗分組處理后,胰酶消化細胞后收集,根據試劑盒提供的說明書操作:離心棄上清液并用PBS洗滌細胞1次,同前棄盡上清液后,按每1×105細胞加入195 μl Annexin V-FITC結合液重懸細胞后,加入5 μl Annexin V-FITC混勻室溫避光孵育10 min。離心棄上清液后,加入190 μl Annexin V-FITC結合液重懸細胞,加入10 μl PI染液混勻后冰浴。隨即進行流式細胞分析儀檢測,調整并收集每個樣品的前散射光、側散射光、Annexin V-FITC和PI四個通道的信號,并以前散射光/側散射光作散點圖圈出主細胞群,再以Annexin V-FITC/PI對主細胞群作圖分出Annexin V-FITC陽性、紅光陰性或陽性的凋亡細胞群,得到每組細胞的凋亡率。
1.6熒光定量PCR檢測參考文獻[5],按實驗分組處理后,棄去原培養基,PBS洗2次,加入TRIzol室溫裂解,氯仿抽提,離心后吸取上清液至新離心管中,加入異丙11醇沉淀RNA,用含75%乙醇的DEPC水溶洗滌RNA沉淀3次,用DEPC水溶解RNA。測得濃度后按PrimeScript RT reagent Kit說明書操作,進行反轉錄;按SYBR Premix Ex Taq II Kit說明書操作(引物信息見表1),在CFX96實時定量PCR系統上,選用2-ΔΔCT相對定量法進行檢測分析,其中選用GAPHD為內參基因,求算各目標基因的相對mRNA表達量。

表1 熒光定量PCR檢測所用引物
1.7熒光素酶報告基因活性檢測參考文獻[6],將細胞接種于24孔板中,24 h后換入Opti-MEN培養液。按10 ∶1分別混合pNF-κB-TA-luc或pGL6-TA-luc與pRL-SV40-C,并用Lipofectamine 2000包裝后轉染細胞。正常培養6 h后,按實驗分組替換為含藥完全培養液,繼續培48 h。去除培養液,PBS洗滌,加入裂解液充分裂解細胞后,離心取上清液轉于96孔板,利用Synergy2多功能酶標儀的自動加樣裝置,按檢測順序自動加入螢火蟲熒光素酶檢測試劑和腎熒光素酶檢測試劑,并以空白孔為參照測定每孔的相對熒光信號,按下列公式計算相對實驗組的相對熒光強度:
1.8Westernblot檢測參考文獻[5],按實驗分組處理后,棄去原培養基,PBS洗2次,加入RIPA裂解液冰上裂解,離心收集上清液,按BCA蛋白定量試劑盒說明書進行蛋白定量,向上清液加入5×上樣緩沖液,沸水浴變性蛋白。使用SDS-PAGE蛋白電泳系統,上樣量為50 μg總蛋白,電泳參數為10%分離膠、5%濃縮膠,100 V電泳至溴酚藍指示劑遷移至底部后,進行電轉移,使用0.2 μm的PVDF膜,300 mA冰浴電轉90 min。電轉結束后,膜使用5%脫脂奶粉封閉,TBST漂洗后,加入稀釋的一抗工作液(按產品說明書稀釋配制),4 ℃孵育過夜,TBST漂洗后,加入稀釋的二抗工作液(按產品說明書稀釋配制),室溫孵育1 h,TBST漂洗后,加入ECL發光液,置壓片夾中用X光片感光,經顯影定影后,得到相應的Western blot結果。
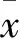
2 結果
2.1佛手柑內酯對肝癌細胞的活性抑制利用梯度佛手柑內酯處理肝癌HepG2和Bel-7402細胞48 h后,利用兩點法求算半數抑制濃度分別為(194.0 ± 146.7) μmol/L和(331.7 ± 209.7) μmol/L。此外,利用1 μmol/L順鉑處理肝癌HepG2和Bel-7402細胞48 h后,兩細胞的抑制率分別為(69.0±1.5)%和(71.3±1.4)%,均高于90%;利用1 μmol/L佛手柑內酯處理肝癌HepG2和Bel-7402細胞48 h后,兩細胞的抑制率分別為(93.4±1.6)%和(94.7±1.0)%,均高于90%,故后續實驗中順鉑與佛手柑內酯的濃度均選用1 μmol/L。
2.2佛手柑內酯對肝癌細胞凋亡核形態的影響按實驗分組處理肝癌HepG2和Bel-7402細胞48 h后,如圖1所示,相對于對照組,順鉑組和佛手柑內酯組均能誘導肝癌細胞出現凋亡核形態,但順鉑組凋亡核形態明顯多于佛手柑內酯組(P<0.05);聯合組中兩肝癌細胞的凋亡核形態比順鉑組分別增加1.99倍和2.00倍,差異有統計學意義(P<0.05)。
2.3佛手柑內酯對凋亡細胞群的影響按實驗分組處理肝癌HepG2和Bel-7402細胞48 h后,如圖2所示,相對于對照組,佛手柑內酯組和順鉑組中均有肝癌細胞出現凋亡,但順鉑組凋亡明顯多于佛手柑內酯組(P<0.05);聯合組中兩肝癌細胞的凋亡細胞群比例比順鉑組分別增加1.86倍和2.00倍,差異有統計學意義(P<0.05)。
2.4佛手柑內酯對抗凋亡相關基因表達的影響按實驗分組處理肝癌HepG2和Bel-7402細胞48 h后,如圖3所示,相對于對照組,佛手柑內酯組和順鉑組中,BCL2、BCL2L1、XIAP和BIRC5均不同程度地降低,不同藥物對不同基因的誘導降低效果不一;聯合組中兩肝癌細胞的抗凋亡相關基因的下調較佛手柑內酯組或順鉑組均更為顯著,差異有統計學意義(P<0.05)。
2.5佛手柑內酯對NF-κB轉錄活性的影響按實驗分組處理肝癌HepG2和Bel-7402細胞48 h后,如表2所示,相對于對照組,佛手柑內酯組與順鉑組中,肝癌細胞NF-κB轉錄活性降低,且佛手柑內酯組NF-κB轉錄活性較順鉑組更低(P<0.05);聯用組中兩肝癌細胞NF-κB轉錄活性僅為順鉑組的0.28倍和0.25倍,差異有統計學意義(P<0.05)。
圖1 佛手柑內酯對肝癌細胞凋亡核形態的影響 ×100

圖2 佛手柑內酯對凋亡細胞群的影響

圖3 佛手柑內酯對抗凋亡相關基因表達的影響
A:HepG2細胞:B:Bel-7402細胞;1:對照組;2:佛手柑內酯組;3:順鉑組;4:聯用組;與對照組比較:*P<0.05;與順鉑組比較:#P<0.05
表2 佛手柑內酯對NF-κB轉錄活性的影響(n=3,±s)
與對照組比較:*P<0.05;與順鉑組比較:#P<0.05
2.6佛手柑內酯對p62及p65蛋白表達的影響按實驗分組處理肝癌HepG2和Bel-7402細胞48 h后,如圖4所示,相對于對照組,佛手柑內酯組和順鉑組中,p62及p65蛋白表達水平下調;聯合組肝癌細胞中p62及p65蛋白的表達水平降低更為顯著。
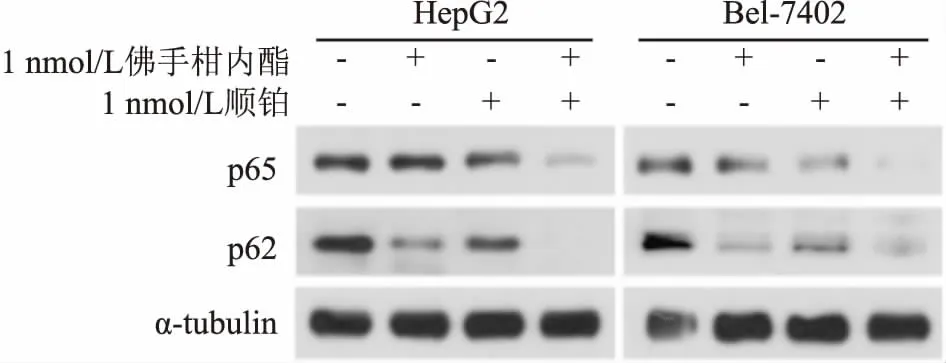
圖4 佛手柑內酯對p62及p65蛋白表達的影響
3 討論
佛手柑內酯屬于呋喃型香豆素類天然產物,為多種植物的次級代謝物,更是中藥佛手[7]和當歸[8]等的主要有效成分之一,具有抗炎、平喘、鎮靜及催眠等藥理作用[9]。最近的研究顯示,佛手柑內酯對多種惡性腫瘤具有顯著的抑制作用,如乳腺癌[10]及白血病[9]等。本課題組的前期研究[11]也顯示,佛手柑內酯對鼻咽癌細胞具有抑制增殖并誘導凋亡的作用,表明佛手柑內酯具有一定的抗腫瘤活性,然而佛手柑內酯對腫瘤細胞的有效抑制濃度較高,不宜作為單獨的抗腫瘤藥物開發。在此,本研究利用低濃度(1 nmol/L)的佛手柑內酯與1 nmol/L順鉑聯用處理肝癌細胞,顯示其能顯著增強順鉑對肝癌細胞的殺傷能力,暗示了低濃度佛手柑內酯可以作為化療藥物增敏劑的作用。
大量的研究[12]證實,炎癥相關的NF-κB在包括肝癌在內的多種惡性腫瘤組織及細胞中表達上調并維持異常激活狀態,參與了腫瘤細胞的增殖、侵襲、轉移、復發和抗腫瘤治療耐受等密切相關。靜息狀態時,NF-κB二聚體(p50,p65)與細胞質的抑制因子IκBα結合,以無活性的狀態存在于細胞質中;當細胞內外的各種信號通過級聯傳導,使IκB激酶磷酸化IκBα導致IκBα降解而NF-κB恢復活性的游離狀態,激活的NF-κB入核與DNA結合,促進下游靶基因轉錄[13]。在腫瘤細胞抗化療的機制中,癌細胞能通過持續激活的NF-κB,上調抗凋亡因子如BCL2、BCL2L2、XIAP和BIRC5等的過量表達,發揮促存活作用[12]。本研究顯示,低濃度(1 nmol/L)的佛手柑內酯與1 nmol/L順鉑聯用處理肝癌細胞,能顯著抑制NF-κB的轉錄活性,并降低細胞中BCL2、BCL2L2、XIAP和BIRC5等的表達,表明了低濃度的佛手柑內酯是通過抑制NF-κB的轉錄活性,降低了抵抗凋亡的多個基因表達水平,從而增強順鉑的殺傷作用。
研究[14]顯示,在肝癌組織與細胞中,NF-κB的持續性激活可能與多功能蛋白p62的異常高表達相關,敲除p62顯著抑制NF-κB的激活。p62是一種多功能泛素結合蛋白,在細胞信號轉導中起支架和適配的作用,p62分子結構中的多個功能結構域可與其它蛋白質相互作用,參與泛素蛋白酶體系統和自噬-溶酶體系統兩種蛋白降解過程[15]。研究[15]顯示p62調控NF-κB主要方式,是通過TB結構域結合TRAF,形成p62-TRAF6-IKKβ-aPKC 的信號復合物激活NF-κB通路;在此通路中,p62與MAPK激酶激酶前端基本區域MEKK3結合作為活動中心募集TRAF6及其他聚合物,進一步促進TRAF6的寡聚化及泛素化,最終誘導NF-κB的激活。本研究顯示,低濃度(1 nmol/L)的佛手柑內酯與1 nmol/L順鉑聯用處理肝癌細胞,能顯著抑制p62蛋白的表達水平,這可能是NF-κB表達及轉錄活性受抑制的可能機制。后續的研究中將進一步通過實驗揭示,佛手柑內酯下調p62的具體機制,并通過裸鼠模型,進一步探討低濃度佛手柑內酯作為化療藥物增敏劑的可能性。
[1] Mazzanti R, Gramantieri L, Bolondi L. Hepatocellular carcinoma: Epidemiology and clinical aspects [J]. Mol Aspects Med, 2008, 29(1-2): 130-43.
[2] Wang D, Li X, Liu J, et al. Effects of TRPC6 on invasibility of low-differentiated prostate cancer cells [J]. Asian Pac J Trop Med, 2014, 7(1): 44-7.
[3] Shin J W, Chung Y H. Molecular targeted therapy for hepatocellular carcinoma: current and future [J]. World J Gastroenterol, 2013, 19(37): 6144-55.
[4] Lau C K, Yang Z F, Ho D W, et al. An Akt/Hypoxia-inducible factor-1 alpha/Platelet-derived growth factor-BB autocrine loop mediates hypoxia-induced chemoresistance in liver cancer cells and tumorigenic hepatic progenitor cells [J]. Clin Cancer Res, 2009, 15(10): 3462-71.
[5] 張 鑫, 林永文, 鄭愛華, 等. 三七皂苷R1對過氧化氫誘導大鼠星形膠質細胞凋亡的影響 [J]. 中華臨床醫師雜志(電子版), 2013, 7(15): 7048-53.
[6] Zhang X, Liu J, Zang D, et al. Upregulation of miR-572 transcriptionally suppresses SOCS1 and p21 and contributes to human ovarian cancer progression [J]. Oncotarget, 2015, 6(17): 15180-93.
[7] 崔紅花, 高幼衡, 蔡鴻飛, 等. 川佛手化學成分研究(Ⅱ) [J]. 中藥新藥與臨床藥理, 2009, 20(4): 344-7.
[8] 楊秀偉, 王繼彥, 嚴仲鎧, 等. 四種長白山產當歸屬藥用植物的香豆精成分研究 [J]. 中藥材, 1994, 17(4): 30-2,53.
[9] Salvador A, Dall'Acqua S, Sardo M S, et al. Erythroid induction of chronic myelogenous leukemia K562 cells following treatment with a photoproduct derived from the UV-A irradiation of 5-methoxypsoralen [J]. Chem Med Chem, 2010, 5(9): 1506-12.
[10] De Amicis F, Aquila S, Morelli C, et al. Bergapten drives autophagy through the up-regulation of PTEN expression in breast cancer cells [J]. Mol Cancer, 2015, 14: 130.
[11] 林碧華, 馬曉娟, 萬樹偉,等. 佛手柑內酯對鼻咽癌細胞凋亡的影響[J]. 腫瘤防治研究, 2014, 41(11): 1163-70.
[12] Wang W, Nag S A, Zhang R. Targeting the NFκB signaling pathways for breast cancer prevention and therapy [J]. Curr Med Chem, 2015, 22(2): 264-89.
[13] Madonna G, Ullman C D, Gentilcore G, et al. NF-κB as potential target in the treatment of melanoma [J]. J Transl Med, 2012, 10: 53.
[14] Duran A, Hernandez E D, Reina-Campos M, et al. p62/SQSTM1 by binding to Vitamin D receptor inhibits hepatic stellate cell activity, fibrosis, and liver cancer[J]. Cancer Cell, 2016, 30(4): 595-609.
[15] Moscat J, Karin M, Diaz-Meco M T. p62 in cancer: signaling adaptor beyond autophagy [J]. Cell, 2016, 167(3): 606-9.

