組織蛋白酶S抑制劑影響小鼠缺血誘導的血管新生的機制研究
李洋,樸穎,類延娜,成憲武,李香
組織蛋白酶S(cathepsins S,CatS)是一類蛋白水解酶,它們廣泛地分布在人體各種細胞的溶酶體中,主要參與細胞溶酶體內蛋白質再利用[1]。目前為止,在人體組織及細胞發現了11種組織蛋白酶。其家族中,研究表明,CatS是一種在細胞內、外都具有很強生物活性(如膠原,彈性蛋白等分解活性)的半胱氨酸蛋白酶。2012年,Circulation雜志發表的文章闡明了組織蛋白酶通過細胞外基質分解及在心血管細胞和炎癥-免疫細胞生物行為中,促進各種心血管疾病的發生、發展[2]。過氧化物酶增殖物激活受體(peroxidase proliferation activated receptors ,PPAR)是核受體超家族成員。PPAR 包括 PPAR-α、PPAR-β/δ 和 PPAR-γ三種表型[3]。由于PPAR 參與調控機體眾多病理生理過程,以此為靶點,開發和利用它們的高選擇性激動劑具有重要的科學意義及廣闊的應用前景。目前較多的研究集中于CatS在動脈硬化性心血管疾病中的表達及其作用,而CatS在缺血性血管生成中表達及其作用鮮有報道[4]。本研究旨在觀察CatS抑制劑(CatS-I)影響小鼠缺血誘導的血管新生機制。
1 材料與方法
1.1 動物來源與分組
將8周齡、體重21~25 g的野生型小鼠(C57/BL6,由日本名古屋大學動物實驗室提供)按照隨機數字表法分為兩組:對照組和CatS-I組,每組各20只。對照組采用基礎飼料飼養基礎上再注射5%羧甲基纖維素鈉鹽(CMC),每天1次,腹腔注射,共17天;CatS-I組在基礎飼料飼養基礎上再注射CatS-I[1 mg/(kg·d)],每天 1次,腹腔注射,共17天。兩組腹腔注射3天后建立下肢缺血模型。分別測定術前、術后即刻、4天、7天、14天的下肢血流;術后第4天利用蛋白免疫印跡(Western)雜交技術檢測PPAR-γ、磷酸化蛋白激酶B(p-Akt)、磷酸化內皮一氧化氮合酶(p-eNOS)和血管內皮生長因子(vascular endothelia growth factor, VEGF)等蛋白表達水平;術后第7天,取缺血骨骼肌制作冰凍切片,采用免疫組織化學方法測定毛細血管密度。
1.2 試劑
甘油醛-3-磷酸脫氫酶(GAPDH)購自于美國Cell signaling Technology 公司;p-Akt 購自于美國 Cell signaling Technology公司;蛋白激酶B(Akt)購自于美國Santa Cruz Biotechnology公司;p-eNOS (Ser1177)購自于美國BD Biosciences公司;eNOS購自于美國BD Biosciences公司;PPAR-γ購自于美國Abcam公司;CD31 單克隆抗體購自于美國 Santa Cruz 公司。
1.3 小鼠單側下肢缺血模型的建立
小鼠腹腔注射戊巴比妥(60 mg/kg)進行麻醉,麻醉后進行脫毛,采取仰臥位固定,切開小鼠左側下腹部皮膚后,首先分離股神經后結扎股動脈根部,剝離股動脈三個主要分支并結扎,然后切除股動脈主干及其分支,建立下肢缺血模型。
1.4 蛋白免疫印跡法檢測蛋白水平
用蛋白裂解液提取細胞或組織總蛋白,按試劑盒說明進行,測提取液的蛋白質水平。通過聚丙烯酰胺凝膠(SDS-PAGE)電泳、轉膜、雜交、顯色、分析等步驟檢測靶蛋白的表達水平。該實驗重復3次。信號通路的檢測:檢測當日肌肉組織的總蛋白,用BCA定量法檢測蛋白含量。取10μg蛋白上樣到12.5% SDS-PAGE凝膠進行電泳,然后電轉移到硝酸纖維素膜上。5%脫脂牛奶封閉,4℃過夜。分 別 加 入 GAPDH、p-Akt、Akt、p-eNOS、eNOS、PPAR-γ。室溫孵育1 h, 用TBST緩沖液[TrisHCL(1mmol/L,pH 7.5):50 ml、Nacl:8 g、KCL:0.2 g、吐溫:0.5 ml ,加蒸餾水定容至1 L]搖動洗膜3次 (10 min/次)。加入辣根過氧化物酶標記的羊抗兔IgG (美國ROCKLAND公司),室溫孵育1 h,用TBST搖動洗膜三次 (10 min/次)。最后進行熒光掃描,應用圖像分析系統進行光密度掃描、分析[5]。
1.5 缺血下肢肌肉組織中毛細血管密度的判斷和計數
采用激光多普勒血流成像儀(瑞典Lisca Development,Linkoping公司)測量術前、術后不同時間點的缺血側(左側下肢)和對側非缺血側(右側下肢)的血流灌注情況。每次測量之前,小鼠腹腔注射戊巴比妥(60 mg/kg)進行麻醉,麻醉后采取仰臥位,置于37℃條件下15 min。仰臥位掃描之后,存儲圖像,圖像存儲形式為整個雙下肢區域的二維圖像,經過PIMⅡ Patch Test WIZARD軟件分析,血流灌注情況用激光多普勒血流平均值表示。用每只小鼠同一時間點的缺血側與非缺血側的下肢血流灌注的比值表示同只鼠的缺血下肢血流恢復情況。
下肢肌肉組織行冰凍切片(5 μm),采用CD31單克隆抗體免疫組化染色法標記血管內皮細胞以測定毛細血管數量和密度。取5個肌肉橫切面視野,計算每個視野的毛細血管數量,取其平均值。毛細血管密度用每高倍視野(×400)下,毛細血管與肌纖維數量的比值表示[6]。
1.6 免疫組織化學染色
應用免疫組織化學檢測試劑盒(丹麥DAKO公司產品)及與增殖相關的CD31單克隆抗體(美國Santacruz/Cell Signaling公司產品)。染色步驟按說明書操作步驟進行。為證明抗體免疫組化檢測特異性,實驗中應用了免疫動物IgG代替一抗作為陰性對照[5]。
1.7 統計學方法
統計學分析應用SPSS15.0統計軟件。計量數據以均數±標準差表示,組間比較采用Tukey post hoc test 進行多重比較。計數資料的比較采用χ2檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 兩組缺血與非缺血下肢血流的動態變化(圖1)
CatS-I組明顯抑制下肢血流的恢復。術后即刻、術后1天血流明顯下降,術后第4天開始血流逐漸恢復,術后第14天CatS-I組小鼠缺血下肢血流恢復明顯慢于對照組(P<0.05)。
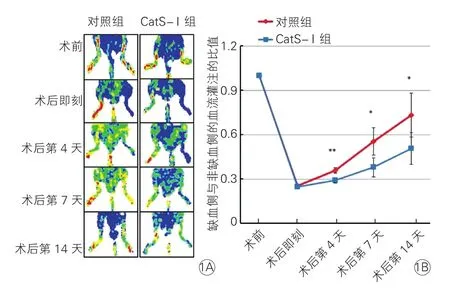
圖1 兩組的激光多普勒血流成像(1A)和缺血側與非缺血側下肢血流灌注的比值統計圖(1B)
2.2 利用CD31免疫組織化學染色觀察兩組骨骼肌毛細血管的形成(圖2)
術后第14天, 與對照組比較,CatS-I組的非缺血骨骼肌中毛細血管形成略減少,但差異無統計學意義(P>0.05),但缺血骨骼肌中毛細血管形成明顯受阻。毛細血管密度統計圖(圖2B)表明,CatS-I組小鼠的毛細血管密度明顯低于對照組(P<0.01)。
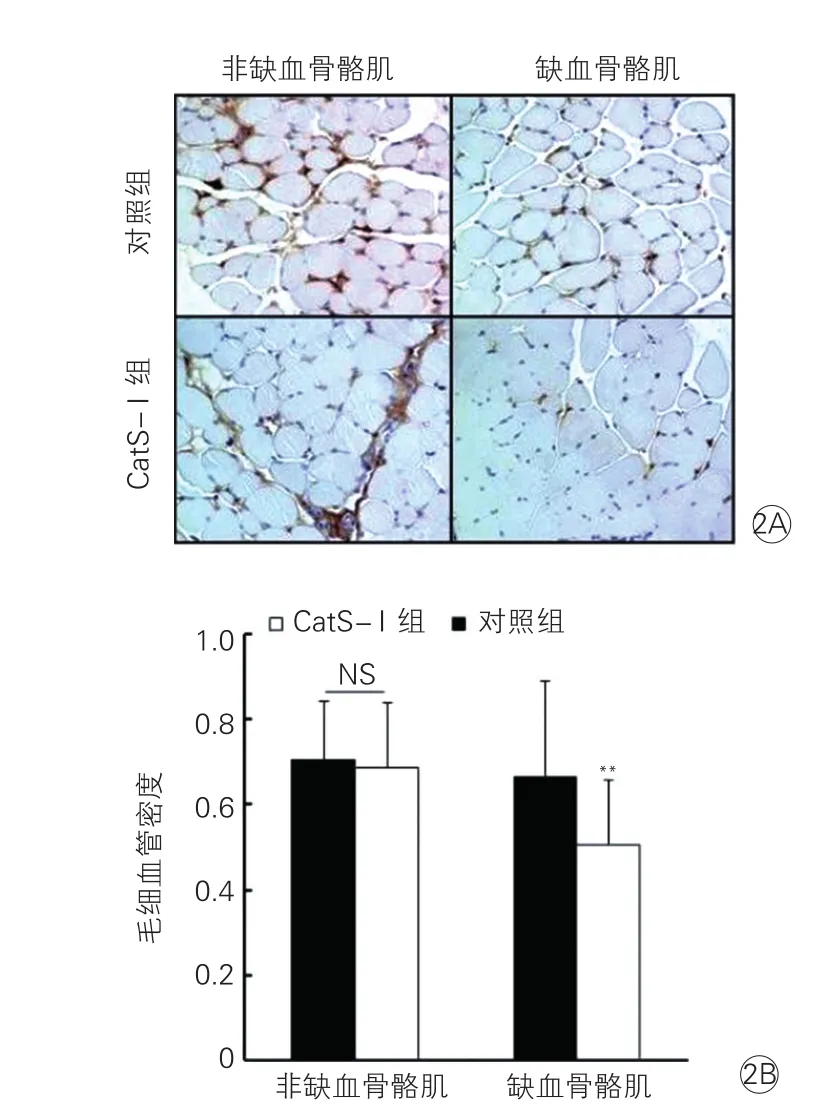
圖2 術后第14天兩組小鼠缺血與非缺血骨骼肌中毛細血管密度比較(×400)
2.3 蛋白免疫印跡雜交法檢測兩組與血管新生有關分子的蛋白水平表達(圖3)
PPAR-γ、p-Akt、p-eNOS和VEGF等蛋白的免疫印跡圖和表達水平的定量分析結果表明:CatS-I組小鼠中,PPAR-γ、p-Akt、p-eNOS和VEGF等蛋白水平與對照組比較明顯減少(P<0.05)。
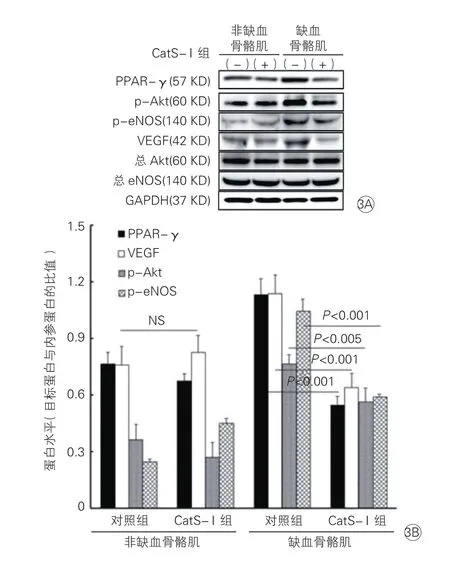
圖3 蛋白免疫印跡法比較兩組小鼠缺血與非缺血骨骼肌中蛋白表達水平
3 討論
2004 年,Cheng等[7,8]報道了CatS 在損傷性增生內膜及心力衰竭心肌中表達明顯增高,并在心血管重構中起著重要作用。此后,也發現CatS主要在血管平滑肌細胞膜外與ανβ3 整合素結合,調控平滑肌細胞的移動及浸潤功能[9]。藥物干預CatS 可以抑制動脈斑塊形成及改善斑塊穩定性[10]。這些研究結果提示,CatS 參與動脈粥樣斑塊形成、發展、破裂和破裂后修復的全過程。以往的散在報道顯示:一方面,CatS通過降解、失活堿性成纖維細胞生長因子(basic fibroblast growth factor,BFGF)或分解Ⅳ型膠原蛋白產生具有抗血管新生活性的血管抑制素,另一方面,通過修飾以及釋放血管生長調節因子控制腫瘤血管新生[11]。許多動物實驗及臨床研究顯示:骨髓和外周血血管內皮祖細胞(endothelial progenitor cell, EPC)細胞移植可以促進缺血性血管新生、改善缺血癥狀[12]。本研究結果表明:CatS-I明顯抑制下肢血流的恢復及毛細血管的形成。揭示:CatS在動脈粥樣硬化性血管疾病的發生、發展中發揮著重要的作用,亦可能參與血管內皮細胞(endothelial cell,EC)和EPC 的功能調控。下肢缺血性疾病最主要的病因為動脈粥樣硬化,因此,CatS 可以成為參與缺血性血管新生的關鍵成員。
研究結果公認:PPAR-γ主要表達在脂肪組織,它介導脂肪細胞分化,并在糖和脂肪酸代謝中發揮調節作用的重要基因。最近,PPAR-γ在心血管系統和炎癥-免疫細胞中表達及其作用越來越受到重視。2013 年,Kroller-Schon 等[13]的主要研究成果闡明了PPAR-γ共激活因子(PPAR-γ coactivator-1α, PGC-1α) 具有抵抗血管緊張素誘導的血管損傷和炎癥反應。Wolf等[14]發現,PPAR-γ阻滯劑可以抑制Akt的磷酸化,從而通過抑制上述內皮細胞的遷移作用而發揮作用。另有研究表明:PPAR-γ激活通過降低腫瘤壞死因子-α(TNF-α)分泌改善糖尿病小鼠胰島素抵抗[15]。隨后的研究還證實了PGC-1α通過促進缺氧誘導的VEGF合成,促進EC的血管形成效應[16]。內皮素-1可以減弱在慢性肺動脈高壓動物宮內內皮細胞的PPAR-γ通路,且抑制血管新生[14]。另一方面,PPAR-γ 激動劑通過絲裂原活化蛋白激酶(mitogen-activated protein K inase,MAPK)-PGC-1α-eNOS-NO 通路抗 EC 凋亡[17]。
綜上,CatS-I明顯抑制下肢血流的恢復及毛細血管的形成,CatS-I組小鼠中,PPAR-γ、p-Akt、p-eNOS和VEGF等蛋白水平與對照組比較明顯減少。因此,CatS在缺血性血管新生中的作用可能是CatS通過PPAR-γ激活及PI3K/Akt/eNOS 信號通路調控EPC分化,增殖及血管生成機制。CatS有望成為治療缺血性心血管疾病的新的分子靶點。
[1] Turk B, Turk D, Turk V. Lysosomal cysteine proteases: more than scavengers[J]. Biochim Biophys Acta, 2000, 1477(1-2): 98-111. DOI:10. 1016/S0167-4838(99)00263-0.
[2] Cheng XW, Shi GP, Kuzuya M, et al. Role for cysteine protease cathepsins in heart disease: focus on biology and mechanisms with clinical implication[J]. Circulation, 2012, 125(12): 1551-1562. DOI:10. 1161/CIRCULATIONAHA. 111. 066712.
[3] Ahmadian M, Suh JM, Hah N, et al. PPARγ signaling and metabolism: the good, the bad and the future[J]. Nat Med, 2013, 19(5):557-566. DOI: 10. 1038/nm. 3159.
[4] Li X, Cheng XW, Hu L, et al. Cathepsin S activity controls ischemiainduced neovascularization in mice[J]. Int J Cardiol, 2015, 183: 198.DOI: 10. 1016/j. ijcard. 2015. 01. 058.
[5] Sukhova GK, Shi GP, Simon DI, et al. Expression of the elastolytic cathepsins S and K in human atheroma and regulation of their production in smooth muscle cells[J]. J Clin Invest, 1998, 102(3): 576-583. DOI: 10. 1172/JCI181.
[6] Shi GP, Sukhova GK, Grubb A, et al. Cystatin C deficiency in human atherosclerosis and aortic aneurysms[J]. J Clin Invest, 1999, 104:1191-1197. DOI: 10. 1172/JCI7709.
[7] Cheng XW, Obata K, Kuzuya M, et al. Elastolytic cathepsin induction/activation system exists in myocardium and is upregulated in hypertensive heart failure[J]. Hypertension, 2006, 48(5): 979-987.DOI: 10. 1161/01. HYP. 0000242331. 99369. 2f.
[8] Cheng XW, Huang Z, Kuzuya M, et al. Cysteine protease cathepsins in atherosclerosis-based vascular disease and its complications[J]. Hypertension, 2011, 58(6): 978-986. DOI: 10. 1161/HYPERTENSIONAHA. 111. 180935.
[9] 秦彥文, 唐朝樞. 腹主動脈瘤發病的新禍首——溶酶體組織蛋白酶[J]. 中國循環雜志, 2012, 27(5): 324-326. DOI: 10. 3969/j. issn.1000-3614. 2012. 05. 002.
[10] Sasaki T, Kuzuya M, Nakamura K, et al. AT1 blockade attenuates atherosclerotic plaque destabilization accompanied by the suppression of cathepsin S activity in apoE-deficient mice[J]. Atherosclerosis,2010, 210(2): 430-437. DOI: 10. 1016/j. atherosclerosis. 2009. 12.031.
[11] Wang B, Sun J, Kitamoto S, et al. Cathepsin S controls angiogenesis and tumor growth via matrix-derived angiogenic factors[J]. J Biol Chem, 2006, 281(9): 6020-6029. DOI: 10. 1074/jbc. M509134200.
[12] 董莉, 孫佳音, 康麗娜, 等. 氨氯地平對糖尿病大鼠心肌梗死后骨髓內皮祖細胞動員及血管再生的改善作用[J]. 中國循環雜志,2014, 29(9): 718-722. DOI: 10. 3969/j. issn. 1000-3614. 2014. 09.016.
[13] Kroller-Schon S, Jansen T, Schuler A, et al. Peroxisome proliferatoractivated receptor gamma, activator 1alpha deletion induces angiotensin II-associated vascular dysfunction by increasing mitochondrial oxidative stress and vascular inflammation[J].Arterioscler Thromb Vasc Biol, 2013, 33(8): 1928-1935. DOI: 10.1161/ATVBAHA. 113. 301717.
[14] Wolf D, Tseng N, Seedorf G, et al. Endothelin-1 decreases endothelial PPARgamma signaling and impairs angiogenesis after chronic intrauterine pulmonary hypertension[J]. Am J Physiol Lung Cell Mol Physiol, 2014, 306(4): L361-371. DOI: 10. 1152/ajplung. 00277.2013.
[15] Moller DE. Potential role of TNF-alpha in the pathogenesis of insulin resistance and type 2 diabetes[J]. Trends Endocrinol Metab, 2000,11(6): 212-217. DOI: 10. 1016/S1043-2760(00)00272-1.
[16] Thom R, Rowe GC, Jang CS, et al. Hypoxic induction of vascular endothelial growth factor (VEGF) and angiogenesis in muscle by truncated peroxisome proliferator-activated receptor gamma coactivator (PGC)-1alpha[J]. J Biol Chem, 2014, 289(13): 8810-8817.DOI: 10. 1074/jbc. M114. 554394. DOI: 10. 1074/jbc. M114. 554394.
[17] Cho YR, Lim JH, Kim MY, et al. Therapeutic effects of fenofibrate on diabetic peripheral neuropathy by improving endothelial and neural survival in db/db mice[J]. PLoS One, 2014, 9(1): e83204. DOI: 10.1371/journal. pone. 0083204.

