肝炎、肝硬化、肝癌患者血清干擾素-γ水平的變化及意義
歐陽博慧,謝晴晴,王林春,孫一帆
(1、柳州市中醫醫院檢驗科,廣西 柳州 545001;2、柳州市柳鐵中心醫院檢驗科,廣西 柳州 545007)
人感染乙型肝炎病毒(HBV)后的臨床轉歸差異巨大,如不積極治療,病情將不斷進展,肝臟發生纖維化,最終導致肝硬化和肝功能衰竭,HBV的慢性感染也是原發性肝癌諸多致病因素中最主要的致病因素之一。乙型肝炎的發病與機體的免疫反應有關,細胞因子是一類由單核巨噬細胞、淋巴細胞等分泌的具有調節細胞功能的多肽物質,在機體的免疫反應中與乙肝病毒相互作用,相互影響[1]。干擾素家族是一類具有抗病毒活性的細胞因子。其中干擾素γ(IFN-γ)屬于細胞因子中的一種,是病毒感染機體后,由細胞分泌的具有抗病毒功能的宿主特異性糖蛋白,是一種重要的巨噬細胞激活因子。IFN-γ通過與細胞表面干擾素受體(IFNGR)結合,誘導多種抗病毒蛋白的產生,從而使病毒感染細胞內產生抗病毒作用,使病毒無法進一步損傷宿主細胞[2]。IFN-γ還能通過干擾細胞周期,抑制細胞增殖。其基因多態性可能通過影響IFNγ的表達和分泌改變機體調節的抗病毒和免疫反應,從而影響疾病的發生發展[3]。IFN-γ的這種抗病毒、抗細胞增殖、免疫調節特性,在肝炎、肝硬化、肝癌的發生發展過程中,參與了多種生理病理過程,并在其中發揮了關鍵作用[4]。本研究通過測定血清中的IFN-γ水平在肝炎、肝硬化、肝癌患者中血清學水平差異,為其應用在肝炎、肝硬化、肝癌的早期治療和早期診斷提供依據。
1 資料與方法
1.1一般資料 本研究為病例-對照研究。研究對象來源于2016年6月至10月在柳州市中醫醫院體檢者和住院患者。正常對照組173例。病例組共347例,其中慢性乙型肝炎(CHB)129例、乙肝后肝硬化(LC)63 例、肝癌(HCC)患者 155 例。
1.1.1 對照組納入標準 ⑴無腫瘤或者肝臟、腎臟、內分泌、心腦血管等重大疾病史;⑵血清指標:乙型肝炎表面抗原 (HBsAg)、乙型肝炎 e抗體(HBeAb)和乙型肝炎表面核心抗體(HBcAb)陰性;甲胎蛋白(AFP)正常;血常規和生化指標正常。納入者為體檢中心健康體檢者。
1.1.2 CHB組納入標準 根據《慢性乙型肝炎防治指南》2015更新版擬定的標準[5],本研究中CHB組納入標準為HBsAg和HBV DNA陽性且既往有乙型肝炎病史或HBsAg陽性超過6個月的病人。若發病時間不明,可根據病人癥狀、生化指標、肝組織學檢查及其它臨床和輔助結果進行判斷。
1.1.3 乙肝后LC組納入標準 HBsAg陽性,或HBV DNA陽性,或有明確的乙型肝炎病史。有肝功能異常、有門脈高壓臨床表現或肝硬化的影像學表現,肝穿刺病理結果有假小葉形成者可直接確診為LC。
1.1.4 HCC組納入標準 根據《原發性肝癌診療規范(2017年版)》[6]及2004年版《原發性肝癌的臨床診斷與分期標準》[7]:⑴AFP≥400μg/L,能排除妊娠、生殖系胚胎源性腫瘤、活動性肝病及轉移性肝癌,并能觸及腫大、堅硬及有大結節狀腫塊的肝臟或影像學檢查有肝癌特征的占位性病變者。⑵AFP<400μg/L能排除妊娠、生殖系胚胎源性腫瘤、活動性肝病及轉移性肝癌,并有兩種影像學檢查有肝癌特征的占位性病變或有兩種肝癌標志物(DCP、GGTⅡ、AFU 及 CA19-9等)陽性及一種影像學檢查有肝癌特征的占位性病變者。⑶有肝癌的臨床表現并有肯定的肝外轉移病灶(包括肉眼可見的血性腹水或在其中發現癌細胞)并能排除轉移性肝癌者。本研究遵循倫理學原則,所有研究對象自愿參與,均已知情同意。
1.2 儀器與方法
1.2.1 標本收集 清晨空腹抽取每個研究對象靜脈血3ml裝入無抗凝劑的紅色帽的無菌干燥管內,室溫放置30min后,3000r/min轉離心10min,取血清保存于-80℃冰箱中,用于血清IFN-γ水平檢測。
1.2.2 測定原理 用ELISA方法進行血清中IFN-γ濃度。用純化的抗體包被微孔板,制成固相載體,往包被抗IFN-γ抗體的微孔中依次加入標本或標準品,生物素化的抗IFN-γ抗體、辣根過氧化物酶(HRP)標記的親和素,經過徹底洗滌后用底物顯色。底物在HRP的催化下轉化成藍色,并在酸的作用下轉化成最終的黃色。顏色的深淺和樣本中IFN-γ呈正比。用酶標儀在450nm波長下測定吸光度(OD)值,根據用標準品繪制的標準曲線,計算樣本濃度。
1.2.3 測定步驟 ⑴配制標準品:將標準品用1ml樣本稀釋液溶解,充分混勻即為標準品原液。依次進行倍比稀釋得到其余6個標準品濃度。以樣本稀釋液為空白。⑵將配制好的8個濃度標準品、樣本加入反應板孔中。每孔加 100μl。37℃溫育 2h。棄去液體,甩干,每孔加生物標記抗體工作液100μl,37℃溫育1h。棄去孔內液體,甩干,在洗板機上洗板9次后,每孔加入HRP標記親和素工作液100μl,37℃溫育 1h。 棄去孔內液體,甩干,在洗板機上洗板9次后,每孔加入底物90μl,37℃避光顯色,當肉眼可見標準品有明顯的藍色梯度時,每孔加入終止液50μl,終止反應。反應終止后5min內在酶標儀上,用450nm波長測量各孔的光密度(OD值)。⑶標準曲線繪制和結果計算:在試劑盒廠家網站上下載專業軟件“Curve Expert 1.4”。根據提示制作標準曲線。根據樣本OD值,由標準曲線查出相應濃度。
1.2.4 所用試劑和儀器 使用人IFN-γ酶聯免疫試劑盒(96T/盒,cusabio生物科技有限公司,美國)。使用儀器為美國BioTek公司酶標儀 (型號:ELX800)。批內精密度CV%<8%;批間精密度CV%<10%。試劑盒自帶質控水平一和水平二,操作步驟同上。
1.3 統計學處理 本研究中的數據處理:計量資料如果符合正態分布,采用平均值±標準差表示(x±s),多組比較采用單因素方差分析(One-Way ANO-VA);若不符合正態分布,采用中位數(四分位間距)M(IQR)表示,組間比較用 Kruskal-Wallis檢驗。統計檢驗使用雙側概率檢驗,以P<0.05時認為結果有統計學意義。數據用SPSS 12.0進行數據分析。
2 結果
2.1 各組研究對象人口學資料 本研究中的研究對象一般性資料見表1。經卡方檢驗,四組間男女構成比差異無統計學意義(P=0.758)。經方差分析,四組間年齡差異無統計學意義(P=0.959)。
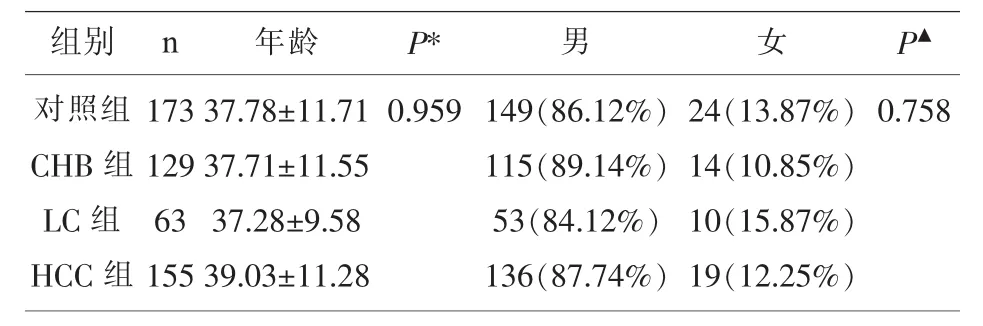
表1 各組研究對象人口學資料
2.2 對照組、CHB組、LC組、HCC組血清中IFN-γ濃度 四組IFN-γ濃度數據以均值±標準差 (x±s)表示,見表2采用單因素方差分析 (One-Way ANOVA)檢驗進行四組樣本比較。四組血清中IFN-γ濃度比較差異有統計學意義 (F=9.606,P<0.001)。兩兩比較結果表明,HCC組和對照組比較差異有統計學意義 (F=37.110,P<0.000),LC 組和對照組比較有統計學意義(F=29.638,P=0.012),其它組間比較差異無統計學意義(P>0.05)。
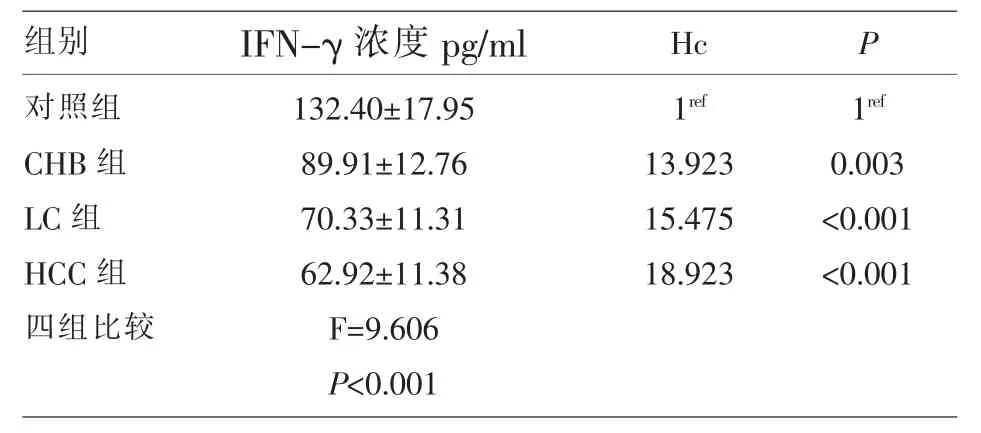
表2 對照組、CHB組、LC組、HCC組血清中IFN-γ濃度
3 討論
雖然目前HCC詳細的發病機制尚未完全明確,但公認的免疫細胞功能異常和細胞因子失衡是HCC發病機制之一。機體免疫系統在HBV感染后被激活,免疫細胞釋放多種細胞因子,進而形成一個復雜的免疫調節網絡。IFN-γ是乙肝相關性HCC發病過程中重要的細胞因子,主要由激活的CD4+、CD8+T細胞和自然殺傷細胞產生,T細胞既可以作為免疫效應細胞直接殺傷靶細胞,又可以作為免疫調節細胞調節免疫應答[8]。IFN-γ是重要的Th1類細胞因子,是Ⅱ型干擾素的唯一成員[9],可以激活并調節CD8+細胞毒T淋巴細胞(cytotoxic CD8+T-lymphocytes,CTL)和肥大細胞。 然而,IFN-γ水平與肝臟疾病之間的關系尚未完全闡明。已有研究發現IFN-γ可以通過清除病毒的衣殼顆粒及其病毒基因組、使病毒RNA失穩等途徑發揮直接抑制HBV復制的作用,在先天性和獲得性宿主免疫反應中發揮著重要作用[10]。我們的結果表明,血清中IFN-γ在研究組中濃度呈不同水平分布,對照組血清中IFN-γ水平明顯高于病例組,HCC組血清中IFN-γ水平最低。因此,IFN-γ血清學水平可能是一個有價值的肝病檢測指標。
我們的結果提示,HCC患者中IFN-γ水平明顯降低。據調查研究統計,初次感染HBV的成人中,90%~95%能夠依靠自身免疫系統清除病毒而表現為自限性感染或無癥狀感染,僅5%~10%的感染者發展為慢性肝炎。因此,IFN-γ主要在病毒感染初期發揮作用。而在長期的炎癥過程中,其水平會受到其它細胞因子,尤其是Th1類細胞因子的影響,如IL4、IL10、轉化因子β能抑制IFN-γ的產生[11],這可能是病例組尤其是HCC組IFN-γ水平低于對照組的原因。此外,IFN-γ能夠抑制病毒增殖,調控細胞凋亡,其水平可能與肝臟疾病的嚴重性相關。如Attallah AM等[12]發現IFN-γ水平與肝纖維化程度、白蛋白、血小板計數、總膽紅素和國際標準化比率(INR)之間存在顯著的關聯,IFN-γ參與了乙肝、肝硬化、肝癌等肝病的發病過程,IFN-γ高水平有利于病毒清除和感染的恢復,而低水平的IFN-γ有利于病毒逃逸,使病毒持續復制導致慢性化感染。研究發現,IFN-γ的表達受基因調控,其血清水平的改變影響HBV清除[3]。另有研究表明,其水平的高低在一定程度上也能夠反映肝細胞損害的嚴重程度,其參與了肝臟炎性損傷過程,與肝炎病情輕重密切相關[1]。目前關于肝炎、肝硬化、肝癌患者血清中IFN-γ水平差異,各項研究結果并不統一。甘雪婷等[13]測定了48例肝硬化、40例原發性肝癌和20例正常對照者血清中的IFN-γ水平,結果表明肝癌組IFN-γ水平低于肝硬化和正常對照組,這與我們的結果相似,但我們的研究表明肝癌組和肝硬化組IFN-γ水平并無明顯區別。陳焰等[14]檢測了30例慢性肝炎和30例肝癌患者的血清標本,發現慢性肝炎組和原發肝癌組IFN-γ水平輕度升高,與對照組比較無顯著性差異。Meng等[15]發現23例肝癌患者IFN-γ水平與正常對照組無明顯區別,但經肝移植后,IFN-γ水平明顯上升。陶鵬輝[16]的研究表明,CHB、LC、PHC三組患者之間血清IFN-γ水平比較無顯著差異,但與健康對照組比,IFN-γ水平明顯增高。標本量不同可能是造成結果不一致,甚至相反的主要原因。
IFN-γ基因多態性會影響到IFN-γ的表達。有研究表明,IFN-γ基因+874位點與IFN-γ基因中的CA重復序列相關,TT基因型中CA重復12次,干擾素產量最高[17]。如Saxena R等[18]的研究結果認為HCC組血清中IFN-γ水平最高,其次為對照組;且多重回歸分析結果表明基因型顯著影響IFN-γ表達。Arababadi MK等[19]的研究結果發現肝炎組血清中IFN-γ水平要高于對照組,且IFN-γ水平與基因型明顯相關,TT基因型的IFN-γ水平明顯要高于在AA基因型中的水平。在我國,IFN-γ+874T/A位點存在基因多態性,在人群中以突變AA基因型為主,占60%以上,其次為TA雜合子,野生型TT基因型所占比例不到10%[20,21],與國外人群相比,存在明顯的差異[18,22]。廣西是一個少數民族聚居的地方,我們以前的研究也表明[23],廣西人群的IFN-γ的TT基因型比例明顯低于其它種族。可見,基因背景不同也可能是造成結果不一致的原因之一,特別是作為IFN-γ高產量的TT基因型所占比例影響較大。
綜上所述,慢性HBV感染是一個由多種免疫細胞和細胞因子參與的復雜過程,各種免疫細胞和細胞因子間相互影響、調節和制約。IFN-γ血清學水平在不同的肝病中呈現不同程度的表達。但應注意到其基因多態性也會對血清學水平產生影響,因此,結合血清學和基因檢測,可能是一個有價值的肝病檢測指標。我們將進一步擴大標本量,并結合甲胎蛋白等檢測指標,對IFN-γ應用于肝病檢測的特異性和靈敏度進行進一步研究。
[1]李彩東,林靜,陳錫蓮,等. 細胞因子 IL-15、IL-16、IFN-γ 及TGF-β在慢性乙型肝炎病毒感染者外周血中的表達及臨床意義的研究[J].國際檢驗醫學雜志,2016,37(1):3-5.
[2]Dicitore A,Caraglia M,Gaudenzi G,et al.Type I interferon-mediated pathway interacts with peroxisome proliferator activated receptor-gamma(PPAR-gamma):At the cross-road of pancreatic cancer cell proliferation[J].Biochim Biophys Acta,2014,1845(1):42-52.
[3]孫向茹.干擾素-γ基因多態性與乙型肝炎病毒感染[J].生命的化學,2014,34(4):567-571.
[4]Sucher R,Kurz K,Margreiter R,et al.Antiviral activity of interferon-gamma involved in impaired immune function in infectious diseases[J].Pteridines,2013,24(3-4):149-164.
[5]王貴強,王福生,成軍,等.慢性乙型肝炎防治指南(2015年更新版)[J].臨床肝膽病雜志,2015,31(12):1941-1960.
[6]中華人民共和國國家衛生和計劃生育委員會.原發性肝癌診療規范(2017年版)[J].臨床肝膽病雜志,2017,33(8):1419-1431.
[7]楊秉輝,夏景林.原發性肝癌的臨床診斷與分期標準[J].中華肝臟病雜志,2001,9(6):324.
[8]莊權權,林志航,蔣燕成,等.慢性乙型肝炎病毒感染患者血清免疫調節因子檢測的臨床意義[J].中華醫院感染學雜志,2016,26(1):1-3.
[9]Augustine JJ,Hricik DE.T-cell immune monitoring by the ELISPOT assay for interferon gamma [J].Clin Chim Acta,2012,413(17-18):1359-1363.
[10]李彩東,楊勇衛,田鵬飛,等.乙型肝炎肝硬化患者外周血IFN-γ、IL-32 和 IL-6 的臨床相關性[J].肝臟,2015,20(9):678-680.
[11]申鴻,周萍,白香妮.支氣管哮喘患兒血清白細胞介素-4、干擾素-γ及免疫球蛋白E水平測定及臨床意義 [J].中國醫藥導報,2012,9(25):109-110+112.
[12]Attallah AM,El-Far M,Zahran F,et al.Interferon-gamma is associated with hepatic dysfunction in fibrosis,cirrhosis,and hepatocellular carcinoma[J].J Immunoassay Immunochem,2016,37(6):597-610.
[13]甘雪婷,白憲光,馮志華,等.肝硬化、肝癌患者血清轉化生長因子β1和干擾素γ的測定及臨床意義 [J].中國現代醫學雜志,2003,(9):92-94+102.
[14]陳焰,周平,田德英.慢性乙型肝炎、原發性肝癌患者IL-12、IFN-γ水平檢測及其臨床意義 [J].實用癌癥雜志,2001,(5):504-506.
[15]Meng XQ,Chen XH,Sahebally Z,et al.Cytokines are early diagnostic biomarkers of graft-versus-host disease in liver recipients[J].Hepatobiliary Pancreat Dis Int,2017,16(1):45-51.
[16]陶鵬輝.乙型肝炎病毒感染者血清HBV DNA與IL-21及IFN-γ水平的相關性[J].實驗與檢驗醫學,2017,35(3):347-350.
[17]Ivansson EL,Juko-Pecirep I,Gyllensten UB.Interaction of immunological genes on chromosome 2q33 and IFNG in susceptibility to cervical cancer[J].Gynecol Oncol,2010,116(3):544-548.
[18]Saxena R,Chawla YK,Verma I,et al.IFN-gamma(+874)and not TNF-alpha (-308)is associated with HBV-HCC risk in India[J].Mol Cell Biochem,2014,385(1-2):297-307.
[19]Arababadi MK,Pourfathollah AA,Jafarzadeh A,et al.Non-association of IL-12+1188 and IFN-gamma+874 polymorphisms with cytokines serum level in occult HBV infected patients[J].Saudi J Gastroenterol,2011,17(1):30-35.
[20]藍艷,唐秀生,武潔,等.廣西壯族及漢族人群干擾素γ基因遺傳多態性的研究[J].北京醫學,2009,31(2):93-96.
[21]張平安,吳健民,李艷.干擾素γ基因內含子1+874位點多態性與乙型肝炎病毒感染關系的研究[J].中華流行病學雜志,2006,(1):41-43.
[22]Maskoen AM,Susanto H,Surialaga S,et al.IFNG Polymorphism(+874 T>A)is not a risk factor for cervical cancer[J].Univ Med,2013,32(1):29-36.
[23]Sun Y,Lu Y,Xie L,et al.Interferon gamma polymorphisms and hepatitis B virus-related liver cirrhosis risk in a Chinese population[J].Cancer Cell Int,2015,15:35.

