ALDH1在膀胱癌組織中的表達及與臨床特征的相關性分析
張鋼,林毅樞#,王強
1北京大學第三醫院海淀院區(北京市海淀醫院)泌尿外科,北京 100080
2解放軍第三〇九醫院泌尿外科,北京 100091
膀胱癌是泌尿系統上皮來源惡性腫瘤中發病率最高的疾病,流行病學研究顯示膀胱癌的發病率可達223/10萬~455/10萬[1]。膀胱癌的發病機制較為復雜,包括遺傳因素、基因突變或分子生物學水平的相關改變等。乙醛脫氫酶1(aldehyde dehydrogenase 1,ALDH1)為過氧化因子家族成員,其能夠通過對膀胱移行上皮細胞的促進增殖及凋亡抑制作用,增加膀胱癌的發生風險,加劇膀胱腺癌或者透明細胞癌等的發生率[2]。已有的相關臨床研究揭示了ALDH1在膀胱癌患者中的異常表達情況,認為高表達ALDH1是促進膀胱癌患者不良預后的重要因素[3-4],但缺乏對于ALDH1與膀胱癌患者臨床病理特征的關系研究。為了進一步揭示ALDH1在促進膀胱癌發病過程中的作用,本研究收集手術后切除的膀胱癌組織標本100例,探討了ALDH1的表達與膀胱癌患者臨床分期、癌細胞分化程度等的關系,現報道如下。
1 資料與方法
1.1 一般資料
回顧性分析2014年12月至2016年8月于北京市海淀醫院進行手術治療的100例膀胱癌患者的臨床資料,收集患者手術后切除的膀胱癌標本100例。納入標準:①膀胱癌的診斷標準參考中華醫學會的標準;②組織標本來源于膀胱癌患者實施手術后的標本;③術前未接受放化療、免疫治療;④臨床資料完整。排除標準:①臨床資料缺失嚴重,無法進行統計學分析;②合并其他部位的腫瘤疾病;③復發性膀胱癌患者。膀胱癌患者中,男67例,女33例;年齡41~82歲,平均(65.1±11.7)歲;臨床分期:Ta期 9例,Tis期 22例,T1期 18例,T2期 25例,T3期20例,T4期6例;病理學分級:Ⅰ級18例、Ⅱ級24例,Ⅲ級58例。選取相應的癌旁正常膀胱組織40例作為對照。
1.2 免疫組化染色方法
采用石蠟切片脫蠟至水,采用離子水進行反復洗滌,加入牛奶液體封閉抗體,封閉時間為5 min,加入ALDH1蛋白抗體(鼠來源,購自美國Abcam公司),37℃孵育2 h,采用磷酸鹽緩溶沖液沖洗3次,滴加熒光染色標記的二抗抗體(購自美國Abcam公司),37℃孵育30 min,加入磷酸鹽緩沖溶液沖洗5 min,連續沖洗3次,采用南京凱基生物制劑公司生產的顯色劑進行顯色,封片,鏡下觀察。
1.3 判定標準
免疫組化結果判定標準:ALDH1蛋白的陽性表達位于細胞漿,染色呈黃色、棕黃色、褐色。①根據細胞的染色強度評分:無色為0分,淡黃色為1分,棕黃色為2分,褐色、黑色為3分;②根據陽性細胞所占百分比評分:無陽性細胞為0分,陽性細胞數目所占比例≤10%為1分,陽性細胞數目所占比例占11%~50%為2分,陽性細胞數目所占比例占51%~75%為3分,陽性細胞數目所占比例﹥75%為4分。兩種積分相乘,總分﹤3分為陰性(-),≥3分為陽性,其中3~5分為弱陽性(+),6~9分為陽性(++),﹥9分為強陽性(+++)。
1.4 統計學方法
采用SPSS 16.0軟件對數據進行統計分析,計量資料以均數±標準差(±s)表示,組間比較采用t檢驗;計數資料以率(%)表示,組間比較采用χ2檢驗。以P﹤0.05為差異有統計學意義。
2 結果
2.1 不同組織中ALDH1蛋白表達情況的比較
膀胱癌組織中ALDH1蛋白的陽性表達率為42.00%,明顯高于癌旁正常膀胱組織的5.00%,差異有統計學意義(χ2=18.150,P﹤0.01)。(表1、圖1)
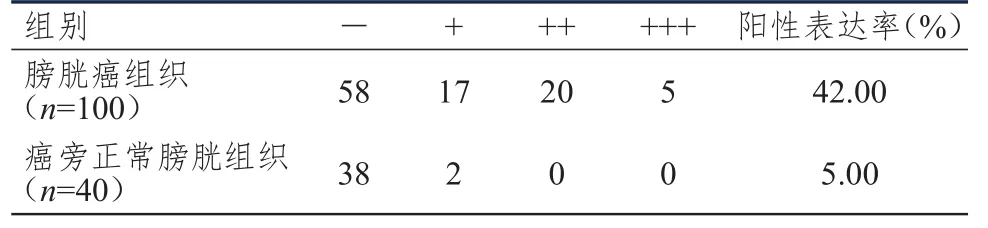
表1 不同組織中ALDH1蛋白的表達情況
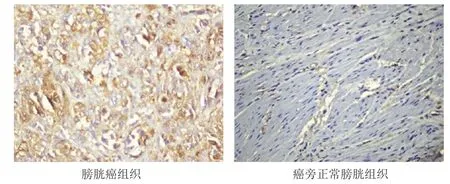
圖1 不同組織中ALDH1蛋白的表達情況(免疫組化染色,×400)
2.2 膀胱癌組織中ALDH1蛋白的陽性表達率與膀胱癌患者臨床病理特征的關系
有脈管浸潤、有神經浸潤、有淋巴結轉移、T2~4期膀胱癌組織中ALDH1蛋白的陽性表達率均高于無脈管浸潤、無神經浸潤、無淋巴結轉移、Ta~1期的膀胱癌組織,差異均有統計學意義(P﹤0.05)。(表2)
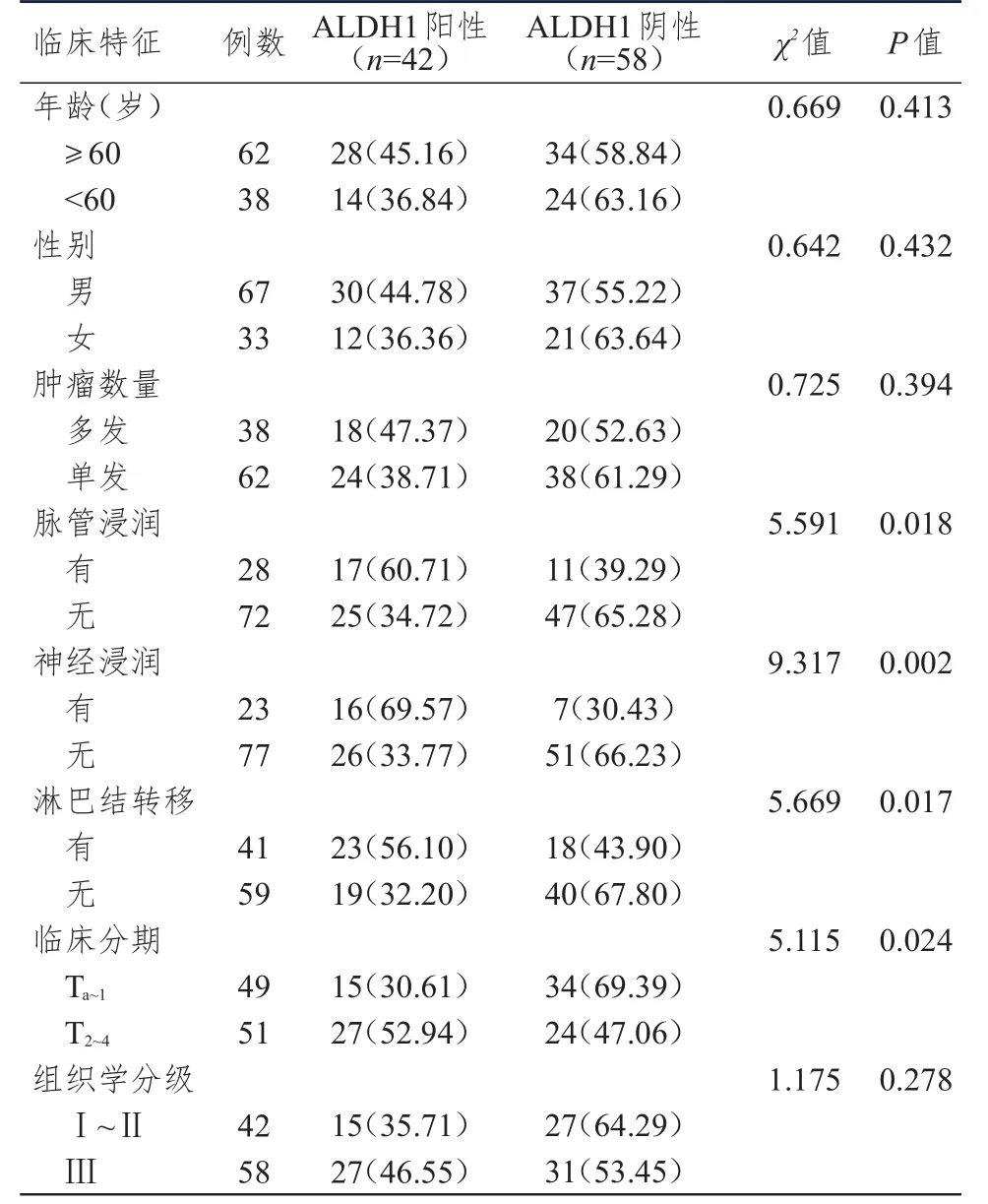
表2 ALDH1蛋白陽性表達率與膀胱癌患者臨床特征的關系[n(%)]
3 討論
目前臨床上膀胱癌的總體治療有效率不足25%[2],包括手術或者聯合放化療等綜合性治療措施的臨床病情緩解率均較低。同時,對于膀胱癌的早期發病缺乏有效的篩查指標,雖然CA125等上皮腫瘤糖蛋白成分能夠在一定程度上提高膀胱癌的診斷率,但其篩查的靈敏度或者特異度等的局限性仍然較為明顯。本次對于分子生物學相關指標的研究,具有下列幾個方面的顯著意義:①能夠為膀胱癌的分子診斷學提供新的研究方向;②能夠為揭示膀胱癌的發病原因提供理論基礎,并為后續臨床藥理學實驗提供治療靶點。
近年來,分子生物學水平的異常被認為是影響惡性腫瘤發生的核心因素,分子水平的表達調控異常增加了癌細胞過度擴增的風險,導致癌細胞的正常分化或者促凋亡過程明顯失常[5-6]。ALDH1是核糖體修飾因子,其對于核糖體羧基末端的修飾作用能夠提高染色體DNA的錯配風險,并抑制基因錯配修復因子cyc活性。ALDH1的高表達提高了癌細胞對于血管內皮或者淋巴管內皮的黏附能力,對于惡性腫瘤的進展具有一定的促進作用[7-8]。同時,ALDH1對于泌尿系統移行上皮細胞的細胞核增殖、細胞周期的調控或者癌細胞的變形能力等的影響,能夠增加膀胱癌病灶組織對于鄰近正常組織的浸潤,促進膀胱癌臨床分期的進展[9-10]。回顧國內外已有的相關研究,部分研究者在探討ALDH1對惡性腫瘤發生的影響時發現,ALDH1能夠促進卵巢癌或者甲狀腺癌等惡性腫瘤的發病,但在膀胱癌中的研究并不充分。
本研究發現,在膀胱癌組織中,ALDH1蛋白的陽性表達率明顯高于癌旁正常膀胱組織,差異有統計學意義(χ2=18.150,P﹤0.01),提示ALDH1蛋白的表達可能與膀胱癌的發生、發展有關,ALDH1蛋白的高表達能夠通過以下幾個方面促進惡性腫瘤的病情進展[11-13]:①ALDH1蛋白的高表達促進了癌細胞細胞周期中G1/S期的比例,導致癌細胞DNA擴增速度的改變;②ALDH1蛋白影響到了癌細胞分化凋亡抑制因子的表達,抑制了早期膀胱移行上皮細胞的分化成熟,導致癌細胞的凋亡減少。Masaoka等[14]研究者探討了小樣本量的中晚期膀胱癌患者的免疫組化資料,發現在膀胱癌病灶組織的中心部分可見明顯的ALDH1蛋白陽性表達率的上升,且患者的遠期生存預后越差,病程越長,ALDH1蛋白的陽性表達率越高。免疫組化染色分析可見,ALDH1蛋白的陽性表達主要定位于膀胱癌細胞核及細胞質內,且癌細胞的分化程度越低,癌細胞的異型性越明顯,ALDH1蛋白的陽性表達率越高,但也發現部分癌細胞中ALDH1蛋白的陽性表達,提示其可能還影響到了癌細胞間信息的傳遞。在探討ALDH1蛋白與膀胱癌患者臨床病理特征的關系過程中發現,在發生了淋巴結轉移的患者中,ALDH1蛋白的陽性表達率較高,這主要考慮與ALDH1蛋白對于淋巴結內皮細胞黏附分子的激活,或者對于分化轉錄調控因子的影響有關。同時,在有脈管浸潤、有神經浸潤或者臨床分期較晚的膀胱癌患者中,ALDH1蛋白的陽性表達率同樣較高,這提示ALDH1對于神經元或者組織間質成分中的引流管等均具有一定的親和力,而其對于臨床分期的影響可能與其對于膀胱鄰近綜上所述,正常組織器官的浸潤有關。
本研究的創新性在于探討了ALDH1蛋白與膀胱癌患者神經浸潤或者脈管浸潤的關系。ALDH1蛋白在膀胱癌組織中呈高表達,且與膀胱癌患者的脈管浸潤、神經浸潤、淋巴結轉移情況、臨床分期有關,其可能在膀胱癌的發生、發展過程中起重要作用。
[1]Mitin T,Shipley WU,Efstathiou JA,et al.Trimodality therapy for bladder conservation in treatment of invasive bladder cancer[J].Curr Urol Rep,2013,14(2):109-115.
[2]曹明麗,王淼,宋豐舉.天津市河西區膀胱癌流行現狀和趨勢分析[J].中華腫瘤防治雜志,2016,23(17):1138-1140;1148.
[3]王卉,李成柏,蔣光亮,等.非肌層浸潤性膀胱癌免疫治療研究進展及機制探討[J].現代泌尿外科雜志,2017,22(5):392-395.
[4]鄒寶嘉,陳明坤,葉云林,等.高危非肌層浸潤性膀胱癌的臨床病理特點分析:10年經驗總結[J].新醫學,2015,46(6):378-382.
[5]馬重,林建水,曾蜀雄,等.膀胱癌無創性早期診斷標志物的研究進展[J].上海醫學,2015,38(4):347-350.
[6]徐賓,張天禹.膀胱癌相關腫瘤標志物的研究進展[J].華夏醫學,2015,28(2):106-110.
[7]許寧,邵明明,金美善,等.腫瘤干細胞標記蛋白ALDH1在浸潤性膀胱癌組織中的表達及其與臨床病理和預后的關系[J].吉林大學學報(醫學版),2014,40(4):828-832.
[8]李慶,王莉,楊樹才,等.腫瘤淋巴管入侵與無淋巴結轉移膀胱癌復發及預后的相關性分析[J].現代生物醫學進展,2015,15(5):854-857.
[9]曹敬毅,王淇超,王乾,等.肌層浸潤性膀胱癌髂內動脈化療的臨床療效[J].江蘇醫藥,2015,41(11):1267-1269.
[10]郭偉宣.膀胱癌40例臨床病理分析[J].中國民族民間醫藥,2015,24(11):95-97.
[11]Huang YC,Yu HS,Chai CY.Aldehyde dehydrogenase induction in arsenic-exposed rat bladder epithelium[J].Exp Toxicol Pathol,2016,68(1):b61-68.
[12]Orywal K,Jelski W,Werel T,et al.The activity of class I,II,III and IV alcohol dehydrogenase isoenzymes and aldehyde dehydrogenase in the sera of bladder cancer patients[J].Acta Biochim Pol,2017,64(1):81-84.
[13]Xu N,Shao MM,Zhang HT,et al.Aldehyde dehydrogenase 1(ALDH1)expression is associated with a poor prognosis of bladder cancer[J].Cancer Epidemiol,2015,39(3):375-381.
[14]Masaoka H,Ito H,Soga N,et al.Aldehyde dehydrogenase 2(ALDH2)and alcohol dehydrogenase 1B(ADH1B)polymorphisms exacerbate bladder cancer risk associated with alcohol drinking:gene-environment interaction[J].Carcinogenesis,2016,37(6):583-588.

