胃癌切除術后食管蠕動情況及胃腸激素水平變化的臨床研究
朱莎,葛昊,徐妍
無錫市第二人民醫院腫瘤科,江蘇 無錫 214000
胃癌是臨床常見的惡性腫瘤之一,發病率僅次于肺癌,發病部位主要集中于胃竇部、胃小彎以及胃前后壁。手術是治療胃癌最有效的手段,尤其對于早期胃癌預后較好,隨著醫療技術水平的不斷提高,胃癌手術的適應證逐漸擴大[1]。研究顯示,除手術創傷外,消化功能紊亂是胃癌手術的主要并發癥,對患者預后有明顯影響[2]。有研究指出,胃癌術后食管動力學指標及胃腸激素水平改變可能與消化功能紊亂有關,但具體機制尚未明確[3]。本研究對24例胃癌患者和25例健康體檢者的食管動力學指標及胃腸激素水平的變化情況進行分析,以期為胃癌術后并發癥的機制研究和防治提供參考依據,現報道如下。
1 對象與方法
1.1 研究對象
選取2016年1月至2017年1月于無錫市第二人民醫院行遠端大部切除術的24例胃癌患者為研究組。納入標準:①經影像學及病理組織學檢查確診為Ⅱ~Ⅲ期;②手術成功且完成6個月以上隨訪;③術后無并發癥,隨訪期間無復發或轉移。排除標準:①合并影響食管功能疾病的患者;②近期接受放化療或使用影響胃腸功能藥物的患者;③依從性較差的患者。另選取同期來本院體檢的25例健康體檢者為對照組。研究組中,男15例,女9例;年齡26~72歲,平均(58.96±8.68)歲;腺癌 21例,印戒細胞癌1例,其他2例;腫瘤直徑為(4.61±1.48)cm;TNM分期:Ⅱ期16例,Ⅲ期8例;2例合并出血梗阻;發病部位:胃竇14例,胃體7例,賁門3例。對照組中,男15例,女10例;年齡25~70歲,平均(58.20±8.33)歲。兩組研究對象的年齡、性別等一般資料比較,差異無統計學意義(P﹥0.05),具有可比性。本研究經過本院倫理委員會審批通過,所有研究對象均對本研究知情并簽署知情同意書。
1.2 方法
1.2.1 食管動力學檢查 檢查前受檢者常規禁食8 h,在充分了解檢查步驟后調整心態和呼吸,使用GAP-36A型36通道HRM高分辨率消化道動力檢測系統(寧波邁達醫療儀器有限公司)檢測食管動力學指標。受檢者取坐位,緩慢將測壓導管經鼻腔插入食管,深度達胃內后開始檢查。受檢者每次吞咽10 ml生理鹽水,每次間隔30 s,共10次,根據吞咽過程中食管體部的蠕動情況,通過HRM系統獲得食管動力學指標[4]。
1.2.2 胃腸激素檢測 檢查前受檢者禁食禁水8 h,抽取受檢者清晨空腹靜脈血5 ml裝入含EDTA抗凝劑的離心管中,在4℃低溫離心機中以3000 r/min離心5 min,獲取血漿并置于-80℃低溫冰箱中保存待檢。分別使用人胃動素檢測試劑盒、人胃促生長素檢測試劑盒和人瘦素檢測試劑盒,采用雙抗體夾心法進行檢測,檢測步驟按照試劑盒說明書進行,試劑盒均購自上海西唐生物科技有限公司。
1.3 觀察指標
觀察研究組患者術前及術后1個月、術后3個月食管動力學指標(食管體部蠕動遠端收縮積分、食管體部蠕動收縮前沿速度、食管下括約肌靜息壓、食管完整松弛壓力)的變化情況以及術前和術后1周、術后3個月胃腸激素(胃動素、胃促生長素、瘦素)水平的變化情況,并與對照組進行比較。
1.4 統計學方法
采用SPSS 19.0軟件對數據進行統計分析。計量資料以均數±標準差(±s)表示,兩組間比較采用t檢驗,多組間比較采用隨機區組設計方差分析,多組間兩兩比較采用q檢驗。計數資料以率(%)表示,組間比較采用χ2檢驗。以P﹤0.05為差異有統計學意義。
2 結果
2.1 食管動力學指標的比較
研究組患者術前食管下括約肌靜息壓低于對照組,差異有統計學意義(P﹤0.05)。研究組患者術前、術后1個月、術后3個月各食管動力學指標進行多組間方差分析,結果顯示,差異均有統計學意義(P﹤0.05)。多組間進行兩兩比較,結果顯示,研究組患者術后1個月食管下括約肌靜息壓低于術前及對照組,差異有統計學意義(P﹤0.05);術后3個月食管體部蠕動遠端收縮積分、食管體部蠕動收縮前沿速度、食管下括約肌靜息壓、食管完整松弛壓力均低于術后1個月、術前及對照組,差異有統計學意義(P﹤0.05)。(表1)
表1 兩組研究對象食管動力學指標的比較(±s)
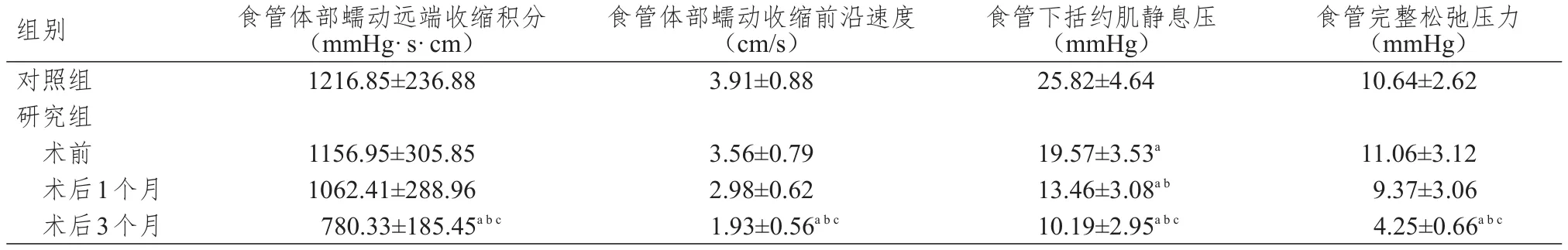
表1 兩組研究對象食管動力學指標的比較(±s)
注:a與對照組比較,P<0.05;b與術前比較,P<0.05;c與術后1個月比較,P<0.05;1 mmHg=0.133 kPa
組別對照組研究組術前術后1個月術后3個月食管體部蠕動遠端收縮積分(mmHg·s·cm)1216.85±236.88食管體部蠕動收縮前沿速度(cm/s)3.91±0.88食管下括約肌靜息壓(mmHg)25.82±4.64食管完整松弛壓力(mmHg)10.64±2.62 1156.95±305.85 1062.41±288.96 780.33±185.45abc 3.56±0.79 2.98±0.62 1.93±0.56abc 19.57±3.53a 13.46±3.08ab 10.19±2.95abc 11.06±3.12 9.37±3.06 4.25±0.66abc
2.2 胃腸激素水平的比較
研究組患者術前胃動素水平高于對照組,胃促生長素水平低于對照組,差異均有統計學意義(P﹤0.05);術前瘦素水平與對照組比較,差異無統計學意義(P﹥0.05)。研究組患者術前、術后1周、術后3個月胃腸激素水平進行多組間方差分析,結果顯示,差異均有統計學意義(P﹤0.05)。多組間進行兩兩比較,結果顯示,研究組患者術后1周和術后3個月胃動素、胃促生長素、瘦素水平均低于術前及對照組,差異有統計學意義(P﹤0.05);術后3個月胃動素水平高于術后1周,胃促生長素水平低于術后1周,差異均有統計學意義(P﹤0.05);術后3個月瘦素水平與術后1周比較,差異無統計學意義(P﹥0.05)。(表2)
3 討論
手術是治療胃癌的主要手段,根據病灶位置及腫瘤分期不同,常用的術式為近端胃大部切除術、遠端胃大部切除術以及全胃切除術。近幾年,臨床研究的熱點逐漸由優化胃癌治療手段以改善預后轉為關注胃癌術后并發癥[5]。消化功能紊亂是胃癌術后常見的并發癥,采用不同手術方式的患者術后消化功能紊亂的嚴重程度不同[6]。有研究指出,胃癌術后消化功能紊亂的主要誘發因素為手術所致的胃腸動力學改變和胃腸激素水平變化,但確切的機制有待于進一步研究[7]。為便于檢測食管動力學指標,本研究選擇了胃癌遠端大部切除術患者作為研究對象,分析患者術后3個月內食管動力學指標及胃腸激素水平的變化情況,以期明確胃腸動力學改變和胃腸激素水平變化對消化功能紊亂的影響。
表2 兩組研究對象胃腸激素水平的比較(pg/ml,±s)
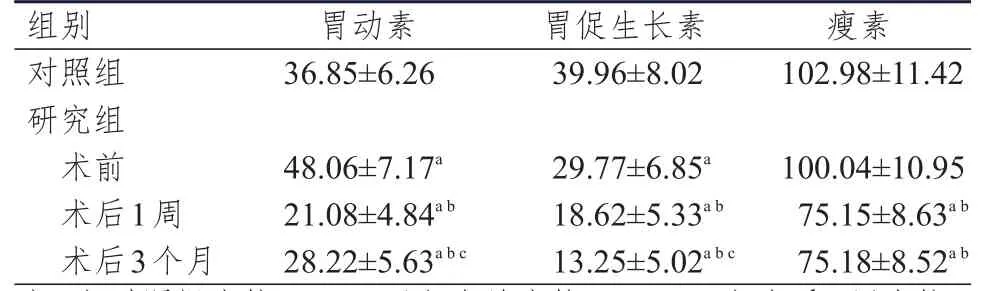
表2 兩組研究對象胃腸激素水平的比較(pg/ml,±s)
注:a與對照組比較,P<0.05;b與術前比較,P<0.05;c與術后1周比較,P<0.05
組別 胃動素 胃促生長素瘦素
本研究使用食管體部蠕動遠端收縮積分、食管體部蠕動收縮前沿速度、食管下括約肌靜息壓、食管完整松弛壓力4個高分辨率食管測壓指標反映食管的蠕動情況,結果顯示,研究組患者術前食管下括約肌靜息壓低于對照組(P﹤0.05),而術前食管體部蠕動遠端收縮積分、食管體部蠕動收縮前沿速度、食管完整松弛壓力與對照組比較,差異無統計學意義(P﹥0.05),提示胃癌患者與健康者的食管蠕動情況無明顯差異,僅存在食管下括約肌靜息壓下降,這可能與胃癌患者胃腸道自身代償有關[8]。術后1個月研究組患者的食管下括約肌靜息壓較術前更低(P﹤0.05),食管體部蠕動遠端收縮積分、食管體部蠕動收縮前沿速度、食管完整松弛壓力較術前雖有下降趨勢但并不明顯,差異無統計學意義(P﹥0.05)。術后3個月研究組患者的食管下括約肌靜息壓、食管體部蠕動遠端收縮積分、食管體部蠕動收縮前沿速度、食管完整松弛壓力進一步降低,與術后1個月比較,差異均有統計學意義(P﹤0.05)。這主要是因為手術破壞了機體神經和激素調節系統,導致食管蠕動功能隨時間延長而逐步下降[9-10]。Alexandre等[11]研究指出,胃癌次全切除術后患者的食管動力學存在蠕動減慢、清空能力下降、食管下括約肌壓力下降等情況,且伴有明顯的食管運動紊亂,與本研究結果相符。
在胃腸激素檢測方面,本研究結果顯示,研究組患者術前胃動素水平高于對照組(P﹤0.05),胃促生長素水平低于對照組(P﹤0.05),可能與胃癌發病過程中胃動力受到抑制,減少了胃促生長素分泌,同時腫瘤生長又刺激胃內分泌細胞大量分泌胃動素有關[12-13]。研究組患者術后1周和術后3個月的胃動素、胃促生長素、瘦素水平均低于術前和對照組(P﹤0.05),主要是由于:①腫瘤切除后對胃動力的抑制作用和對胃內分泌細胞的刺激作用消失;②胃部分切除后內分泌細胞大量缺失,機體無法及時代償,胃腸激素分泌明顯降低[14]。
以往的研究報道顯示,胃癌患者術后胃腸激素水平對胃腸運動有影響[15]。本研究結果顯示,胃癌術后因胃腸結構受到破壞,食管蠕動及胃腸激素水平均受到明顯影響,通過觀察術后3個月食管動力學指標和胃腸激素水平的變化情況,結果發現,兩者存在一定程度的聯系,但具體機制尚未明確。由于技術限制,本研究僅選取了接受胃癌遠端大部切除術的患者,其余術式的影響有待今后開展進一步研究。
綜上所述,胃癌切除術后患者的食管動力學指標和胃腸激素水平均有不同程度的下降,兩者具有一定的關聯。
[1]桑溫昌,李兆德,張軍,等.胃癌行全胃切除術76例臨床療效分析[J].中華普外科手術學雜志(電子版),2012,6(4):361-366.
[2]鄭朝輝,陸俊,黃昌明,等.胃癌根治術后并發癥及其相關因素分析[J].中國實用外科雜志,2013,33(4):317-320.
[3]Barakat O,Cagigas MN,Bozorgui S,et al.Proximal Rouxen-y gastrojejunal anastomosis with pyloric ring resection improves gastric emptying after pancreaticoduodenectomy[J].J Gastrointest Surg,2016,20(5):914-923.
[4]Nicodème F,Pipa-Muniz M,Khanna K,et al.Quantifying esophagogastric junction contractility with a novel HRM topographic metric,the EGJ-Contractile Integral:normative values and preliminary evaluation in PPI non-responders[J].Neurogastroenterol Motil,2014,26(3):353-360.
[5]Wang D,Patel A,Mello M,et al.Esophagogastric junction contractile integral(EGJ-CI)quantifies changes in EGJ barrier function with surgical intervention[J].Neurogastroenterol Motil,2016,28(5):639-646.
[6]趙現光,陳堅.胃癌患者術后胃腸激素與胃腸動力改變的關系[J].上海醫藥,2014,35(7):36-40.
[7]Tomita R,Sakurai K,Fujisaki S.Significance of the lower esophageal sphincter preservation in preventing alkaline reflux esophagitis in patients after total gastrectomy reconstructed by Roux-en-Y for gastric cancer[J].Int Surg,2014,99(2):174-181.
[8]Gor P,Li Y,Munigala S,et al.Interrogation of esophagogastric junction barrier function using the esophagogastric junction contractile integral:an observational cohort study[J].Dis Esophagus,2016,29(7):820-828.
[9]Tomita R,Sakurai K,Fujisaki S,et al.Manometric study in patients with or without preserved lower esophageal sphincter 2 years or more after total gastrectomy reconstructed by Roux-en-Y for gastric cancer[J].Hepatogastroenterology,2012,59(119):2339-2342.
[10]Salvador R,Savarino E,Pesenti E,et al.The impact of heller myotomy on integrated relaxation pressure in esophageal achalasia[J].J Gastrointest Surg,2016,20(1):125-131.
[11]Alexandre L,Broughton T,Loke Y,et al.Meta-analysis:risk of esophageal adenocarcinoma with medications which relax the lower esophageal sphincter[J].Dis Esophagus,2012,25(6):535-544.
[12]Chen CY,Tsai CY.Ghrelin and motilin in the gastrointestinal system[J].Curr Pharm Des,2012,18(31):4755-4765.
[13]Lin TC,Hsiao M.Ghrelin and cancer progression[J].Biochim Biophys Acta,2017,1868(1):51-57.
[14]Terawaki K,Kashiwase Y,Sawada Y,et al.Development of ghrelin resistance in a cancer cachexia rat model using human gastric cancer-derived 85As2 cells and the palliative effects of the Kampo medicine rikkunshito on the model[J].PLoS One,2017,12(3):e0173113.
[15]Nakajima K,Oiso S,Uto T,et al.Triterpenes suppress octanoylated ghrelin production in ghrelin-expressing human gastric carcinoma cells[J].Biomed Res,2016,37(6):343-349.

