胰腺小細胞神經內分泌癌導致梗阻性黃疸1例
董凡,王禹,賈明庫,陳超,廖佳樺
吉林大學第二醫院肝膽胰外科,長春 130000
胰腺小細胞神經內分泌癌屬于胰腺神經內分泌癌(pancreatic neuroendocrine carcinoma,pNEC),與胰腺大細胞神經內分泌癌統稱為胰腺低分化神經內分泌癌[1]。pNEC在所有胰腺惡性腫瘤中所占比例不足5%[2],胰腺小細胞神經內分泌癌所占比例不足1%[3],非常罕見,且因其惡性程度高,基本不具有內分泌功能,特異性臨床特征不明顯,很難與胰腺導管癌相鑒別,極易誤診。本文報道1例胰腺小細胞神經內分泌癌致梗阻性黃疸患者。
1 病歷資料
1.1 一般資料
患者男,49歲,間斷性右上腹痛15 d,以右上腹痛為著,伴腰背部放散痛,多于飲食后加重,腹痛3 d后出現皮膚及鞏膜黃染,伴惡心,無嘔吐,近半年體重下降5 kg。無其他腫瘤病史。查體:鞏膜及全身皮膚黃染,腹部未觸及腫塊,右上腹壓痛(+),余查體未見明顯異常。
1.2 輔助檢查
1.2.1 腹部增強CT 胰頭形態不規整,其內密度欠均勻,可見小圓形低密度區,增強掃描呈不均勻輕度強化(圖1A~圖1C),胰管未見擴張;腹腔內、腹膜后見多發結節狀軟組織影(約43 HU),部分似見融合,較大者為43 mm×48 mm,增強掃描未見明顯強化;增強掃描期可見門靜脈充盈缺損(圖1D);腹腔內見液體密度影;上游肝內外膽管明顯擴張,膽囊增大。診斷提示:胰頭惡性占位性病變,伴腹腔內腹膜后淋巴結腫大,繼發性膽道系統梗阻,門靜脈癌栓形成。
1.2.2 血清學檢查 總膽紅素240 μmol/L,直接膽紅素190.20 μmol/L,間接膽紅素50.6 μmol/L,谷草轉氨酶117 U/L,谷丙轉氨酶163 U/L,堿性磷酸酶415 U/L,癌胚抗原(CEA)3.28 ng/ml,甲胎蛋白3.91 ng/ml,糖鏈抗原 19-9 112.6 U/ml。
1.3 治療及隨訪
結合相關輔助檢查,考慮為胰頭惡性腫瘤伴周圍淋巴結腫大,不排除淋巴瘤可能性,經討論可行開腹探查術,術中探查:腹腔內臟器黃染,胰頭占位與周圍組織分界不清,胰頭周圍、腹膜后淋巴結融合成團、質地硬,活動度差,無法分離,取十二指腸旁淋巴結1枚送快速病理回報為小圓細胞惡性腫瘤。術中決定行“膽囊切除、膽腸吻合、胃腸吻合術”。術后病理:小細胞神經內分泌癌(圖2)。免疫組化結果 :CK(AE1/AE3)(-)、Vimentin(-)、CgA(+)、Syn(弱+)、CD56(+)、NSE(-)、CD99(-)、Ki-67(陽性率70%)、FLI-1(-)。
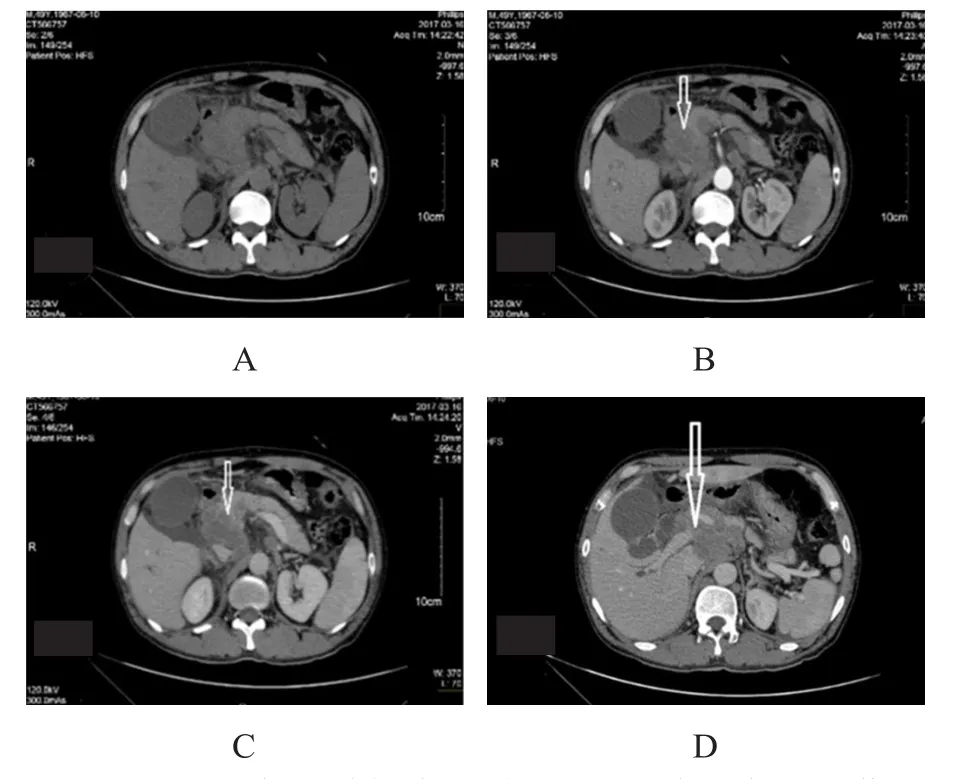
圖1 患者腹部增強CT
患者術后恢復順利,病情穩定后經會診,可行綜合化療,后轉入腫瘤血液科行依托泊苷+卡鉑(EP)化療方案(依托泊苷100 mg/m2,連續靜脈滴注5 d;卡鉑80 mg/m2,化療第2日靜脈滴注,連續滴注3 d)治療,1個月后出院,定期隨訪,患者于出院后6個月死亡。
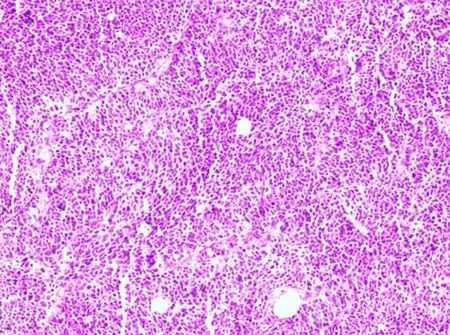
圖2 術后病理檢查結果(HE染色,×200)
2 討論
神經內分泌腫瘤是一組起源于肽能神經元和神經內分泌細胞的異質性腫瘤,pNEC被認為起源于神經內分泌系統的胺前體攝取及脫羧細胞(amine precursor uptake and decarboxylation cell,APUD),在胰腺組織中,起源于全能干細胞的APUD細胞則主要散布于胰腺導管與腺泡上皮之間[4]。臨床中pNEC在所有神經內分泌腫瘤(neuroendocrine neoplasm,NEN)中的發病率不足15%,相關文獻研究表明pNEC好發于中年以上患者[5]。根據美國腫瘤學年鑒統計,美國pNEC的發病率約為22/100萬[4]。目前我國對該疾病在國內發病率尚無詳細統計,僅見極少量病例報道。
pNEC根據是否伴隨相應的內分泌癥狀可分為功能性和無功能性兩類[6]。大多數胰腺小細胞神經內分泌癌為無功能性,但也有研究認為多數具有分泌功能,能分泌有生物學活性的肽類和胺類,與類癌綜合征或其他功能性癥狀有關,完全不分泌激素的腫瘤較少見,只是大部分腫瘤分泌的激素不足,難以表現出特異性臨床癥狀[7]。本病例即為無功能性低分化癌,惡性程度高,主要的臨床表現為腹痛、黃疸、惡液質等,多期增強CT(圖1)等影像學表現與胰腺導管癌難以鑒別,臨床診斷難度大。
目前對于胰腺小細胞神經內分泌癌尚無明確報道的敏感腫瘤標志物,血清CA19-9、CEA等無特異性診斷價值,血清NES、CgA可能是有效的特異性指標[8]。病理診斷是診斷胰腺小細胞神經內分泌癌的金標準,HE染色可見腫瘤為均一小圓細胞或燕麥樣細胞,核分裂象多見,細胞體積小,細胞質少[9](圖2),免疫組化染色結果中NSE、Syn、CgA等可鑒別腫瘤類別,一般認為在NES、Syn、CgA中,至少兩項結果呈陽性才可診斷為神經內分泌癌,但對于pNEC患者,尤其是分化程度差的小細胞癌類,CgA、Syn可能呈弱表達[10]。免疫組化中Ki-67陽性指數用于神經內分泌腫瘤分級,通常與每高倍鏡下核分裂象數結合使用,還可作為高分化腫瘤患者治療的參考標準[8]。對于神經內分泌癌患者進行化療的研究報道中表明,Ki-67陽性表達率低于55%的患者對鉑類化療藥物的反應敏感度較差,但是生存時間較長[5]。
胰腺小細胞神經內分泌癌患者就診時腫瘤多已侵犯周圍組織器官或發生遠處轉移,目前沒有普遍公認的有效治療方案,手術切除是相對有效的治療方法之一,胰十二指腸切除術多用于周圍組織侵犯不嚴重、無遠處器官轉移且可完全切除腫物的病例[11]。對于周圍組織侵犯嚴重或已有明確遠處轉移者,應行多學科綜合治療,其中化療和生物治療被認為是較為有效的治療手段,化療方法多借鑒胃腸道神經內分泌腫瘤,國外一直倡導全身治療,卻未能找到安全有效的藥物[12]。該腫瘤侵襲性高,易發生轉移,患者預后差,由于病例稀少,預后影響因素目前尚無定論[5]。
[1]Rampurwala MM,Kumar A,Kannan S,et al.Non-functioning pancreatic neuroendoerine tumors——a case report and review of literature[J].J Gastrointest Cancer,2011,42(4):257-262.
[2]Lee HS,Chen M,Kim JH,et al.Analysis of 320 gastreenteropancreatic neureendocrine tumors identifies TS expression as independent biomarker for survival[J].Int J Cancer,2014,135(1):128-137.
[3]Ronald A,Ricardo V.Pathology and genetics of tumours of endocrine organs[M].Lyon:IARC Press,2004,8:230.
[4]Halfdanarson TR,Rabe KG,Rubin J,et al.Pancreatic neuroendocrine tumors(PNETs):incidence,prognosis and recent trend toward improved survival[J].Ann Oncol,2008,19(10):1727-1733.
[5]辛寶寶,樓文暉,李劍昂,等.胰腺神經內分泌癌的臨床病理特點和預后因素分析[J].中華普通外科雜志,2015,30(5):352-356.
[6]張巍,程捷瑤,阮戈沖,等.胰腺神經內分泌腫瘤肝轉移合并異位ACTH綜合征1例報道[J].胃腸病學和肝病學雜志,2015,24(12):1450-1452.
[7]金玲.分析胃腸胰神經內分泌腫瘤的臨床特點[J].世界最新醫學信息文摘,2015,15(2):79.
[8]鄭念野,許靜涌,韋軍民.胰腺小細胞癌伴肺占位一例及文獻回顧[J].中華內分泌外科雜志,2014,8(6):521-524.
[9]姜東強,王瑩雪,趙艷秋.胰腺小細胞癌1例[J].中國實驗診斷學,2012,16(5):938-939.
[10]中國胃腸胰神經內分泌腫瘤病理專家組.中國胃腸胰神經內分泌腫瘤病理學診斷共識[J].中華病理學雜志,2011,40(4):257-262.
[11]Ehehalt F,Saeger HD,Schmidt CM,et al.Neuroendocrine tumors of the pancreas[J].Oncologist,2009,14(5):456-467.
[12]Lewis RB,Lattin GE,Paal E.Pancreatic endocrine tumors:radiologic-clinicopathologic correlation[J].Radiographics,2010,30(6):1445-1464.

