TMEPAI蛋白表達對溶酶體穩定性的影響
羅深恒,白喜龍,景 磊,李玉銀,刁愛坡
(天津科技大學生物工程學院,天津 300457)
溶酶體于1955年被發現,是一個由單層膜圍繞、內含多種酸性水解酶類的囊泡狀細胞器[1-2].溶酶體的主要功能是消化作用,同時還具有降解表面受體、失活病原微生物、修復細胞膜等功能[3].近年來研究表明,溶酶體調控著細胞內的多種死亡信號[3-4].當它受到一些外界因子,如腫瘤壞死因子[5-6]、Fas[7]、p53[8]、微管穩定劑[9]、氧化應激[7,10]和星形孢菌素[11]刺激時,溶酶體膜發生通透化,其內部的組織蛋白酶從溶酶體腔釋放到細胞質.一旦這些組織蛋白酶被釋放到細胞質中,特別是半胱氨酸組織蛋白酶B和L以及天冬氨酰蛋白酶 D,可誘發線粒體外膜通透化,繼而引發半胱天冬蛋白酶或細胞凋亡誘導因子介導的凋亡[11-13],或者調節半胱天冬蛋白酶或細胞凋亡誘導因子介導的細胞程序性死亡[6,14].另外,由于不同因素引起的溶酶體膜穩定性下降可導致與溶酶體相關疾病的發生,如矽肺、類風濕性關節炎等[15].
目前已被鑒定的溶酶體相關蛋白包括溶酶體相關膜蛋白(LAMP1、LAMP2)、溶酶體內在蛋白(LIMP2)以及溶酶體膜糖蛋白(LGP85).這些蛋白都高度糖基化,能保護溶酶體膜不被其內部的水解酶降解[16-18],防止溶酶體通透化,從而維持溶酶體穩定性.
前列腺跨膜蛋白(transmembrane prostate androgen-induced protein,TMEPAI)是 N-端含有一個跨膜區(TMD)的Ⅰ型跨膜蛋白,由287個氨基酸組成. 編碼TMEPAI的基因最早于2000年由Xu等[19]在前列腺癌細胞中通過基因表達系列分析受雄激素調控的基因時發現的,TMEPAI基因定位于染色體 20q13,TMEPAI在眾多癌細胞中高表達,包括乳腺癌[20-21]、肺癌[22]、骨癌[23]、卵巢癌[24]、前列腺癌[25]、結腸癌、腎癌及胃癌細胞[26-28].TMEPAI在癌細胞中的表達受部分生長因子(EGF和 TGF-β)調控,如在肺癌細胞中,TMEPAI的持續高表達需要 TGF-β的刺激,EGF能夠協同 TGF-β共同調節誘導 TMEPAI的表達[29].本實驗室近期研究發現 TMEPAI蛋白在細胞內定位于溶酶體和晚期內吞體,并能夠通過促進 TGF-β受體(TβR)的溶酶體降解負調控 TGF-β信號[22].
鑒于 TMEPAI是溶酶體膜相關蛋白并且在癌細胞中高表達,那么其功能是否可以增加溶酶體的穩定性,從而增強癌細胞的抗凋亡能力.基于此猜想,本研究擬構建穩定表達 TMEPAI細胞株,通過 MTT法、流式細胞技術和免疫熒光技術研究細胞內TMEPAI蛋白表達對溶酶體穩定性的影響,為探索TMEPAI在腫瘤細胞發生中的作用提供理論依據.
1 材料與方法
1.1 材料
1.1.1 菌種、細胞及質粒
大腸桿菌(E.coli)TOP10、肺癌細胞 A549及質粒pEF-IRES-puro 均為本實驗室保存.
1.1.2 主要試劑
Taq DNA 聚合酶、T4 DNA連接酶、限制性內切酶、DAN marker、蛋白 預染 marker,Fermentas 公司;質粒小提試劑盒、DNA純化回收試劑盒、膠回收試劑盒,上海生工生物工程有限公司;LipofectamineTM2000、Alexa Fluor?555 goat anti-rabbit IgG、Alexa Fluor?488 donkey anti-mouse IgG、Alexa Fluor?680 goat anti-rabbit IgG,Invitrogen公司;細胞完全培養基F-12K、胰酶、胎牛血清、DPBS,GIBIO公司;Flag抗體、嘌呤霉素(puromycin)、吖啶橙(acridine orange,AO)、DNA 染料(hoechst 33342),Sigma 公司;TMEPAI抗體為本實驗室純化所得;LAMP2抗體,Abcam公司;Rab7抗體,Santa Cruz 公司;β-actin抗體,天津三箭生物技術有限公司;引物合成和基因測序由北京華大基因公司完成.
1.2 方法
1.2.1 pEF-IRES-TMEPAI-Flag重組載體的構建與鑒定
根據目的基因 TMEPAI的核酸序列和表達載體pEF-IRES-puro 的多克隆位點,設計擴增目的基因的引物,其中上、下游引物 P1、P2分別添加 AflⅡ和XbaⅠ的酶切位點(下劃線標示).P1∶5'-CGCGCTT AAG ATGCACCGCTTGATGGG-3';P2∶5'-CTGTCT AGACTACTTGTCGTCATCGTCTTTGTAGTCGCTC GAGAGAGGGTGTCCTTTCTGTTTATCC-3'.以實驗室保存的重組質粒 pEGFP-N3-TMEPAI為模板進行PCR擴增得到 TMEPAI基因片段.真核表達載體pEF-IRES-puro以及 TMEPAI基因純化產物經 AflⅡ和XbaⅠ雙酶切后純化回收.酶切產物經T4,DNA連接酶連接并轉化大腸桿菌 TOP10,挑取單克隆菌落進行培養并提取質粒后,經AflⅡ和XbaⅠ酶切及PCR鑒定為陽性的重組質粒,進一步測序鑒定.
1.2.2 穩轉細胞系的建立
最適嘌呤霉素篩選濃度的確定:在 6孔板中接種適量A549細胞,37,℃、5%,CO2條件下培養細胞生長至 80%~90%,,更換含有不同濃度嘌呤霉素(0~2,μg/mL)的培養基繼續培養.每天鏡下觀察,隔天更換含有嘌呤霉素新鮮培養液.培養3~5,d后,導致細胞全部死亡的嘌呤霉素最低濃度為最低致死濃度,即最適嘌呤霉素篩選濃度(一般以4,d完全致死為準).
穩定細胞系的建立:在 100,mm 培養皿中接種適量細胞,37,℃、5%,CO2條件下培養細胞生長至70%~80%,時,利用LipofectamineTM2000將重組質粒轉染A549細胞,24,h后更換含有最適嘌呤霉素篩選濃度的新鮮培養液.每天更換含有篩選濃度嘌呤霉素的新鮮培養液進行培養.待單克隆長至肉眼可見時,將單克隆挑起并轉移至新的培養皿繼續培養,收集細胞,免疫印跡實驗(Western blot)檢測穩定細胞系是否建立成功.
1.2.3 免疫印跡實驗檢測TMEPAI蛋白的表達
收集對數生長期的單克隆細胞,加入適量 RIPA裂解緩沖液(50,mmol/L,Tris-HCl(pH,7.4),150,mmol/L NaCl,1%,Triton X-100)(含蛋白酶抑制劑)在冰上裂解 30,min,離心收集上清加入 SDS上樣緩沖液,經12%,SDS-PAGE分離后轉至 PVDF膜上,5%,的脫脂奶粉室溫封閉 1,h,于 4,℃下進行一抗(TMEPAI 1∶500、β-actin 1∶2,000)孵育過夜,PBST洗膜后再與二抗孵育2,h后,PVDF膜在Odyssey紅外激光成像系統下掃描成像.
1.2.4 免疫熒光法檢測TMEPAI在細胞中定位
將適量細胞接種于已預先放置無菌細胞爬片的30,mm 培養皿中,待細胞生長至約 70%,,取出細胞爬片用預冷的甲醇-20,℃固定 5,min,DPBS洗滌 1次后一抗(Flag 1∶100、LAMP2 1∶200、Rab7 1∶100)室溫孵育 3,h,DPBS洗滌 3次后二抗(Alexa Fluor?555,goat anti-rabbit IgG 1 ∶ 200 、Alexa Fluor?488 donkey anti-mouse IgG 1∶200、hoechst 33342 10,μg/mL)室溫孵育 30,min,共聚焦熒光顯微鏡下觀察拍照.
1.2.5 MTT法檢測細胞增殖
實驗設置實驗組與對照組,每組設 6個復孔.96孔板每孔接種 5,000個細胞.待細胞貼壁后,分別加入 0、1、2、4、8、16、32、64、128,μmol/L 氯喹.處理48,h后,每孔加入20,μL MTT溶液(5,mg/mL),繼續培養 4,h后,小心吸去孔內培養液.每孔加入 200,μL二甲基亞砜(DMSO),置搖床上低速振蕩 10,min,使結晶物充分溶解,酶標儀測定490,nm處吸光度.
1.2.6 吖啶橙(AO)染色分析過表達TMEPAI對溶酶體穩定性的影響
熒光顯微鏡分析:將適量對數期的細胞接種于放有細胞爬片的30,mm培養皿中,培養24,h后,DPBS洗滌2次,加入含有2,μmol/L AO的DPBS,于37,℃孵育 15,min,DPBS洗滌 3次,細胞爬片在熒光顯微鏡下觀察拍照.
流式細胞術分析:將適量細胞接種于 60,mm培養皿中培養 24,h后,胰酶消化細胞,收集 1×106個細胞于DPBS中,加入2,μmol/L AO,于37,℃避光孵育15,min.流式細胞儀檢測紅色熒光強度.
1.3 統計學分析
應用 SPSS軟件進行數據的整理分析,采用 t檢驗進行組間比較,檢驗結果P<0.05表示差異有統計學意義,*、**和***分別表示與對照組比較 P<0.05、P<0.01和P<0.001.
2 結果與分析
2.1 重組質粒pEF-IRES-TMEPAI-Flag的構建
以本實驗室構建的 pEGFP-N3-TMEPAI重組載體為模版,利用引物 P1、P2,定向擴增目的片段(圖1(a)).PCR產物經雙酶切純化后連接,轉化 E.coli TOP10宿主菌.挑取 Amp+抗性陽性克隆菌培養,提取質粒后進行 PCR檢測(圖 1(b)),在 913,bp處有明顯條帶,與 TMEPAI目的基因大小一致.進一步將重組質粒進行雙酶切鑒定(圖 1(c)),結果大小分別為載體片段 5,700,bp和目的片段 913,bp.基因測序結果顯示,目的基因與 GenBank中 TMEPAI基因序列(GenBank No.NM_020182.4)完全一致.以上結果表明,重組質粒pEF-IRES-TMEPAI-Flag構建成功.
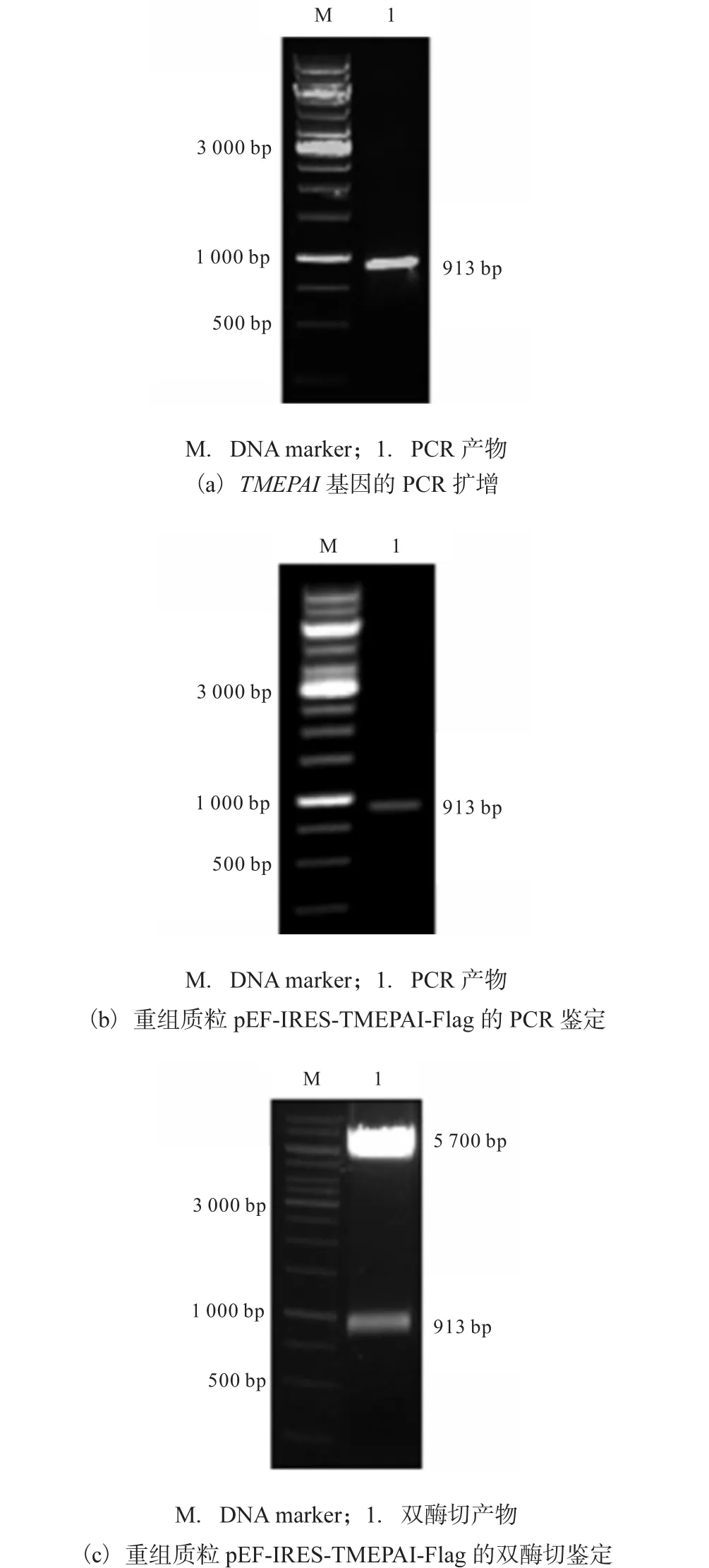
圖1 重組質粒pEF-IRES-TMEPAI-Flag的構建和鑒定Fig. 1 Construction and identification of the recombinant plasmid pEF-IRES-TMEPAI-Flag
2.2 穩定表達TMEPAI細胞株的構建及鑒定
穩定細胞株構建實驗篩選獲得 2個空載體對照的細胞株,分別為 pEF-IRES-puroⅠ、pEF-IRES-puroⅡ;3個穩定表達 TMEPAI-Flag的細胞株,分別為TMEPAI-FlagⅠ、TMEPAI-FlagⅡ、TMEPAI-FlagⅢ.采用Western blot檢測穩定株TMEPAI蛋白表達,結果如圖 2所示,其中 A549為正常 A549細胞;pEFIRES-puroⅠ/Ⅱ為空載體對照組;TMEPAI-FlagⅠ/Ⅱ/Ⅲ為穩定表達 TMEPAI-Flag的 A549細胞株.正常的 A549細胞與空載體對照組的 A549細胞中TMEPAI的表達量較低,而穩定表達 TMEPAI-Flag的A549細胞中TMEPAI蛋白水平顯著提高.由此表明,穩定表達TMEPAI的A549細胞株構建成功,其中 TMEPAI-FlagⅢ表達量最高,因此選用該穩定株進行后續實驗.

圖2 Western blot 檢測穩定細胞株TMEPAI表達Fig. 2 Detection of the expression of TMEPAI in stable cell lines by Western blot
采用免疫熒光法檢測構建的 A549穩定細胞株中TMEPAI的定位情況.如圖3所示,在穩定細胞株中,TMEPAI與 LAMP2(溶酶體 marker)有明顯共定位,與 Rab7(晚期內吞體 marker)有部分共定位,由此進一步證明,成功構建穩定表達 TMEPAI-Flag的A549細胞株.
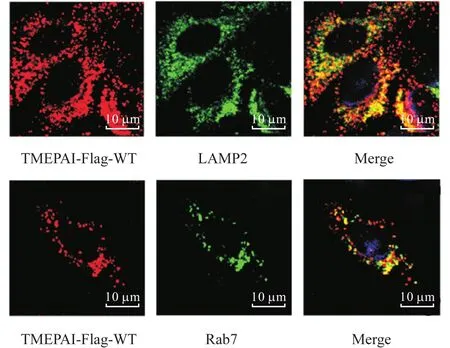
圖3 穩定細胞株中TMEPAI的定位Fig. 3 TMEPAI localization in stable cell lines
2.3 TMEPAI過表達對溶酶體穩定性的影響
氯喹是一種溶酶體抑制劑,通過升高溶酶體腔內pH使溶酶體膨大,并引起溶酶體通透化,從而抑制溶酶體功能[30].利用不同濃度的氯喹處理穩定細胞株,觀察TMEPAI表達對溶酶體穩定性的影響,結果如圖4所示.隨著氯喹處理細胞的濃度增加,48,h后正常 A549細胞的存活率逐漸降低,32,μmol/L時細胞基本完全死亡.而穩定細胞株在氯喹處理濃度32,μmol/L 時仍有細胞存活.由此說明,過表達TMEPAI可以增加溶酶體對氯喹的耐受性,使溶酶體穩定性增強.
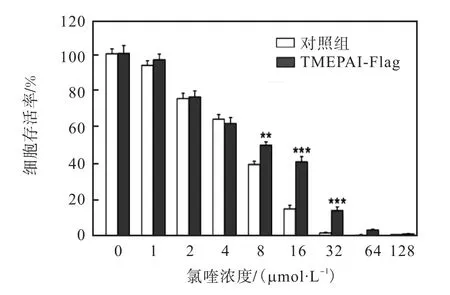
圖4 MTT檢測過表達TMEPAI對溶酶體穩定性的影響Fig. 4 Effect of TMEPAI expression on the lysosome stability by MTT assay
2.4 吖啶橙染色分析過表達 TMEPAI對溶酶體穩定性的影響
吖啶橙(AO)是一種溶酶體異質性熒光染料,可透過細胞膜進入溶酶體內,細胞內不同區域的 pH影響AO分布的濃度,即pH低時AO濃度高,而pH高時AO濃度低.當用紫外光激發時,AO在高濃度(當其存在于溶酶體內)下顯示橘紅色熒光,而在低濃度(當其存在于細胞質和細胞核中)下顯示綠色熒光[31].因此,AO染色的細胞內橘紅色熒光強度越強,說明溶酶體越穩定,分別通過熒光顯微鏡以及流式細胞技術分析細胞內紅色熒光的強度.
利用熒光顯微鏡觀察 AO在穩定表達 TMEPAI細胞株內的分布情況,結果如圖 5所示.與對照組相比,穩定細胞株(TMEPA1-FlagⅢ)的紅色熒光較強,說明過表達 TMEPAI后,溶酶體的穩定性增強,即TMEPAI增加了溶酶體的穩定性.
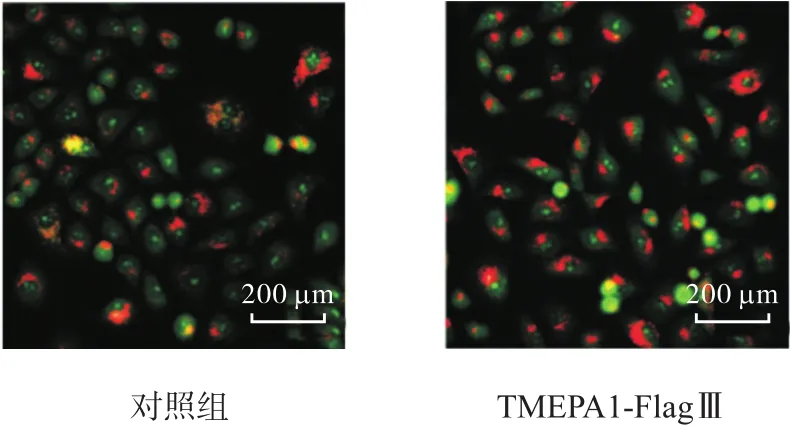
圖5 AO染色檢測TMEPAI表達對溶酶體穩定性的影響Fig. 5 Effect of TMEPAI expression on the lysosome stability by AO staining
采用流式細胞技術對AO染色進行定量分析,結果如圖 6所示.對照組高于紅色熒光閾值(溶酶體陽性)的細胞數為 73.8%,,實驗組(TMEPA1-FlagⅢ)的細胞數為 92.7%,較對照組增加了 18.9%.這說明過表達TMEPAI后,細胞內的紅色熒光強度增強,溶酶體的穩定性增強.
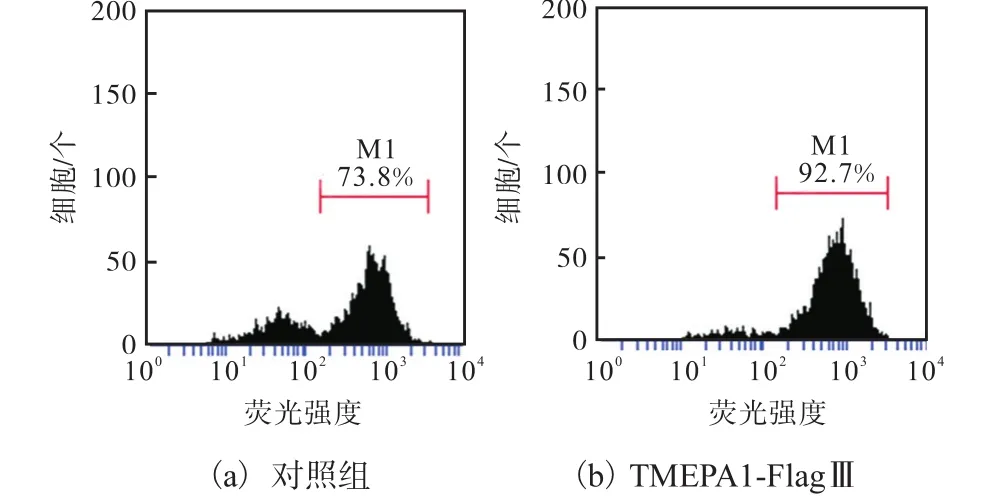
圖6 流式細胞技術分析過表達 TMEPAI對溶酶體穩定性的影響Fig. 6 Impact of TMEPAI expression on the lysosome stability by flow cytometry assay
3 討 論
溶酶體結構和功能的完整性需要溶酶體膜蛋白以及腔內水解酶的共同調節,溶酶體膜蛋白主要負責調節內腔 pH、胞質蛋白的膜融合以及降解產物的外排.越來越多的研究表明,溶酶體蛋白通過溶酶體調控一系列細胞生理過程,如溶酶體跨膜蛋白LAPTM4B能夠維持溶酶體膜腔 pH,增強溶酶體的穩定性[30];轉錄因子 EB(transcription factor EB,TFEB)能夠酸化溶酶體內腔,促進水解酶的運輸以及自噬體與溶酶體的融合[32-33].TMEPAI是溶酶體定位蛋白質[22],本實驗室前期研究發現 TMEPAI能夠增強溶酶體的穩定性,抵抗藥物刺激(etoposide)引起的溶酶體通透化(lysosomal membrane permeabilization,LMP)[34].溶酶體的通透化會使腔內H+以及酸性水解酶釋放到胞質中,導致細胞內pH失衡以及細胞器損傷.通過 konckdown實驗證明了干擾 TMEPAI表達能降低溶酶體膜的穩定性,與本文的結果一致,證明了TMEPAI表達能增加溶酶體膜的穩定性.
對于活細胞來說,溶酶體內高濃度的水解酶為其發揮功能起到重要作用,但它的不穩定可能會給自身帶來潛在的危害.一旦溶酶體膜被破壞,將導致其內部水解酶釋放至細胞質,造成溶酶體通透化,引起無法控制的細胞內容物降解.同時,大量的溶酶體膜破裂可引起細胞內酸化,從而導致細胞死亡.此外,溶酶體通透化可能與活性氧(ROS)有關,溶酶體去穩定化已被認為是由氧化應激引起的細胞損傷所造成的[35],并且 ROS可誘導溶酶體泄漏[36].本文通過構建穩定表達 TMEPAI細胞株,研究發現 TMEPAI表達能增加溶酶體膜的穩定性.Hu等[37]研究表明TMEPAI與ROS有關,由此推測TMEPAI可能通過抑制 ROS增加溶酶體穩定性.Kirkegaard等[38]發現熱休克蛋白 70(Hsp70)通過調節鞘磷脂代謝增加溶酶體膜的穩定性.TMEPAI表達增加溶酶體膜的穩定性可能增強了癌細胞的抗凋亡能力,實驗也表明過表達 TMEPAI可以抵抗氯喹對肺癌細胞 A549殺傷作用.因此,TMEPAI可能成為抗癌的潛在藥物靶點.
4 結 語
本研究成功構建了 pEF-IRES-TMEPAI-Flag表達載體,并建立了穩定表達TMEPAI的細胞株,且證實了 TMEPAI蛋白在溶酶體表達.同時,發現TMEPAI表達可以增強溶酶體的穩定性.
參考文獻:
[1] de Duve C. The lysosome turns fifty[J]. Nature Cell Biology,2005,7(9):847-849.
[2] Mullins C,Bonifacino J S. The molecular machinery for lysosome biogenesis[J]. Bioessays,2001,23(4):333-343.
[3] Jaattela M,Tschopp J. Caspase-independent cell death in T lymphocytes[J]. Nature Immunology,2003,4(5):416-423.
[4] Ferri K F,Kroemer G. Organelle-specific initiation of cell death pathways[J]. Nature Cell Biology,2001,3(11):255-263.
[5] Guicciardi M E,Deussing J,Miyoshi H,et al. Cathepsin B contributes to TNF-alpha-mediated hepatocyte apoptosis by promoting mitochondrial release of cytochrome C[J]. Journal of Clinical Investigation,2000,106(9):1127-1137.
[6] Foghsgaard L,Wissing D,Mauch D,et al. Cathepsin B acts as a dominant execution protease in tumor cell apoptosis induced by tumor necrosis factor[J]. Journal of Cell Biology,2001,153(5):999-1010.
[7] Brunk U T,Svensson I. Oxidative stress,growth factor starvation and Fas activation may all cause apoptosis through lysosomal leak[J]. Redox Report,1999,4(1/2):3-11.
[8] Yuan X M,Li W,Dalen H,et al. Lysosomal destabilization in p53-induced apoptosis[J]. Proceedings of the National Academy of Sciences of the United States of America,2002,99(9):6286-6291.
[9] Broker L E,Huisman C,Span S W,et al. Cathepsin B mediates caspase-independent cell death induced by microtubule stabilizing agents in non-small cell lung cancer cells[J]. Cancer Research,2004,64(1):27-30.
[10] Brunk U T,Dalen H,Roberg K,et al. Photo-oxidative disruption of lysosomal membranes causes apoptosis of cultured human fibroblasts[J]. Free Radical Biology &Medicine,1997,23(4):616-626.
[11] Bidere N,Lorenzo H K,Carmona S,et al. Cathepsin D triggers Bax activation,resulting in selective apoptosisinducing factor(AIF)relocation in T lymphocytes entering the early commitment phase to apoptosis[J].Journal of Biological Chemistry,2003,278(33):31401-31411.
[12] Boya P,Andreau K,Poncet D,et al. Lysosomal membrane permeabilization induces cell death in a mitochondrion-dependent fashion[J]. Journal of Experimental Medicine,2003,197(10):1323-1334.
[13] Roberg K,Kagedal K,Ollinger K. Microinjection of cathepsin D induces caspase-dependent apoptosis in fibroblasts[J]. American Journal of Pathology,2002,161(1):89-96.
[14] Vancompernolle K,Van Herreweghe F,Pynaert G,et al.Atractyloside-induced release of cathepsin B,a protease with caspase-processing activity[J]. FEBS Letters,1998,438(3):150-158.
[15] Zhang L,Sheng R,Qin Z. The lysosome and neurodegenerative diseases[J]. Acta Biochimica et Biophysica Sinica,2009,41(6):437-445.
[16] Kornfeld S,Mellman I. The biogenesis of lysosomes[J].Annual Review of Cell Biology,1989,5:483-525.
[17] Fukuda M. Lysosomal membrane glycoproteins.Structure,biosynthesis,and intracellular trafficking[J].Journal of Biological Chemistry,1991,266(32):21327-21330.
[18] Eskelinen E L. Roles of LAMP-1 and LAMP-2 in lysosome biogenesis and autophagy[J]. Molecular Aspects of Medicine,2006,27(5/6):495-502.
[19] Xu L L,Shanmugam N,Segawa T,et al. A novel androgen-regulated gene,PMEPA1,located on chromosome 20q13 exhibits high level expression in prostate[J].Genomics,2000,66(3):257-263.
[20] Tanner M M,Tirkkonen M,Kallioniemi A,et al.Increased copy number at 20q13 in breast cancer:Defining the critical region and exclusion of candidate genes[J]. Cancer Research,1994,54(16):4257-4260.
[21] Hirokawa Y S,Takagi A,Uchida K,et al. High level expression of STAG1/PMEPA1 in an androgenindependent prostate cancer PC3 subclone[J]. Cellular &Molecular Biology Letters,2007,12(3):370-377.
[22] Bai X,Jing L,Li Y,et al. TMEPAI inhibits TGF-beta signaling by promoting lysosome degradation of TGF-beta receptor and contributes to lung cancer development[J]. Cellular Signalling,2014,26(9):2030-2039.
[23] Wang L. TGFbeta induces a pro-bone metastasis program in prostate cancer[J]. Cancer Discovery,2015,5(7):23.
[24] Hidaka S,Yasutake T,Takeshita H,et al. Differences in 20q13. 2 copy number between colorectal cancers with and without liver metastasis[J]. Clinical Cancer Research,2000,6(7):2712-2717.
[25] Ishkanian A S,Mallof C A,Ho J,et al. High-resolution array CGH identifies novel regions of genomic alteration in intermediate-risk prostate cancer[J]. Prostate,2009,69(10):1091-1100.
[26] Brunschwig E B,Wilson K,Mack D,et al. PMEPA1,a transforming growth factor-beta-induced marker of terminal colonocyte differentiation whose expression is maintained in primary and metastatic colon cancer[J].Cancer Research,2003,63(7):1568-1575.
[27] Reichling T,Goss K H,Carson D J,et al. Transcriptional profiles of intestinal tumors in Apc(Min)mice are unique from those of embryonic intestine and identify novel gene targets dysregulated in human colorectal tumors[J].Cancer Research,2005,65(1):166-176.
[28] Rae F K,Hooper J D,Nicol D L,et al. Characterization of a novel gene,STAG1/PMEPA1,upregulated in renal cell carcinoma and other solid tumors[J]. Molecular Carcinogenesis,2001,32(1):44-53.
[29] Azami S,Vo Nguyen T T,Watanabe Y,et al. Cooperative induction of transmembrane prostate androgen induced protein TMEPAI/PMEPA1 by transforming growth factor-beta and epidermal growth factor signaling[J]. Biochemical & Biophysical Research Communications,2015,456(2):580-585.
[30] Li Y,Zhang Q,Tian R,et al. Lysosomal transmembrane protein LAPTM4B promotes autophagy and tolerance to metabolic stress in cancer cells[J]. Cancer Research,2011,71(24):7481-7489.
[31] Vanderlinden E,Vanstreels E,Boons E,et al. Intracytoplasmic trapping of influenza virus by a lipophilic derivative of aglycoristocetin[J]. Journal of Virology,2012,86(17):9416-9431.
[32] Settembre C,Fraldi A,Medina D L,et al. Signals from the lysosome:A control centre for cellular clearance and energy metabolism[J]. Nature Reviews Molecular Cell Biology,2013,14(5):283-296.
[33] Zhou J,Tan S H,Nicolas V,et al. Activation of lysosomal function in the course of autophagy via mTORC1 suppression and autophagosome-lysosome fusion[J]. Cell Research,2013,23(4):508-523.
[34] Luo S,Yang M,Lv D,et al. TMEPAI increases lysosome stability and promotes autophagy[J]. The International Journal of Biochemistry & Cell Biology,2016,76:98-106.
[35] Zdolsek J,Zhang H,Roberg K,et al. H2O2-mediated damage to lysosomal membranes of J-774 cells[J]. Free Radical Research Communications,1993,18(2):71-85.
[36] Antunes F,Cadenas E,Brunk U T. Apoptosis induced by exposure to a low steady-state concentration of H2O2is a consequence of lysosomal rupture[J]. Biochemical Journal,2001,356(2):549-555.
[37] Hu Y,He K,Wang D,et al. TMEPAI regulates EMT in lung cancer cells by modulating the ROS and IRS-1 signaling pathways[J]. Carcinogenesis,2013,34(8):1764-1772.
[38] Kirkegaard T,Roth A G,Petersen NH,et al. Hsp70 stabilizes lysosomes and reverts Niemann-Pick diseaseassociated lysosomal pathology[J]. Nature,2010,463(7280):549-553.

