腦梗死后血清甲狀腺激素水平與康復預后的關系
吳芳玲 舒曉燕
上海市徐匯區中心醫院康復科(上海200031)
近年來,隨著神經內分泌學的進展,腦梗死后內分泌方面的病理生理學變化,越來越受到重視,腦梗死不僅造成神經系統的結構和功能損傷,并可能導致如皮質醇、垂體性激素等一系列內分泌代謝方面的變化,這種變化是腦梗死的結果,同時又可能影響著腦梗死的預后[1-2]。
目前已有報道,甲狀腺功能可由于急性腦卒中的發生而出現異常,異常程度可能影響預后[3-4]。這種異常程度甚至與卒中性質、病灶大小均有關[5]。最近的研究認為,輕微腦血管事件如腔隙性腦梗死、短暫性腦缺血等,甲狀腺激素都可能發生應急反應,從而對遠期預后產生影響[6]。為探討腦梗死后甲狀腺功能變化與康復預后的關系,筆者回顧分析了88例腦梗死后住院康復治療的患者,分析其發病后1個月內的血清甲狀腺素水平與6個月后的康復轉歸之間的關系。
1 資料與方法
1.1 一般資料觀察對象共88例,男54例,女34例,年齡60~80歲,為2015年6月至2016年6月入住上海市徐匯區中心醫院康復科的腦梗死患者,并符合以下條件:(1)符合2010年中國急性缺血性腦卒中診療指南制定的缺血性腦血管病的診斷標準[7],且經頭顱MRI證實為左側大腦半球范圍內腦梗死;(2)首次發病,病程1周~1個月;(3)牛津郡社區卒中計劃(Oxford shire community stroke project)分型為部分前循環梗死(partial anterior circulation infarcts,PACI)型 ;(4)急 性 卒 中 治 療Org10172試驗(Trial of Org10172 in acute stroke treatment)分型為大動脈粥樣硬化(Large artery atherosclerosis,LAA)型;(5)無甲狀腺及其他內分泌疾病;(6)既往及觀察期內均不服用對下丘腦垂體靶腺有影響的藥物;(7)入選后首次日常生活活動能力(activities of daily living,ADL)[8]評分 ≤ 50。
1.2 方法
1.2.1 康復治療及分組方法所有病例康復治療期6個月。病程1周~1個月時入院,檢測血清游離三碘甲狀腺原氨酸(FT3)、TSH、TT3、TT4、FT4、rT3,進行ADL評分(ADL1)。行常規抗血小板聚集、清除自由基、腦細胞保護及對癥治療,根據入院康復評定進行個體化康復訓練,包括偏癱肢體訓練、言語、認知、吞咽訓練、作業訓練等。治療訓練6個月后重新進行ADL評分(ADL2)。以ADL2-ADL1值作為康復預后評判指標,差值越大,預后越好。根據預后將患者分成3組,第1組ADL評分的差值≤25,第2組ADL評分的差值介于25~45,第3組ADL評分的差值≥45分,各組臨床資料見表1。
表1 各組臨床資料比較Tab.1 Comparison of clinical data ±s
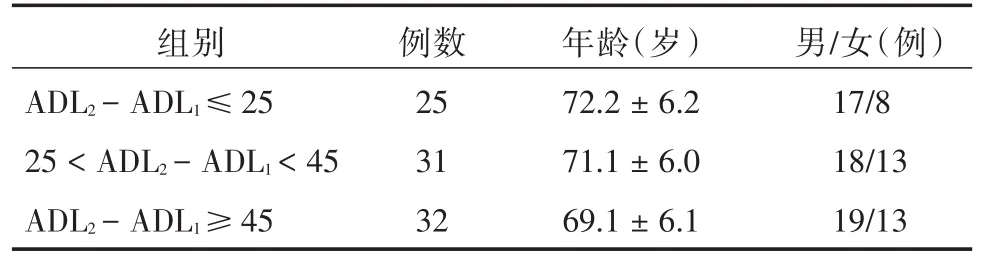
表1 各組臨床資料比較Tab.1 Comparison of clinical data ±s
1.2.2 甲狀腺激素檢測方法取清晨靜脈血4 mL,4 000 r/min離心20 min,取上清液;西門子ADVIA Centaur XP全自動化學發光免疫分析儀及配套試劑盒自動檢測。
1.3 統計學方法采用SPSS 21統計軟件進行統計分析,各組數據以±s表示。進行單因素方差分析,方差齊性檢驗后計算統計值F值或Welch值進行均值比較,Games-Howell進行兩兩比較,取α=0.05,P<0.05為差異有顯著性,P<0.01為差異有高度顯著性。
2 結果
各組血清甲狀腺激素濃度見表2,單因素方差分析結果示各組僅FT3濃度差異有顯著性(P<0.01),其他各項指標差異無顯著性(P>0.05)。Games-Howell進行兩兩比較顯示:FT3值越低,康復預后越好(P<0.01)。
表2 各組血清甲狀腺激素濃度比較Tab.2 Comparison of serum thyroid hormone concentration ±s
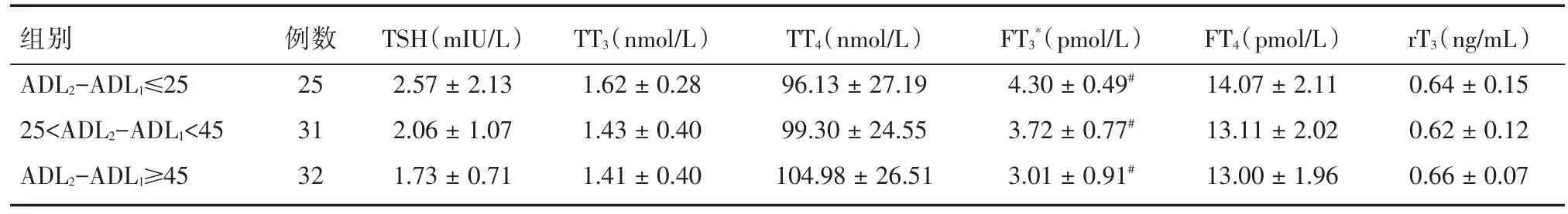
表2 各組血清甲狀腺激素濃度比較Tab.2 Comparison of serum thyroid hormone concentration ±s
注:單因素方差分析,*P<0.01;Games-Howell兩兩比較,#P<0.01
3 討論
ADL評分是患者生活自理能力的綜合評定,它包括了穿衣吃飯、洗漱轉移、行走爬樓、二便控制等能力評定,患者在完成這些日常活動的過程中,不僅需調動肢體運動能力,也需使用自身認知判斷交流功能,因此,康復治療前后ADL評分的差值更能反映患者的恢復程度。
大量報道認為腦血管病急性期,體內甲狀腺激素水平發生變化,較多的報道是發生低T3綜合征[9],T3的下降一方面考慮為下丘腦-垂體-甲狀腺軸的直接受損,抑制了TSH-TRH的分泌,另一方面考慮機體處于較為嚴重的內環境紊亂狀態,多臟器受損,甲狀腺激素生成的物質基礎缺乏[10]。這種變化也可能是機體在應激狀態下的一種自我保護機制,以抑制甲狀腺激素的分泌來減少產熱及能量物質的分解,使機體處于低代謝狀態,保證重要器官的供能[11]。首先受到影響的是直接起生物學作用的FT3,FT3可以通過細胞膜與受體結合發揮生理效應,因此它是甲狀腺激素發生生理效應的真正活性部分。FT3來自呈結合狀態的T3,T3的大部分是由T4轉化所生成,少部分由甲狀腺分泌。本研究結果顯示,腦梗死后早期,只有FT3與6個月后的預后相關,其他不直接發揮生物活性的甲狀腺激素,可能也發生了變化[12],但這些變化與預后無明顯關聯。
許多報道認為,腦梗死急性期FT3下降程度與病情嚴重程度及預后相關,FT3越低,病情越嚴重、預后越差[4,13]。而隨著病情的好轉,T3一般可恢復正常。但這些報道中,FT3明顯下降、預后極差的患者,都是大面積梗死或腦干梗死患者[14],這些患者本身就病情危重,造成的嚴重腦水腫或丘腦缺血,可嚴重擠壓或直接破壞丘腦、垂體的神經內分泌細胞,從而因TRH、TSH的分泌障礙導致外周甲狀腺激素水平下降[15]。
而本研究的結果則相反,發病早期,FT3越低,其6個月后的康復預后越佳。這可能與觀察對象的選擇有關。本研究的觀察對象局限于PACI+LAA型,排除了后循環梗死對下丘腦-垂體神經分泌細胞的直接損害,也排除了大面積前循環型梗死造成的嚴重腦水腫、過度應激對下丘腦-垂體造成的嚴重擠壓,所有觀察對象病情嚴重程度變異度低。但入選觀察的病例發病1個月內的ADL評分≤50,且為左大腦半球梗死,也排除了輕微腦血管事件病例。筆者認為,這些患者腦梗死后出現低FT3的機制,可能不同于一些研究推測的那樣,是下丘腦-垂體-甲狀腺軸遭受損傷后的功能破壞[16],也沒有甲狀腺激素分泌的下降,而是外周T3向FT3的轉化受到抑制,以減少產熱及能量物質的分解,維持機體處于低代謝狀態,保證重要器官的供能。這是機體的一種積極應對損害的自我保護能力,這種自我保護能力越強,機體損傷后的自我修復及對康復治療的應答能力則越強,所以在本研究中可以發現,腦梗死后,FT3值越低的患者,其康復療效越好。因此,排除病情極重或輕微對預后的影響,腦梗死患者疾病早期的血清FT3值對康復治療的預后有提示作用。
[1]KATAN M,FLURI F,MORGENTHALER N G,et al.Copeptin:a novel,independent prognostic marker in patients with ischemic stroke[J].Ann Neurol,2009,66(6):799-808.
[2]URWYLER S A,SCHUETZ P,FLURI F,et al.Prognostic value of copeptin:one-year outcome in patients with acute stroke[J].Stroke,2010,41(7):1564-1567.
[3]TOGNINI S,MARCHINI F,DARDANO A,et al.Non-thyroidal illness syndrome and short-term survival in a hospitalized older population[J].Age Ageing,2010,39(1):46-50.
[4]ZHANG Y,MEYER M A.Clinical analysis on alteration of thyroid hormones in the serum of patients with acute ischemic stroke[J].Stroke Res Treat,2010,3:1-5.
[5]劉運林,陸寅,邢詒剛.急性腦血管病血清和腦脊液甲狀腺素的變化及其臨床意義[J].實用醫學雜志,2006,22(8):902-903
[6]ZHANG X,XIE Y,DING C,et al.Subclinical hypothyroidism and risk of cerebral small vessel disease:A hospital-based observational study[J].Clin Endocrinol,2017,87(5):581-586.
[7]中華神經病學分會腦血管病學組急性缺血性腦卒中診治指南撰寫組.中國急性缺血性腦卒中診治指南[J].中華神經科雜志,2010,43(2):146-153.
[8]黃曉琳,燕鐵斌.康復醫學[M].5版.北京:人民衛生出版社,2013:94-95.
[9]SQUIZZATO A,GERDES V E,BRANDJES D P,et al.Thyroid diseases and cerebrovascular disease[J].Stroke,2005,36(10):2302-2310.
[10]PARLE J V,MAISONNEUVE P,SHEPPARD M C,et al.Prediction of all cause and cardiovascular mortality in elderly people from one low serum thyrotropin result:a 10-year cohort study[J].Lancet,2001,358(9285):861-865.
[11]OSHINAIKE O,OGBERA A,AZENABOR A,et al.Effect of sub-clinical hypothyroidism on clinical severity in first-ever acute ischemic stroke[J].Nig Q J Hosp Med,2015,25(2):95-98.
[12]CHAKER L,BAUMGARTNER C,DEN ELZEN W P,et al.Subclinical hypothyroidism and the risk of stroke events and fatal stroke:An individual participant data analysis[J].Clin Endocrinol Metab,2015,100(6):2181-2191.
[13]劉安民,畢桂南,童偉林,等.急性腦血管病甲狀腺功能改變與NIHSS和年齡的相關性[J].醫學綜述,2015,21(11):2052-2054.
[14]ALEVIZAKI M,SYNETOU M,XYNOS K,et al.Low triiodothyronine:a strong predictor of outcome in acute stroke patients[J].Eur J Clin Invest,2007,37(8):651-657.
[15]QURESHI A I,SURI F K,NASAR A,et al.Free thyroxine index and risk of stroke:results from the national health and nutrition examination survey follow-up study[J].Med Sci Monit,2006,12(12):501-506.
[16]LANIA A,PERSANI L,BECK-PECCOZ P.Central hypothyroidism[J].Pituitary,2008,11(12):181-186.

