半夏兩種愈傷組織結構及細胞壁成分比較
胡珊珊, 張明生,呂 享,李小蘭,李 歡
(貴州大學 生命科學學院/國家喀斯特石漠化防治工程技術研究中心, 山地植物資源保護與種質創新教育部重點實驗室, 貴州 貴陽 550025)
半夏[Pinelliaternata(Thunb.) Breit.].為天南星科多年生草本植物,是我國傳統重要中藥材之一,具有燥熱化痰、降逆止嘔、消痞散結等功效[1]。近年來,由于人們對野生半夏的掠奪性采挖,導致其自然資源急劇減少,人工種植是半夏產業可持續發展的必由之路,但長期采用塊莖繁殖導致病害嚴重、種質退化、產量下降[2-6]等一系列問題。半夏人工種子技術已成為近年來的研究熱點[7-9],但半夏人工種子生產中同步化的人工種胚至今仍難獲得,其根本原因在于半夏疏松愈傷組織誘導困難,嚴重限制半夏人工種子的產業化。疏松愈傷組織增殖快,通過懸浮培養,可獲得大量均一分散的同步化人工種胚。致密愈傷組織細胞連接緊實而不易分散,不適于作懸浮培養材料。果膠為細胞壁胞間層主要成分,其作用有助于將相鄰細胞粘連在一起。纖維素存在于細胞壁的初生壁和次生壁中,可使細胞維持一定形狀和延展性。程杰山等[10]研究了不同硬度的辣椒品質在果實發育中果膠、纖維素等的含量變化,發現果膠和纖維素含量變化對不同品系辣椒硬度可能有較大影響。所以,本研究通過對半夏疏松愈傷組織和致密愈傷組織進行石蠟切片顯微觀察其結構,并分析愈傷組織果膠、纖維素和半纖維素含量,比較研究兩種愈傷結構和細胞壁成分差異,以期為進一步研究疏松愈傷組織形成機理奠定理論基礎。
1 材料與方法
1.1 材料
半夏[Pinelliaternata(Thunb.) Breit.]由貴州省赫章縣半夏藥材基地提供。
1.2 方法
愈傷組織的誘導:選擇生長15 d的半夏無菌苗,切取葉柄(0.5 cm)作為外植體備用。以MS為基本培養基,加入蔗糖30 g/L,瓊脂6.0 g/L,并添加不同質量濃度的2,4-D和6-BA。培養條件:培養基pH 5.8,培養溫度(25±1)℃,光照強度2000 lx,光照時間12 h/d。愈傷組織誘導率 = 形成愈傷組織的半夏葉柄數/接入半夏葉柄總數100%。
愈傷組織結構觀察及果膠定位:采用常規石蠟切片法[11],選取誘導出的最疏松和致密的愈傷組織后,用50%福爾馬林-乙酸-酒精(FAA)固定液固定,經過酒精梯度脫水、透明、石蠟包埋、番紅/釕紅-固綠雙重染色、中性樹膠封片等過程,制成永久切片,顯微鏡觀察并拍照。果膠定位與常規石蠟切片法過程相同,番紅染色替換為釕紅染色20~30 min即可。
愈傷組織果膠、纖維素和半纖維素的測定:果膠含量采用咔唑-濃硫酸法測定[12],纖維素含量采用蒽酮比色分光光度法測定[13],半纖維素含量采用2 mol/L鹽酸水解法測定[14]。
1.3 數據分析
試驗數據采用Microsoft Excel 2007、SPSS 17.0和GraphPad Prism 7.0軟件進行統計學分析。
2 結果與分析
2.1 2,4-D與6-BA組合對半夏愈傷組織誘導的影響
不同濃度2,4-D與6-BA組合對半夏愈傷組織誘導率影響的差異不大,但對其質地有顯著影響(表1和圖1)。外植體接種10 d后,開始出現灰白色愈傷組織,繼續培養,觀察到處理4的愈傷組織增殖快,質地較疏松,呈淡黃色(圖1 A)。將其培養28~30 d后轉到繼代培養基上培養,以28~30 d繼代一次,繼代2~3次可獲得顏色淡黃、結構疏松的愈傷組織,該疏松愈傷組織即可通過懸浮培養以獲得同步化人工種胚用于半夏人工種子制作。其它處理的愈傷組織的質地均不如處理4的疏松,不適宜用作懸浮培養獲得疏松愈傷組織。處理9的愈傷組織增殖慢,質地緊實,繼續培養其顏色逐漸變黃加深,并出現分化現象(圖1 B)。
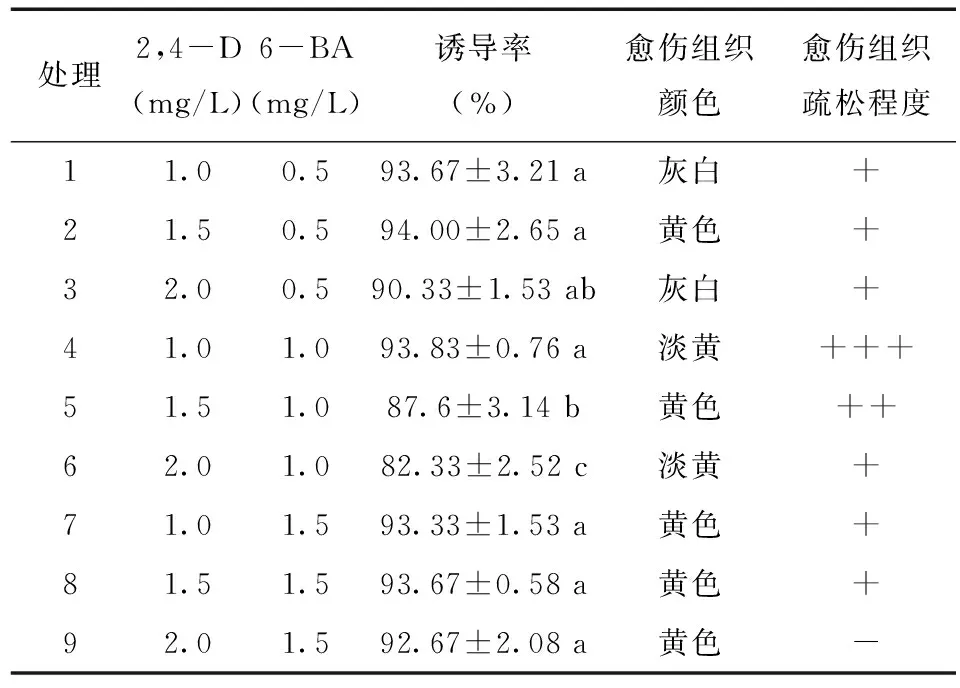
表1 2,4-D與6-BA組合對半夏愈傷組織誘導的影響Tab.1 Effects of 2,4-D and 6-BA concentration on callus induction

圖1 接種10 d后的半夏愈傷組織Fig.1 Callus of P. ternata 10 days after inoculating
2.2 半夏兩種愈傷組織結構及細胞壁成分差異
與致密愈傷組織(圖2 A)相比,半夏疏松愈傷組織的結構較松散,細胞及胞間間隙較大,細胞壁較薄(圖2 B)。
致密愈傷組織的化學成分定位顯示,其細胞壁及細胞間隙中同時存在著色為綠色的纖維素部分及著色為紫色的果膠和纖維素的混合部分(圖2 C),綠色較深,說明其細胞壁纖維素含量較高;而紫色部分較淺,說明其果膠含量較低,即中膠層中細胞粘結物果膠質很少水解成果膠,細胞間連接緊密。疏松愈傷組織的化學成分定位顯示出細胞壁及細胞間隙幾乎僅存在著色為紫色的果膠與纖維素的混合部分(圖2 D),顏色較深,說明其果膠含量較高,即中膠層中細胞粘結物果膠質大量水解成果膠,細胞間連接被解除,使其愈傷組織細胞松散;而綠色極少,說明其細胞壁纖維素合成較少,含量甚微,使細胞壁剛性減弱,細胞生長加快。
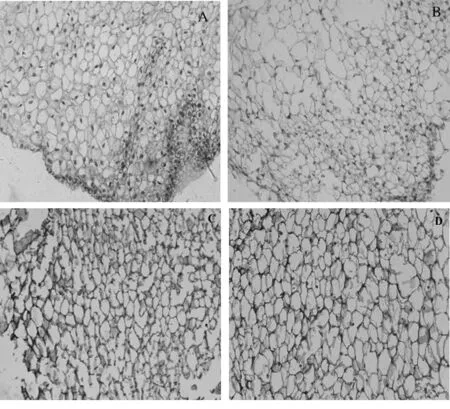
A: 致密愈傷組織番紅-固綠染色切片; B: 疏松愈傷組織番紅-固綠染色切片; C: 致密愈傷組織釕紅-固綠染色果膠定位切片; D: 疏松愈傷組織釕紅-固綠染色果膠定位切片
化學成分含量分析結果表明,半夏愈傷組織形成過程中,疏松愈傷組織的果膠含量顯著高于致密愈傷組織,是致密愈傷組織的1.2~2.9倍(P0.05),培養28 d后急劇增加,而致密愈傷組織的果膠含量則一直下降(圖3)。致密愈傷組織的纖維素含量顯著高于疏松愈傷組織,是疏松愈傷組織的1.9~2.9倍(P0.05),且一直呈上升趨勢,而疏松愈傷組織則有增有減,變幅較小,培養28 d后一直呈下降趨勢(圖4)。

圖3 半夏愈傷組織形成過程中果膠含量變化Fig.3 Veriation of pectin contents during callus formation of P. ternata
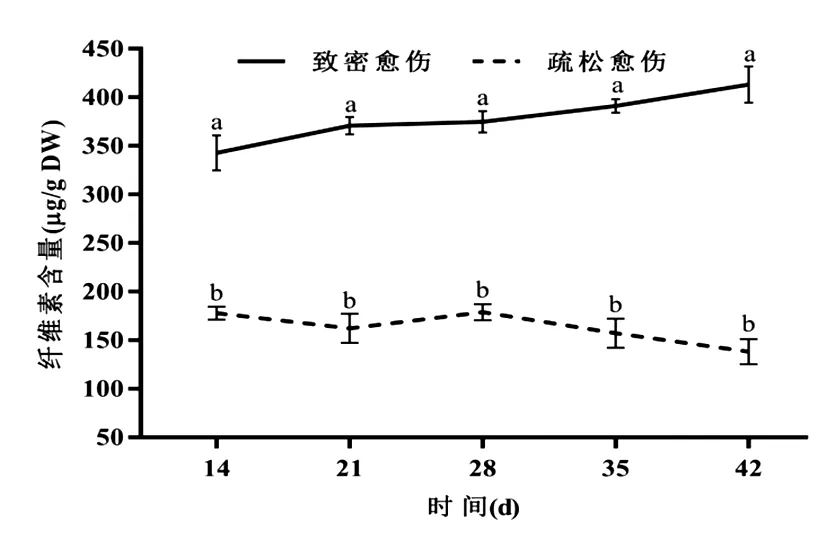
圖4 半夏愈傷組織形成過程中纖維素含量變化Fig.4 Changes of cellulose contents during callus formation of P. ternata
化學成分含量分析結果與化學成分定位結果有高度的一致性。該研究結果暗示,植物生長調節物質(如2,4-D和6-BA)對半夏愈傷組織形成的類型起著決定性作用,若要獲得適于懸浮培養的疏松愈傷組織,則須通過對培養條件的調節(如調節2,4-D與6-BA的配比)以抑制細胞壁纖維素的合成并促進中膠層中果膠質的水解。
3 結論與討論
植物細胞壁由多糖類、木質素、結構蛋白、無機離子等相互連接而成,而多糖類根據化學提取的難易程度可分為果膠質、纖維素和半纖維素。而植物組織的疏松或致密程度主要與果膠質和纖維素有密切關系。果膠質主要位于細胞間中膠層,是粘結相鄰細胞、使組織堅實的重要成分;纖維素是細胞壁的主要成分,是維持植物細胞形態、增強細胞機械強度的物質,因其具有剛性而在一定程度上限制細胞的生長。在植物組織培養進行愈傷組織的誘導和增殖過程中,有時需要獲得疏松愈傷組織,尤其是通過細胞懸浮培養同步化誘導產生體細胞胚用于人工種子生產時,疏松愈傷組織更是必不可少。然而,很多植物的組織培養卻難以得到疏松愈傷組織,半夏就是其中之一[8-9,15]。眾所周知,植物生長調節物質在愈傷組織誘導過程中發揮重要作用,生長素與細胞分裂素的適宜配比可有效地誘導愈傷組織產生[16-17],常用的生長素有2,4-D和NAA等[18-19],細胞分裂素有6-BA和KT等[20]。本研究通過2,4-D與6-BA組合試驗,篩選出了誘導半夏疏松愈傷組織的最佳激素組合,即在基本培養基中添加1 mg/L 2,4-D和1 mg/L 6-BA。當然,影響植物組織疏松與致密的因素可能還有很多,尚需進一步深入研究。
參考文獻:
[1] 國家藥典委員會. 中華人民共和國藥典(2010版一部)[M]. 北京: 中國醫藥科技出版社, 2010.
[2] Hu XF, Fang QL, Li SX,etal. Isolation and characterization of endophytic and rhizosphere bacterial antagonists of soft rot pathogen fromPinelliaternata.[J].FEMSMicrobiologyLetters, 2009, 295(1): 101-106.
[3] 馬小軍, 李西文, 杜 鵑, 等. 加權打分法定量評價半夏種質資源的研究[J]. 中國中藥雜志, 2006, (12): 975-977.
[4] 章艷玲, 李關榮, 位運糧. 中藥半夏的研究進展[J]. 中國農學通報, 2007, 23(7): 163-167.
[5] 賈君君, 李 婷, 李 敏, 等. 影響半夏產量因素分析[J]. 世界科學技術(中醫藥現代化), 2009, 11(04): 562-565.
[6] 李 花, 張明生, 彭斯文, 等. 半夏不同種植模式的經濟效益分析[J]. 世界科學技術(中醫藥現代化), 2009, 11(04): 566-569.
[7] 薛建平, 張愛民, 盛 瑋, 等. 半夏人工種子貯藏技術的研究[J]. 中國中藥雜志, 2005, 30(30): 1820-1823.
[8] 張明生, 李 花. 半夏人工種子制作技術及其萌發研究[J]. 種子, 2009, 28(11): 4-6, 10.
[9] 申起飛, 張明生, 李立青, 等. 生長調節物質對半夏人工種胚形成的影響[J]. 山地農業生物學報, 2014, 33(03): 33-36.
[10] 程杰山, 沈火林, 楊學妍, 等. 不同硬度辣椒品系果實組織結構觀察與細胞壁物質含量測定[J]. 西北農業學報, 2008, 17(1): 150-156.
[11] 李正理. 植物制片技術(第二版)[M]. 北京: 科學出版社, 1978.
[12] 趙 偉, 杜映達, 國 微, 等. 北五味子果實中果膠的超聲提取工藝研究[J]. 天然產物研究與開發, 2014, 26(08): 1316-1320.
[13] 李合生. 植物生理生化實驗原理和技術[M]. 北京: 高等教育出版社, 2000.
[14] 安玉民, 王菊葵, 黃 燁, 等. 馬鈴薯秸稈中纖維素與半纖維素含量的測定[J]. 現代農業科技, 2016 (17): 159-160.
[15] 劉貴賢, 張明生, 李小蘭, 等. 適于懸浮培養的半夏疏松愈傷組織誘導及增殖技術[J]. 山地農業生物學報, 2016, 35(01): 82-85, 94.
[16] 李代麗, 康向陽. 植物愈傷組織培養中內外源激素效應的研究現狀與展望[J]. 生物技術通訊, 2007 (03): 546-548.
[17] 王小菁. 植物生長調節劑在植物組織培養中的應用[M]. 北京: 化學工業出版社, 2010.
[18] 黃衡宇, 王美蓉. 紫背金盤愈傷組織誘導與再生體系的建立[J]. 中草藥, 2014, 45(09): 1313-1318.
[19] 韋 瑩, 黃雪彥, 韋坤華, 等. 箭根薯愈傷組織誘導及無性系的建立[J]. 中草藥, 2013, 44(17): 2466-2470.
[20] 李浚明, 朱登云, 植物組織培養教程[M]. 北京: 中國農業大學出版社, 2005.

