異福片中利福平有關雜質研究
張濤 孫婷 黃靈勇 徐艷 王東凱
(1沈陽藥科大學 遼寧 本溪 117004)
(2沈陽沃森藥物研究所 遼寧 沈陽 110016)
異福片是利福平和異煙肼組成的固定劑量復方制劑(Fixed Dose Combination,FDC),由賽諾菲-安萬特公司于上世紀研發。該品種現收載于國際藥典、英國藥典、中國藥典等,已列入預認證(Prequalification Program, PQ)品種目錄。本課題是中國衛生部-蓋茨基金會結核病防治項目中“中國抗結核FDC藥品的質量保證”子項目的一部分。本課題參照ICH指導原則開展了分析方法驗證和降解雜質研究,為制藥企業開展高端仿制藥雜質研究提供參考依據。
1.儀器與材料
1.1 儀器和設備
Agilent1200型高效液相色譜儀(配有在線脫氣機、四元泵、自動進樣器、UV檢測器和Chemstation工作站,美國Agilent公司),高純水機,微孔濾膜及過濾裝置。
1.2 試劑和試藥
利福平對照品(批號:L0J351,USP),異煙肼對照品(批號:10G205,USP),衛非寧Rifinah(規格:福平300mg/異煙肼150mg;批號:A1462;諾菲-安萬特公司意大利工廠生產),利福平原料藥(漯河南街村藥業集團制藥有限公司生產),異福片(規格:利福平300mg/異煙肼150mg;批號:130501YF、130502YF和130601YF;華北制藥股份有限公司生產,高密度聚乙烯瓶、鋁塑鋁封口簽),醌式利福平對照品(批號:130413-201104,純度94.6%,中國食品藥品檢定研究院),甲醇為色譜純,磷酸二氫鉀和乙酸為分析純,水為超純水。
2.方法與結果
2.1 溶液的制備
稀釋液:取甲醇和pH7.0磷酸鹽緩沖液適量,按體積比4∶6混合后備用。
供試品溶液:取待測樣品20片,研細。取該粉末適量,使含利福平約40mg,精密稱定,加入200mL稀釋液中充分振搖,濾過,即得。
對照溶液:精密量取供試品溶液5mL,置100mL量瓶中,加稀釋液定容,充分振搖,即得。
對照品溶液:精密稱取利福平對照品適量,置于50mL量瓶中,加入稀釋液溶解并制成每1mL中約含0.2mg利福平的溶液,作為利福平對照品溶液。精密稱取異煙肼對照品適量,置于50mL量瓶中,加入稀釋液溶解并制成每1mL中約含0.1 mg異煙肼溶液,作為異煙肼對照品溶液。
2.2 色譜條件
色譜柱:Agilent C18柱(25cm×4.6mm,5μm);流動相:甲醇-pH7.0磷酸鹽緩沖液(6∶4);流速1.0mL/min;檢測波長:254nm;進樣量:20μl。
測定過程:溶液臨用現配,避光操作。HPLC系統適用性試驗通過后,取上述對照溶液和供試品溶液,依次注入液相色譜儀,記錄色譜圖。按主成分自身對照法以保留時間對各雜質定位、以峰面積計算各雜質的量,即得。色譜圖上,面積小于0.02倍主成分峰的色譜峰(0.1%)和相對保留時間小于0.23的色譜峰忽略不計。[2]
2.3 方法學驗證
2.3.1 系統適用性試驗 取雜質對照品溶液,照2.2項下色譜條件測定。結果,利福平峰和醌式利福平峰的分離度大于4,系統適用性良好。
2.3.2 專屬性 依次注入異煙肼、利福平、醌和腙的對照品溶液,結果異煙肼出峰時間在2.5 min左右,RRT小于0.23,不干擾雜質測定;醌、腙和利福平分離良好,互不干擾。按照異福片處方制備不含利福平的空白溶液,在2.2色譜條件下測定。結果在利福平和各雜質出現的位置無色譜峰出現,表明溶劑和輔料對雜質測定結果無干擾。
2.3.3 檢測限 精密稱取利福平對照品適量,定量稀釋成系列低濃度溶液,峰值信號與基線噪音比較,信噪比為3∶1時的濃度為 0.1261μg·mL-1。
2.3.4 定量限 精密稱取利福平對照品適量,定量稀釋成系列低濃度溶液,峰值信號與基線噪音比較,信噪比為10∶1時的濃度為 0.3301μg·mL-1。
2.4 樣品測定
2.4.1 異福片中雜質實際水平 取3批異福片,照2.2色譜條件測定有關物質。結果,異福片中平均水平大于0.1%(報告閾值)的雜質有6個,同時也大于0.2%(鑒別閾值和界定閾值)[3],見表。
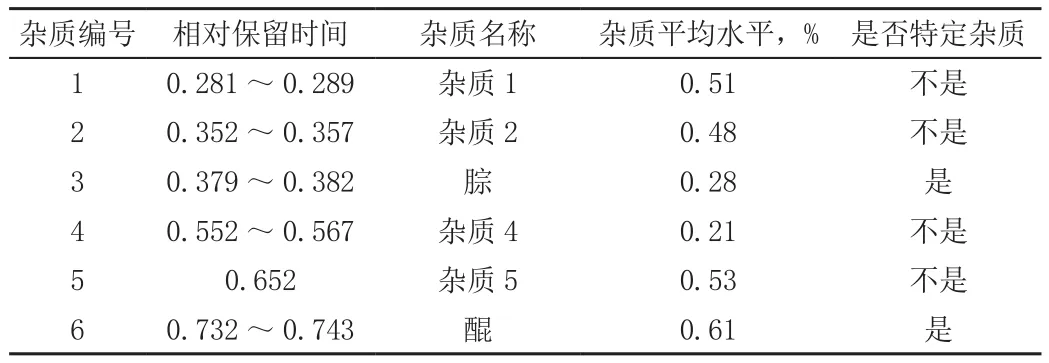
表 異福片中實際雜質情況Tab.Actual impurity of Rifampicin and Isoniazid Tablets
在一定條件下,制劑中的利福平可發生水解(主要形成3-甲酰利福霉素及25-去乙酰基利福平)和氧化(主要形成醌式利福平和N-氧化利福平),還可與異煙肼發生化學反應形成腙[2]。另外,利福平原料藥中還可能存在利福霉素SV。
測定利福平對照品(USP)和參比制劑(Rifinah)的有關物質可知,利福平對照品中含有1、2、4、5號雜質,參比制劑中含有1、4號雜質。這些雜質超過了鑒定閾值,可認為經過了安全評估。供試品中這些雜質的平均水平沒有超過法定對照品或參比制劑的水平,是安全的。
2.4.2 強光照射 根據利福平原料藥遇光變質的特性,設計試驗考察強光對雜質的影響以及包裝對產品的保護作用。取同一批號的異福片60片,隨機分成三份,每份20片。其中一份為裸片、一份為裸片外包裹鋁箔、一份為市售包裝,并列平鋪擺放,置光照箱內接受冷白日光燈和近紫外燈連續照射。分別于第5天和第10天取樣,依2.2色譜條件測定有關物質。結果,異福片裸片中醌有明顯增加,市售包裝及暗對照幾乎沒有變化。
2.4.3 雜質分析及控制 綜合以上結果,因為輔料和異煙肼在2.2色譜條件下沒有雜質峰,而利福平有,因此,可以確定這些雜質都是利福平有關雜質,或為利福平降解產生或為利福平帶入。醌是利福平經光照或氧化的降解產物,易生成、增速快,生產中應避光操作、保證產品密封性,必要時充氮。腙是利福平與異煙肼反應的產物,易生成、增速快,在有水的情況下反應更快[4],生產中宜采用減少接觸、干法制粒并嚴格控制顆粒水分等措施來保證。雜質1在高濕下增長明顯,可能為利福平水解產物,生產中應嚴格控制顆粒水分。雜質2在高溫下增長明顯,應為利福平降解產物。雜質4和5在高溫高濕及加速條件下幾乎不增長,可能為利福平帶入的工藝雜質,需完善利福平采購標準來控制。
3.討論
3.1 在抗結核FDC的活性成分中,異煙肼為化學合成,性質穩定,純度高,4個特定雜質均在0.1%以下,可以忽略。而利福平為發酵產物,純度較低,雜質多,易降解和水解。因此,本研究重點考察了利福平的相關雜質。
3.2 本文研究了利福平相關雜質,確定了各雜質的來源、檢測方法和限度要求,便于生產和質量控制。其中醌和腙是最易增長的兩種雜質,需要單獨控制。
3.3 本研究證明了國產異福片通過優化工藝、加強過程控制和提高質量標準,可以使其雜質控制水平獲得提升,符合國際藥典標準。
3.4 本研究中1,2,4,5號雜質雖然超過了ICH推薦的鑒定閾值和界定閾值,但經過了評估,可依據“其它單個雜質”項進行控制。在這里,筆者認為藥典中有關物質項下的“其它單個雜質”即“any other peak”,應當是制藥企業或上市許可持有人研究過并被批準列入內控質量標準中的雜質,而非任意的其它未知雜質。其它未知雜質仍要按照ICH Q3的原則進行控制。
3.5 本研究中一些雜質沒有最終確定化合物結構,下一步將繼續對它們進行深入研究。
【參考文獻】
[1]The International Pharmacopoeia(國際藥典).2017.Seventh Editon.http://apps.who.int/phint/en/p/docf/
[2]ICH Q3B(國際人用藥品注冊與醫藥技術協調會議 Q3B新藥制劑中的雜質).2006.第二版:70-80.
[3]李冰,姚蘭,孫曉軍.抗結核固定劑量復方制劑有關物質的測定[J].中國醫藥工業雜志,2012,43(3):208-211.

